河川沙塘鳢DMRT1基因的克隆及其表达分析
张红燕,朱文旭,赵 诚,张宏叶,王 涛,陈树桥,尹绍武,贾永义
(1.南京师范大学生命科学学院,海洋科学与工程学院,南京 210023;2.浙江省淡水水产研究所,农业部淡水渔业健康养殖重点实验室,浙江省淡水水产遗传育种重点实验室,浙江湖州 313001;3.南京市水产科学研究所,南京 210036)
鱼类的性别决定机制具有多样性、易变性和原始性等特点[1],可分为单性(unisexuality)、雌雄同体(hermaphroditism)和雌雄异体(gonochorism)[2]。绝大多数鱼类为雌雄异体,少数鱼类雌雄同体[3]。硬骨鱼的性别决定一般取决于遗传和环境两大因素,而且这种作用具有可塑性[3]。多种环境因素如外源激素、温度、pH、水质以及盐度等都可能影响性别决定,但是决定性别的基础是遗传基因。随着分子生物学技术的不断发展[4],鱼类性别决定相关基因如 DMY基因[5]、芳香化酶基因[6]、Sox基因家族[7]和 DMRT基因家族[15-20]等都被广泛研究报道。
DMRT(double-sex and mab-3 related transcription factor)基因家族的成员与性别决定和分化相关,其中DMRT1基因在演化过程中具有高度的保守性[8]。DMRT1基因位于级联反应的上游,作为转录调控因子,对雄性性腺的形成和功能的维持、多种组织和器官的分化和形成具有重要意义[9]。在无脊椎动物果蝇(Drosophila melanogaster)和线虫(Caenorhabditis elegans)的性别决定基因中发现了共有的DM结构域[10];在脊椎动物的两栖类如黑斑蛙(Pelophylax nigromaculatus)中DMRT1基因在雄性性腺中特异性表达[11];鸟类DMRT1蛋白的表达量减少会导致胚胎中雄性(ZZ)性腺的雌性化[12];小鼠(Musmusculus)的DMRT1基因调控精原细胞的发育及分化[13];人类若发生DMRT1基因的片段缺失会阻碍精巢的发育[14]。DMRT1基因在鱼类中广泛存在,目前在斑马鱼(Danio rerio)[15]、青鳉(Oryzias latipes)[16]、尼罗罗非鱼(Oreochromis niloticus)[7]、奥 里 亚 罗 非 鱼 (Oreochromisco aureus)[2]、非洲胡子鲶(Clarias gariepinus)[17]、乌鳢(Channa argu)[18]、西 伯 利 亚 鲟 (Acipenser baerii)[19]等鱼类中已进行过广泛的报道研究,DMRT1可作为斑马鱼幼苗时期性别决定的指示基因[15],能够调节青鳉精原细胞的分化[16]。此外,该基因被认为是尼罗罗非鱼精巢分化的分子标记[7],由此可见,DMRT1基因参与了脊椎和无脊椎动物的性别决定和分化过程[20]。
河川沙塘鳢(Odontobutis potamophila),又名虎头鲨、塘蒲、土布鱼、虎头呆子等,分布于长江、闽江、钱塘江等水域,是一种小型淡水底栖的肉食性鱼类。其肉质鲜美、细嫩可口,深受人们欢迎,具有广阔的市场开发前景[21]。目前在江浙沪等地区,虽然广泛开展河川沙塘鳢的混养和套养[22],但产量仍不能满足日益增大的消费需求。河川沙塘鳢在生长速度方面显示出明显的性别二态性,表现为雄性河川沙塘鳢比同期雌性生长速度快30%以上[23],因此养殖雄性个体比雌性个体有着更大的经济效益。然而,目前关于河川沙塘鳢性别决定机制方面的研究非常有限,这很大程度上阻碍了河川沙塘鳢的遗传育种研究。DMRT1基因作为一个保守的性别决定基因,其研究对于开展河川沙塘鳢单性育种技术具有重要意义。因此,本文首次克隆河川沙塘鳢的DMRT1的全长基因,并采用qRT-PCR技术研究DMRT1基因在其不同组织、不同发育阶段的性腺以及不同时期的胚胎中的表达情况,旨在为河川沙塘鳢性别决定分子机制的解析提供基础资料,也为今后河川沙塘鳢开展全雄育种打下坚实基础。
1 材料与方法
1.1 实验材料
河川沙塘鳢取自江苏省南京市水产科学研究所周岗基地。暂养于循环缸内7 d,确定无病后开始取样。在胚胎发育期间,在8个不同的发育阶段(受精卵期、桑椹胚期、原肠胚期、神经胚期、体节期、口裂期、出膜后1 d、出膜后3 d)取样,每个胚胎时期各取30粒卵,孵化后1 d、3 d各取10尾仔鱼;此外,随机取3尾成鱼[雌雄均为1龄生,体质量为(30.0±1.5)g]的 8种组织:鳃、肠、心、肌肉、脑、肝、脾、性腺以及4个不同发育时期的性腺(河川沙塘鳢的性腺分期的标准均参考中华乌塘鳢 Bostrichthys sinensis)[24],取样后迅速置于液氮中冷冻10 min,然后存放于-80℃冰箱中备用。PCR引物购自上海生物工程有限公司;高纯总RNA快速抽提试剂盒(离心柱型)购自诺唯赞公司,美国;SMARTerTMRACE cDNA AmplificationKit购自Clontech公司,美国;荧光定量试剂盒Faststart Universal SYBR Green Master购自罗氏公司,瑞士;反转录试剂盒HiScript TM QRT SuperMix for qPCR(+gDNA wiper)购自诺唯赞公司,美国。
1.2 DMRT1基因总RNA的提取
将冻存于-80℃的组织根据高纯度总RNA快速抽提试剂盒的说明按步骤抽提总RNA。每个样品的RNA浓度及纯度用RNA浓度测定仪(Thermo,NANO DROP 2000C,北京)测定(OD260/OD280=1.95~2.05),用 1%琼脂糖凝胶电泳检测其完整性。
1.3 DMRT1基因cDNA的全长扩增
以河川沙塘鳢总 RNA为模板,按照HiScriptTM1 ST Strand cDNA Synthesis Kit的说明进行操作,反转录得到cDNA第一条链。根据在河川沙塘鳢转录组测序所得的cDNA文库进行筛选,得到DMRT1基因的cDNA中间EST序列,长度约为894 bp,根据其设计 5′RACE和 3′RACE序列扩增引物,分别按照的5′RACE System for Rapid Amplification of cDNA Ends Version 2.0试剂盒和Clontech公司的SMARTerTMRACE cDNA Amplification Kit试剂盒的方法进行操作。扩增基因所需的引物见表1。

表1 DMRT1基因扩增所用引物Tab.1 Primers used for DMRT1 genes amplification
1.4 DMRT1基因的生物信息学分析
将DMRT1保守区片段、3′端序列及5′端序列进行拼接,得到DMRT1序列的总长,其结果用DNAStar软件进行统计分析。使用BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)进行检索,得到与河川沙塘鳢开放阅读框(ORF)高度同源的核苷酸和氨基酸序列。使用软件DNAman进行多序列比对;开放阅读框氨基酸序列及氨基酸序列的理论分子量(MW)、等电点(pI)等用蛋白质分析专家系统(Expert Protein Analysis System,ExPASy,http://www.expasy.org/tools/protparam.html)进行预测。使用 SMART(http://smart.embl-heidelberg.de/)软件对预测到的序列进行分析,包括所组成的蛋白质结构特点、结构域等。使用 SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽的预测。使用同源建模网站 Swiss-model(http://swissmodel.expasy.org/)预测蛋白质的高级结构。根据GenBank中已有物种的DMRT1氨基酸序列,用MEGA 5.0软件构建 N-J系统发育树[25]。
1.5 河川沙塘鳢DMRT1基因在不同组织和不同发育时期的表达分析
对河川沙塘鳢不同组织、胚胎不同时期和性腺不同发育阶段的材料,分别提取总RNA后反转录得到cDNA。根据目前已获得的cDNA的全长序列分别设计特异性引物DMRT1-F、DMRT1-R,以及作为内参基因的β-actin基因特异性上下游引物 β-actin-F、β-actin-R(表 1),已有研究证明β-actin基因可作为河川沙塘鳢性腺的内参基因[26]。分别以8种组织和8个胚胎发育时期和4个雌雄性腺发育时期的cDNA为模板,进行荧光定量PCR扩增,来检测DMRT1基因的mRNA在河川沙塘鳢不同组织及胚胎不同时期和性腺不同发育时期的表达情况。
荧光定量 PCR反应体系 20μL:Faststart Universal SYBR Green Master 10μL,正反向引物各3μL,cDNA模板4μL。扩增程序为:95℃10 min;95℃ 10 s,55℃ 30 s,共40个循环,于4℃冰箱中进行保存[27]。所有样品检测实验重复3次。其中,每条引物配置成的工作液浓度为2 μmol·μL-1,cDNA模板的浓度为5 ng·μL-1。
实验数据采用平均值±标准差(Means±SD)表示。目的基因的相对表达量采用2-ΔΔCt法进行计算,实验数据的统计分析、差异显著性检验分析用SPSS 19软件进行处理,用One-Way ANOVA计算P值,当 P<0.05时为差异显著。使用Origin 8.6软件制图。
2 结果与分析
2.1 DMRT1基因的全长序列分析
通过 RACE技术克隆得到:河川沙塘鳢DMRT1基因cDNA的全长序列为2 025 bp,包括编码297个氨基酸的开放阅读框(ORF)894 bp、73 bp的5′非编码区和1 058 bp的3′非编码区。其中,3′非编码区具有脊椎动物典型的加尾信号AATAAA和25 bp的PolyA尾巴,表明获得的该cDNA全长序列的完整性(图1)。

图1 河川沙塘鳢DMRT1 cDNA序列及推导的氨基酸序列Fig.1 Nucleotide and translated am ino acid sequences of DMRT1 cDNA in O.potamophila
通过ExPASy软件预测所得的氨基酸分子量为170 519.30,理论等电点为4.91。DMRT1基因的编码区经SignalP软件分析发现,其不存在信号肽序列,不属于分泌蛋白。通过SMART软件对DMRT1基因的ORF区域的氨基酸序列进行分析,结果表明,共包含有2个结构域,分别是DM结构域(18 aa)、Pfam蛋白结构(23 aa)。
2.2 河川沙塘鳢DMRT1基因氨基酸序列的同源性分析
将河川沙塘鳢DMRT1基因输入GenBank进行注册(登录号:MG585938)。使用 DNAman软件将河川沙塘鳢与其它7种已知物种的DMRT1基因的氨基酸序列进行多序列对比,以检测同源性。结果显示,河川沙塘鳢的DMRT1基因的氨基酸序列与另外7种已知物种氨基酸序列同源性在11.6~80%之间,其中与硬骨鱼类的相似度均大于50%,与其它类别的脊椎动物的相似度则小于 50%。其中,与同为鲈形目军曹鱼(Rachycentron canadum)和欧洲鲈鱼(Dicentrarchus labrax)的同源性最高,分别为80%和77%,与鳉形目花斑剑尾鱼(Xiphophorus maculatus)、鲀形目的红鳍东方鲀(Takifugu rubripes)以及鲤形目的斑马鱼的同源性次之,分别为 74%、64.33%、53.49%,与哺乳纲的家鼠(Musmusculus)以及鸟纲的原鸡(Gallusgallus)的同源性最低,分别为32.62%和16.11%(图2)。
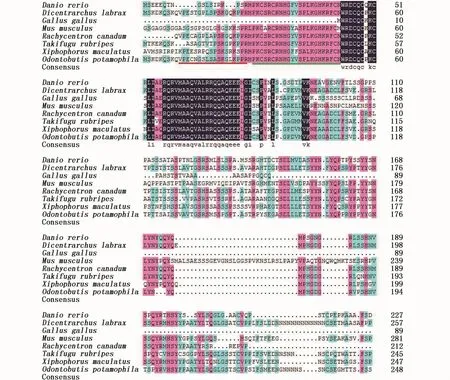
图2 河川沙塘鳢与其它物种DMRT1氨基酸序列对比Fig.2 Comparison of translated am ino acid sequences of DMRT1 gene in O.potamophila w ith other species
为研究河川沙塘鳢DMRT1基因与其它物种之间的同源性,采用MEGA 5.0以N-J法构建系统进化树(图3)。结果表明,在进化树的两大分支中,所有的鱼类聚为一支,而与鱼类亲缘关系较远的爬行类、鸟类和哺乳类的动物聚为另外一支,这与传统的分类情况是一致的,基本符合从低等无脊椎动物向高等脊椎动物乃至人类的进化过程,物种之间进化地位的差异推测与DMRT1基因DM保守区域氨基酸序列的变异情况有关。此外,由进化树可以得知,河川沙塘鳢与同为鲈形目的军曹鱼以及金钱鱼(Scatophagus argus)同源性较高,表明其亲缘关系较近。
2.3 河川沙塘鳢DMRT1基因空间结构的预测
应用同源建模网站 Swiss-model,以人类DMRT1基因的三维结构为模板(4yj0.1),推测出河川沙塘鳢DMRT1基因的三维结构(图4),该三维结构与人类性别决定基因的DM结构域有相同构型,序列相似度达 60%,序列同源性达90.32%,都具有与DNA结合的锌指结构蛋白。
2.4 河川沙塘鳢DMRT1基因组织差异性表达情况分析
通过qRT-PCR技术对河川沙塘鳢雌雄个体的各个组织的表达情况检测分析,由图5可知,河川沙塘鳢DMRT1基因在精巢中大量表达,在卵巢、肌肉、心脏、肝4种组织中表达较少,而在鳃、肠、脑、脾4种组织中几乎不表达。
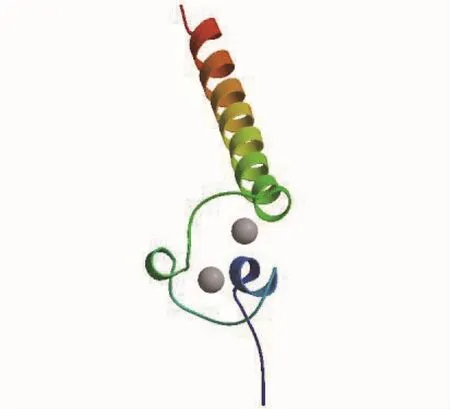
图4 河川沙塘鳢DMRT1基因的三维结构Fig.4 Three-dimension structure of O.potamophila DMRT1
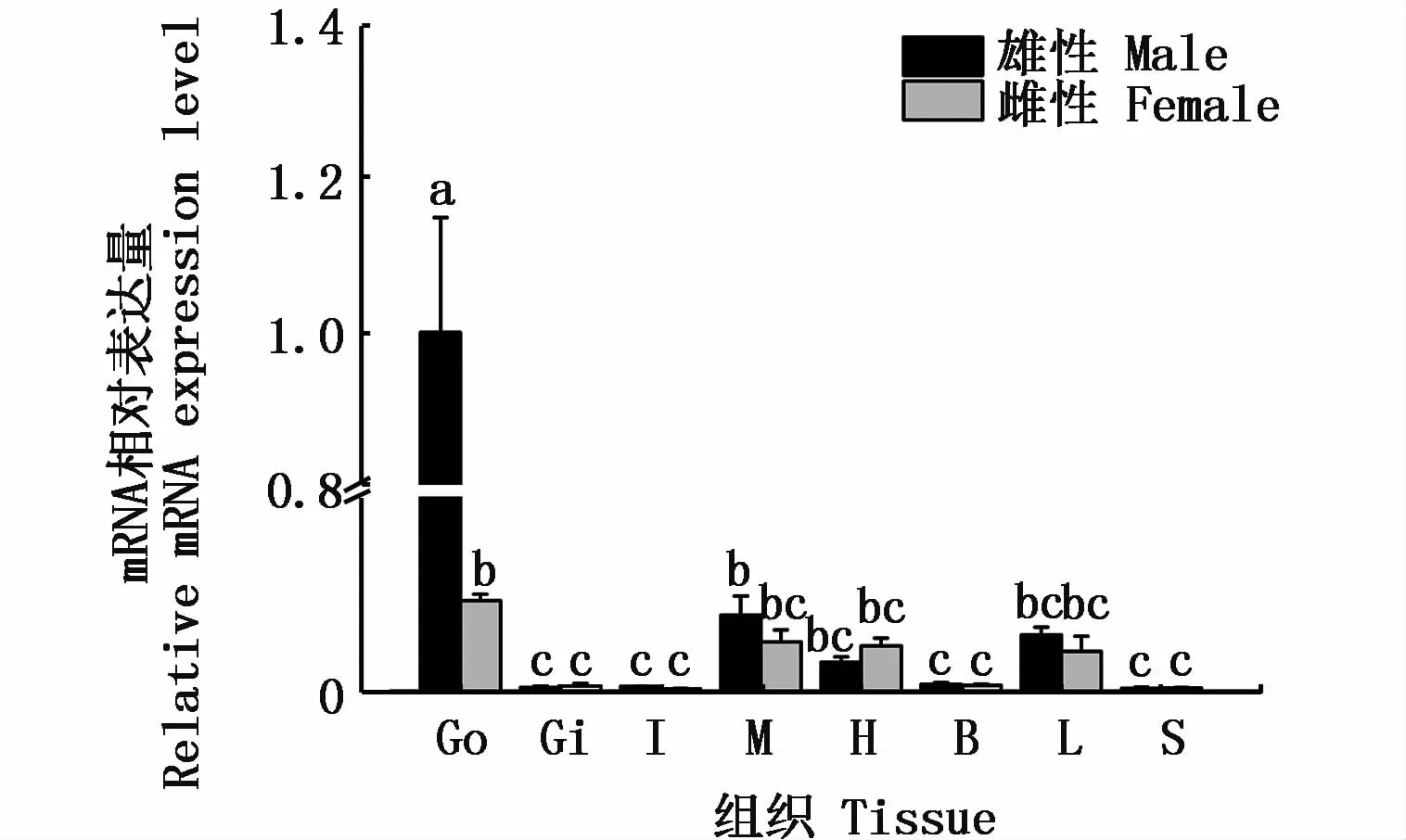
图5 DMRT1在河川沙塘鳢不同组织中的表达Fig.5 DMRT1 gene expressions in various tissues of O.potamophila
2.5 河川沙塘鳢DMRT1在胚胎和仔鱼不同发育时期表达差异
通过qRT-PCR技术对河川沙塘鳢的胚胎和仔鱼在不同发育时期表达情况进行分析。由图6可知,在胚胎各个时期到仔鱼发育初期,都可以检测到DMRT1基因的表达,具有广泛表达的特点,其表达量随着河川沙塘鳢的不断发育呈先上升后下降的趋势,在原肠胚时期达到最高值,显著地高于其它发育阶段(P<0.05),之后才逐渐降低。
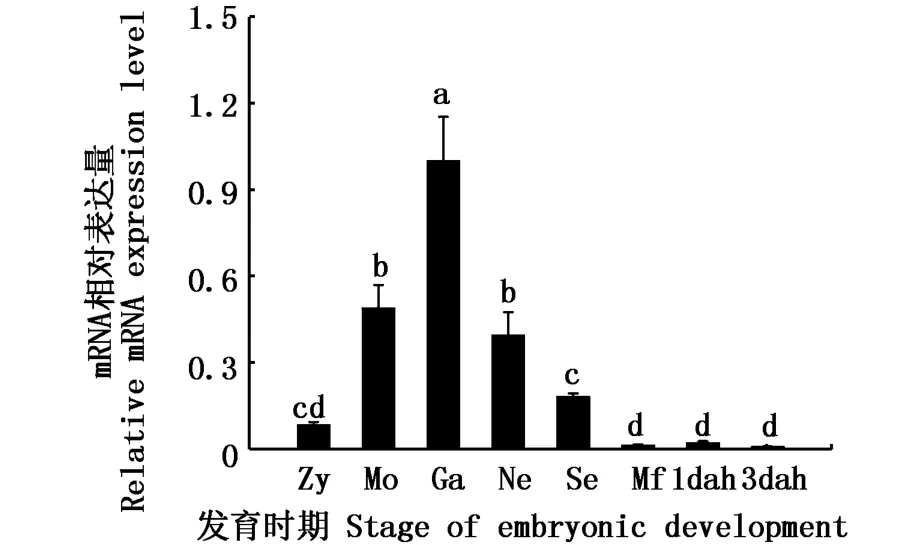
图6 DMRT1在河川沙塘鳢胚胎期和仔鱼发育早期表达Fig.6 DMRT1 gene expressions during the embryonic and early larval development of O.potamophila
2.6 河川沙塘鳢DMRT1在性腺不同时期表达差异
通过qRT-PCR技术对河川沙塘鳢DMRT1基因在性腺不同时期的表达情况进行分析。由图7可知,在河川沙塘鳢精巢发育的各个时期都有所表达,但不同时期表达强度存在差异,其在精巢发育的各个时期呈先下降后上升的趋势,在精子成熟期(IV期)达到最大值,而DMRT1基因在卵巢发育的各个时期表达量较少且表达强度差异不明显。
3 讨论
3.1 河川沙塘鳢DMRT1的全长基因和保守性分析
DMRT1基因是目前发现的唯一一个同时存在于无脊椎动物和脊椎动物中的性别相关基因[28],广泛参与物种的性别决定、分化过程以及器官的功能维持[29]。然而,物种间进化地位和性别决定机制的差异使其在性别发育过程中作用及表达特性也存在较大的差异[2]。
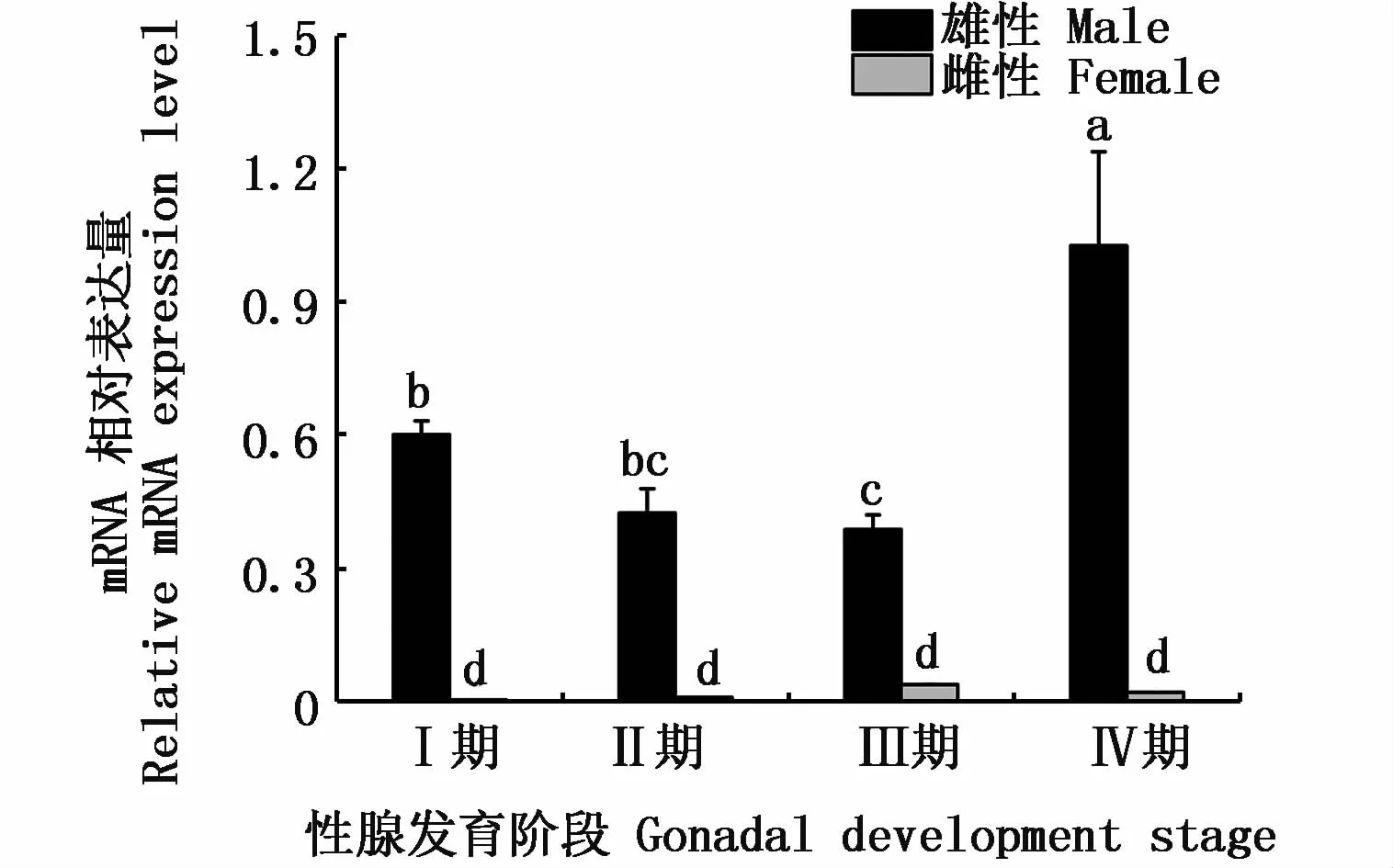
图7 DMRT1在河川沙塘鳢性腺不同时期的表达Fig.7 DMRT1 gene expressions in different gonadal development stages of O.potamophila
本研究对其表达蛋白质的结构预测表明河川沙塘鳢DMRT1基因共包含有2个结构域,分别是DM结构域和Pfam蛋白结构,其中DM结构域是一段包含用以锌离子螯合的锌指结构(C2H2C4)的保守区,而此保守区的锌指蛋白可结合受控基因的启动子以调节下游目的基因的表达[28],最终影响精巢的发育。
通过河川沙塘鳢DMRT1基因cDNA全长序列分析发现,该基因在分子进化过程中具有高度的保守性,尤其是DM结构域。经过表达氨基酸序列同源性比对,河川沙塘鳢与同为鲈形目的军曹鱼和欧洲鲈鱼的同源性最高,与其它目硬骨鱼氨基酸序列相比也表现出了高度的同源性,虽然与哺乳类、鸟类氨基酸序列的同源性较低,但序列比对结果表明,其结构域特定部位的氨基酸序列是高度保守的,推测这些序列的组成对于维持DMRT1基因的结构和功能可能是必需的。利用DMRT1基因编码的氨基酸序列构建了进化系统树,在进化树的两大分支中,河川沙塘鳢与所有的硬骨鱼类聚为一簇,如鲈形目的军曹鱼、金钱鱼等,而爬行类、鸟类和哺乳类的动物聚为另外一支,聚类分析各参考物种与其组成的进化树的分类地位基本吻合[28],由此可以推测河川沙塘鳢在系统进化过程中的分类地位,这也表明DMRT1基因在不同进化地位的物种间具有一定差异,这种差异与亲缘关系的联系十分密切。此外,空间结构预测表明,河川沙塘鳢DMRT1基因的三维结构与人类性别决定基因的DM结构域有着相同构型,序列相似度达60%,同源性更是高达90.32%。由此可见,DMRT1在物种进化过程中具有高度的保守性。
3.2 河川沙塘鳢DMRT1基因组织差异性分析
DMRT1基因在一些鱼类中早已被成功克隆且对其在性腺组织中的表达情况进行了研究。KOBAYASHI等[16]对青鳉研究发现,DMRT1在其发育不同阶段的多种组织中均有表达。而在斑马鱼[30]、稀有鮈鲫(Gobiocypris rarus)[31]、牙鲆(Paralichthys olivaceus)[32]、 黑 鲷 (Sparus macrocephlus)[33]、非 洲 胡 子 鲇[17]、红 鳍 东 方鲀[34]、异育银鲫(Carassius auratus gibelio)[35]、半滑舌鳎(Cynoglossus semilaevis Gunther)[36]和尼罗罗非鱼[7]等鱼类的研究中发现,DMRT1基因的表达具有性别二态性,即在雄性成体精巢中具有特异性的表达或在精巢中的表达量远高于卵巢中表达量[37]。DMRT1基因在两性中差异性表达的特点也与本研究的结果一致,表现为河川沙塘鳢DMRT1基因在精巢中的表达量远大于卵巢中表达量,这说明DMRT1基因仅在精巢的发育过程中起到了重要的作用。此外,周楠[18]对乌鳢的研究结果表明,DMRT1在卵巢中的表达量约为精巢的1/6,在肌肉、肝、心、鳃等组织中的表达量较少且无明显的雌雄差异。而在本实验中DMRT1基因在精巢中大量表达,在卵巢、心脏、肌肉、肝中少量表达,在肠、脑、鳃、脾中几乎不表达,这与乌鳢的研究结果基本一致,因此推测DMRT1基因在精巢的发生和功能维持上发挥作用[18]。
3.3 河川沙塘鳢DMRT1基因时空表达的差异性分析
DMRT1基因在不同鱼类胚胎发育的不同时期广泛表达。如DMRT1基因在青鳉胚胎发育早期持续表达[38];李林等[39]在黄颡鱼(Pelteobagrus fulvidraco)胚胎发育的各个阶段都能检测到DMRT1基 因 的 表 达;王 金 华[40]对 香 鱼(Plecoglossus altivelis)研究发现,香鱼从受精卵到孵化出膜的胚胎发育的各个阶段中都能检测到DMRT1基因的表达。在本研究中,河川沙塘鳢DMRT1基因在胚胎发育的各个时期都有表达,这种广泛表达的特性与先前的研究结果一致,推测该基因在河川沙塘鳢胚胎发育过程中也扮演着重要角色。在硬骨鱼中,原始生殖细胞(PGCs)最早发现于原肠胚时期[41]。河川沙塘鳢DMRT1基因的表达量在胚胎发育的不同时期呈先上升后下降的趋势,在原肠胚时期达到最高,该表达模式与黄颡鱼[39]、香鱼[40]类似。因此推测,DMRT1基因在胚胎发育过程中的高表达可能与原始生殖细胞的产生有关。
DMRT1基因在性腺不同时期的表达量存在明显的时空差异性,如在银汉鱼(Odontesthes bonariensis)中,DMRT1于精子再次发生时表达量会增高[42];虹鳟DMRT1在精子发生期的各个阶段均能稳定表达,而在精子成熟后表达量减少[43];黄颡鱼DMRT1基因在IV期精巢中的表达量最高,在V期(精子成熟期)及VI期(精子退化期)的表达量减少[39]。此外,DMRT1基因在胡子鲇[28]、黑鲷[33]的精巢Ⅲ、Ⅳ和Ⅴ期均能够稳定表达,而在精原细胞和精母细胞大量存在时表达量显著增强。以上研究说明,DMRT1基因在不同鱼类性腺的不同时期其表达量存在差异。本实验发现DMRT1基因在河川沙塘鳢精巢发育的各个时期表达量也存在差异且呈先下降后上升的趋势,在精子成熟期(Ⅳ期)达到最大值,这与鲟鱼DMRT1基因的表达趋势类似[19],推测DMRT1基因可能在精巢的发育和功能维持过程中起重要作用。至于DMRT1基因通过何种途径发挥相关作用,有待今后更进一步研究。
4 小结
河川沙塘鳢DMRT1基因具有保守的DM结构域,该基因在精巢的发育过程中持续表达并在Ⅳ期精巢表达量最高,推测其可能与精巢的发育和功能维持密切相关。本实验为河川沙塘鳢DMRT1基因功能的研究提供了理论依据,为其性别决定机制的研究奠定了基础,也为探究河川沙塘鳢的全雄育种打下了基础。

