小黄黝鱼繁殖期与非繁殖期的两性异形
金锦锦, 张方方, 仇玉萍, 陈国柱*
(1. 西南林业大学,云南省滇池湿地生态系统国家定位观测研究站,昆明650224; 2. 西南林业大学,湿地学院/国家高原湿地研究中心,昆明650224)
两性异形在动物界中普遍存在(Shine,1989;Morietal.,2017),研究证实其具有重要的进化生物学意义及生态适应意义(Estlanderetal.,2017)。对于入侵物种,两性异形可能在促进其成功入侵过程中扮演着重要角色(Jeschke & Strayer,2006;樊晓丽等,2016;MacGregoretal.,2017;Milleretal.,2017;万安等,2017)。入侵物种数量庞大,对其两性异形进行过针对性研究的种类只占极少部分,极需深入系统地开展相关研究工作。
鱼类普遍存在个体大小、体色和局部特征的两性异形(Parker,1992;Pyron,1996)。部分成功入侵的鱼类中存在两性异形现象,如尼罗河尖吻鲈Latesniloticus(Dadeboetal.,2005)、黑口新虾虎鱼Neogobiusmelanostomus(Kornisetal.,2012)、麦穗鱼Pseudorasboraparva(Záhorskáetal.,2013)、鲇Silurusasotus(樊晓丽等,2014)、食蚊鱼Gambusiaaffinis(樊晓丽等,2016)、东部食蚊鱼Gambusiaholbrooki(Sreanetal.,2017)等。这些鱼类涵盖了已知因性选择及繁殖选择压力而形成的鱼类个体大小两性异形的3种表现形式(Parker,1992;林植华等,2007):雌鱼大于雄鱼,如尖吻鲈、食蚊鱼,主要由提高雌鱼繁殖力选择压力所致;雄鱼大于雌鱼,如麦穗鱼,主要由雄鱼护卵及争夺雌鱼选择压力所致;雌雄大小相似,如鲇鱼,主要由提高受精率等选择压力所致。显然,入侵鱼类中复杂多样的两性异形形式提示它们适应环境压力的多样性较为丰富,针对性对某类入侵鱼类两性异形问题进行深入分析将有助于理解其入侵机制。
小黄黝鱼Micropercopsswinhonis属鲈形目Perciformes虾虎鱼亚目Gobiidae沙塘鳢科Odontobutidae,是广泛分布于我国平原地区湖泊沿岸带和河流缓流区的淡水小型鱼类(易伯鲁,1982),中国特有种(伍汉霖,钟俊生,2008)。由于半个多世纪前的广泛引种,小黄黝鱼已经成为我国西南云贵高原(何记昌,刘振华,1985)及西北蒙新高原湖泊(郭焱等,2005)的典型入侵种,并逐步向青藏高原区域扩散(陈锋,陈毅峰,2010;丁慧萍等,2014)。小黄黝鱼种群数量优势对入侵区域,如滇池(袁刚等,2010)、洱海(Tangetal.,2013)等高原湖泊的鱼类群落和生态环境造成了一定影响;其入侵对云南香格里拉濒危鱼类中甸叶须鱼Ptychobarbuschungtienensis是一个重要威胁(Panetal.,2010);其入侵与泸沽湖中3种土著特有裂腹鱼类的灭绝关系密切(孔德平等,2006)。因此,无论是基于对其种群控制还是基于对其资源利用,与繁殖相关的小黄黝鱼对高原湖泊的入侵机制及其适应性均是亟待解决的重要科学问题。
过去人们针对入侵至朝鲜半岛小黄黝鱼的繁殖生物学及生态学进行了研究,如繁殖特性(Kim & Kim,1996)、卵子发育(Kim & Kim,1996;Kim,1996)、种群生态(Kim & Kim,1997)、胚胎和幼体发育特征(Iwataetal.,2001)、食物组成(Araoetal.,2010)等。尽管我国很早就意识到小黄黝鱼入侵对高原区域土著鱼类有重要影响,但迄今未进行过相关的入侵生态学研究。小黄黝鱼存在两性异形现象(易伯鲁,1982),但仅限于形态、体色的描述而缺少定量分析(陈咏霞,管敏,2011),也缺少对这种现象与其入侵过程的相关分析。本文利用生态形态学分析方法(张堂林等,2008),观察小黄黝鱼繁殖期与非繁殖期形态特征的两性异形,并分析其形成原因,为研究小黄黝鱼对我国西南高原生境的入侵机制及其对高原湖泊的生态影响奠定基础。
1 材料与方法
1.1 样品采集地
样品采集地位于云南省昆明市西郊团结乡花红园社区所在的山间盆地,该地是中华青鳉Oryziassinensis模式标本产地(陈银瑞等,1989),同时也是小黄黝鱼在滇池流域的一个典型入侵地。地形及湿地生境详细描述参见仇玉萍等(2015)及陈国柱(2016),海拔约2 200 m。盆地西南侧为三家村水库(丰水期水面约1 km2),水库坝下为低缓的丘陵盆地。水库的湖滨带、低洼耕地在弃荒后形成的山地沼泽、灌溉沟渠及排水渠道为小黄黝鱼主要栖息生境。盆地出水口为地下溶洞,可能以潜流形式汇入滇池流域水系。
1.2 样品采集与分析
2016年9月—2017年8月,逐月从样品采集地用手抄网(孔径为1.2 mm,网口30 cm)及地笼网(孔径约3 mm)采集小黄黝鱼,10%甲醛溶液现场固定备检(1—2月枯水期、8月丰水期样品不足,故不列入分析)。通过对雌鱼的性腺观察、卵巢称量以及卵子计数,计算雌鱼的性腺指数(gonadosomatic index,GSI),参考《鱼类生态学》(殷名称,1995)中的公式:GSI=100%×(性腺质量/体质量),雌鱼GSI≥5%时为繁殖期(其卵巢发育至Ⅲ~Ⅳ期),其余为非繁殖期。雄鱼直接判别,繁殖期雄鱼头部隆起,头呈褐黑色、体色变黄,腹部赤红。本研究共使用样品253尾,雌鱼135尾(其中120尾分析形态和性腺指数,另7尾仅分析形态,8尾仅分析性腺指数),雄鱼118尾(其中3尾不作形态分析,只用于雌雄鱼逐月体长对比分析),故用于形态分析的雌鱼共127尾,雄鱼115尾(繁殖期:雌鱼50尾,雄鱼56尾;非繁殖期:雌鱼77尾,雄鱼59尾),用于性腺分析的雌鱼样品为128尾,具体见各部分标注。繁殖世代间体长分布的比较分别使用其中的2017年3—5月混合样品(n=30)与6月样品(n=80)。
小黄黝鱼传统可量性状指标测量方法主要参考《中国动物志 硬骨鱼纲 鲈形目(五) 虾虎鱼亚目》(伍汉霖,钟俊生,2008),使用电子数显游标卡尺测量样品的全长、体长、体高、头长、吻长、尾柄长、尾柄高、眼径、体宽等(精度为0.01 mm,计算平均值时四舍五入至小数点后第3位)(图1),并用电子天平测量样品的体质量、卵巢质量(精度为0.001 g),同时记录性别。

图1 小黄黝鱼可量性状及框架测量示意Fig. 1 Morphometric measurements of Micropercops swinhonis
A. 吻端, B. 第一背鳍起点, C. 第一背鳍基部末端, D. 第二背鳍起点, E. 第二背鳍基部末端, F. 尾鳍背部起点, G. 腹鳍起点, H. 臀鳍起点, I. 臀鳍基部末端, J. 尾鳍腹部起点, K. 胸鳍起点; A至B, A至C, ……, G至K之间的距离分别用AB, AC, ……, GK来表示; 1. 全长, 2. 体长, 3. 头长, 4. 吻长, 5. 眼径, 6. 体高, 7. 尾柄高, 8. 尾柄长, 9. 体宽
A. tip of snout, B. origin of first dorsal fin, C. tremunus of first dorsal fin, D. origin of second dorsal fin, E. tremunus of second dorsal fin, F. dorsal origin of caudal fin, G. origin of pelvic fin, H. origin of anal fin, I. tremunus of anal fin, J. ventral origin of caudal fin, K. origin of pectoral fin; AB, AC, …, GK indicate the distance of A to B, A to C, …, G to K; 1. total length, 2. standard body length, 3. head length, 4. lip length, 5. eye diameter, 6. body depth, 7. caudal peduncle depth, 8. caudal peduncle length, 9. body width
1.3 数据处理
所有数据均利用Excel和SPSS 19.0进行处理和分析。数值以平均数±标准差表示,显著性水平设置为α=0.05。
为消除异速生长及体长差异对分析结果的影响,将除体长外的其他形态参数值与体长或头长的比值作为统计值进行统计分析。利用单因素方差分析(One-Way ANOVA)对传统形态性状测量值及框架性状测量值在雌雄小黄黝鱼间的差异进行分析。基于上述传统测量性状及框架测量性状共计33组可量性状及比例参数,利用多元统计方法:主成分分析、判别分析等方法对雌雄鱼的形态性状差异进一步分析,以确认性别形态性状差异。
2 结果
2.1 外部形态的两性异形描述
GSI结果显示,小黄黝鱼3—9月繁殖,10月至次年2月停止繁殖(图2)。体长分布显示,小黄黝鱼种群5—6月出现世代交替,可以划分出5月前的世代Ⅰ(1+龄及以上)和6月后新成熟的世代Ⅱ(0+龄)2个繁殖群体(本文仅作指代,是未依据细分年龄划分的2个群体,后者为前者春季繁殖仔鱼当夏成熟所形成),2个群体的个体大小差异有统计学意义(图3)。另一方面,小黄黝鱼为分批产卵类型鱼类,在繁殖季节中同时存在繁殖期个体及非繁殖期个体,本研究作两性异形分析时,分别比较繁殖期与非繁殖期样品。
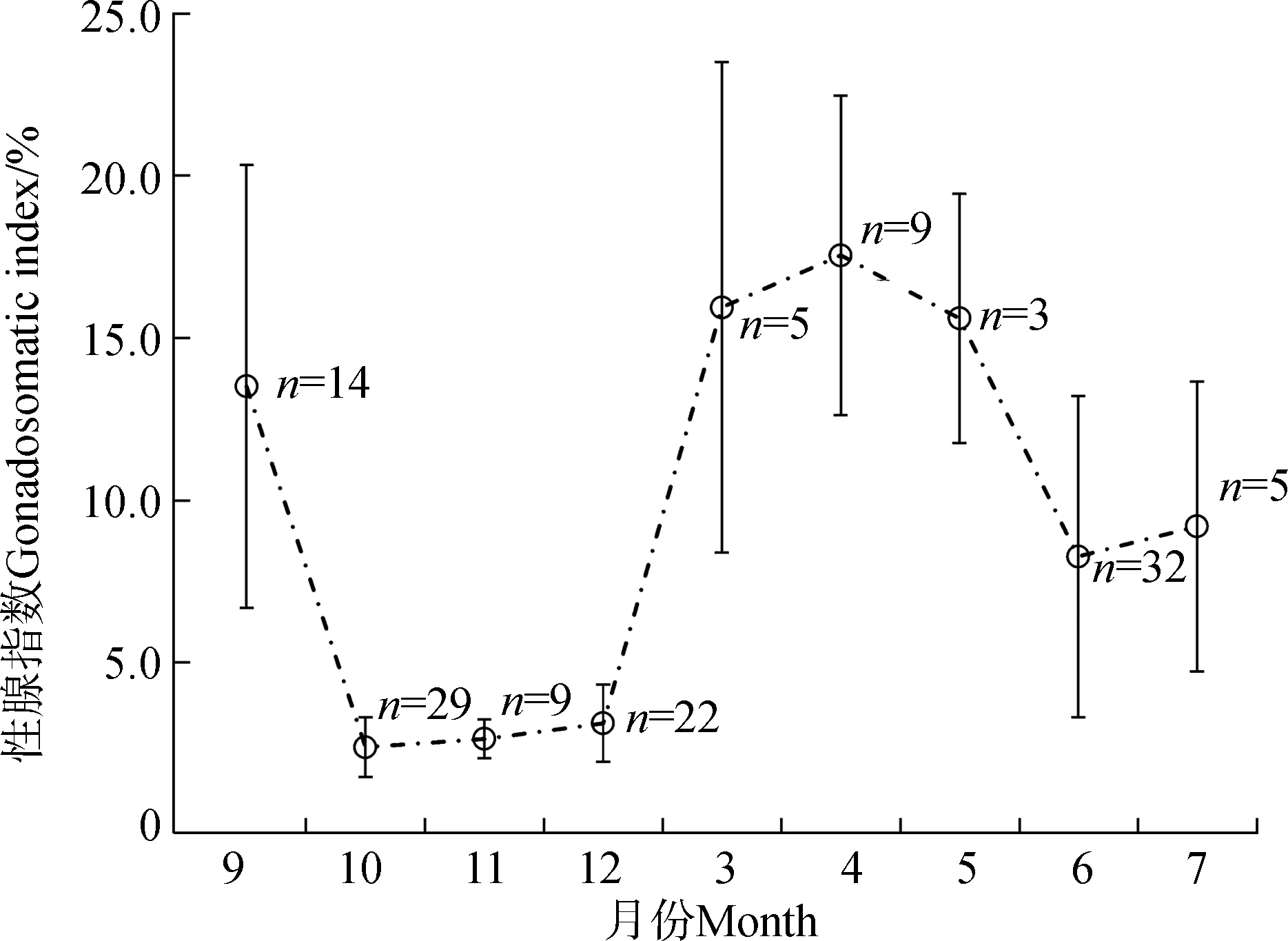
图2 小黄黝鱼研究期间雌鱼性腺指数变化(n=128)Fig. 2 Changes of gonadosomatic index of female Micropercops swinhonis during the study period (n=128)
小黄黝鱼雄鱼在繁殖期与非繁殖期的外形特征存在差异,与雌鱼的差异也十分明显(表1,图4)。其他特征差异与前人的研究(易伯鲁,1982;陈咏霞,管敏,2011)一致。
小黄黝鱼雄鱼在繁殖期与非繁殖期的形态存在差异(图4:a,b)。雄鱼世代Ⅰ繁殖群体个体显著大于世代Ⅱ繁殖群体(图4:c)。雄鱼能够迅速从非繁殖期进入繁殖期,形态存在连续变化:非繁殖期头部无隆起,曲线平滑;繁殖期初期,雄鱼头额部开始隆起;进入护卵期,头额部、枕部隆起呈肉瘤状(图4:d)。
2.2 形态特征两性异形单因素方差分析
雌雄小黄黝鱼在多个形态参数差异有统计学意义。无论是世代Ⅰ还是世代Ⅱ繁殖群体,在繁殖期,雄鱼体长均显著大于雌鱼(P<0.05)(表2,表3);而在非繁殖期,雄鱼与雌鱼个体大小差异无统计学意义(P>0.05)(表2,表3)。进一步分析显示,雌雄个体大小差异在逐月分析的样品中存在变化,以雄鱼个体大于雌鱼的月份居多(图5)。
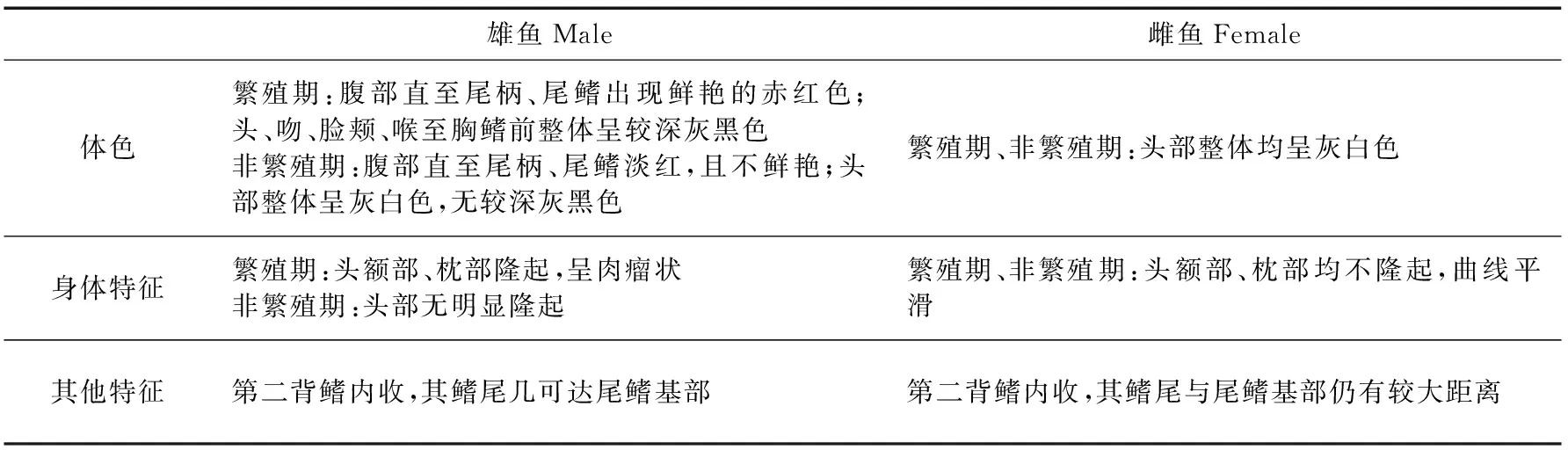
表1 雌雄小黄黝鱼外形特征差异比较Table 1 Morphological characteristics between the male and female Micropercops swinhonis
2.3 形态特征两性异形多元统计分析
世代Ⅰ繁殖群体:繁殖期共提取7个主成分,共解释75.536%的变异,其中前5个主成分累计共解释70.024%的变异:PC1=26.455%、PC2=17.762%、PC3=11.457%、PC4=8.553%、PC5=5.797%。非繁殖期共提取8个主成分,共解释71.984%的变异,其中前4个主成分累计共解释55.295%的变异:PC1=25.949%、PC2=14.086%、PC3=9.232%、PC4=6.028%。
世代Ⅱ繁殖群体:繁殖期共提取9个主成分,共解释79.909%的变异,其中前5个主成分累计共解释64.381%的变异:PC1=25.245%、PC2=17.550%、PC3=9.425%、PC4=6.793%、PC5=5.368%。非繁殖期共提取10个主成分,共解释85.981%的变异,其中前4个主成分累计共解释55.355%的变异:PC1=19.696%、PC2=14.157%、PC3=13.202%、PC4=8.300%。
以主成分PC1对主成分PC2绘制散点图(图6):2个繁殖群体中,繁殖期小黄黝鱼雌雄之间空间位置明显分离,非繁殖期雌雄鱼高度重叠。在繁殖期,世代Ⅰ繁殖群体雌雄鱼在PC2轴上显著分离,尾柄高/体高(0.804)和腹鳍起点-臀鳍起点(GH)/体长(0.736)2个参数对主成分PC2有主要贡献(>0.700),它们是影响两者形态差异的主要因素;而世代Ⅱ繁殖群体在PC1轴上显著分离,全长(0.707)、体长(0.755)、尾柄长/头长(0.729)、尾柄高/体长(0.750)、头宽/体长(0.814)、胸鳍起点-臀鳍起点(KH)/体长(0.764)6个参数对主成分PC1有主要贡献(>0.700),它们是影响两者形态差异的主要因素。
判别分析。世代Ⅰ繁殖群体:繁殖期雌雄间及其与非繁殖期雌雄间组质心距离均明显;非繁殖期两性组质心极为接近,两者分值点存在相当大程度的重叠(图7)。判别函数对原始案例正确分别率为79.4%,交叉验证分类正确率为66.1%,其中,对繁殖期雄鱼、雌鱼,非繁殖期雄鱼、雌鱼等各类群的正确分别率分别为95.2%、87.1%、68.8%及78.5%。世代Ⅱ繁殖群体:与世代Ⅰ繁殖群体类似,繁殖期雌雄间及其与非繁殖期雌雄间组质心距离均明显。同时,非繁殖期雌性和雄性组质心距离也较为明显,两者分值点重叠不明显。判别函数对原始案例正确分别率为97.4%,交叉验证分类正确率为66.2%,其中对繁殖期雄鱼、雌鱼,非繁殖期雄鱼、雌鱼的正确分别率分别为97.1%、94.7%、100.0%及100.0%。
3 讨论
3.1 小黄黝鱼两性异形形成机制
动物两性异形表现形式多样,最重要的表现之一是个体大小异形(廖灏泓等,2013;Estlanderetal.,2017)。繁殖期小黄黝鱼雄鱼体长显著大于雌鱼,属于雄鱼大于雌鱼的两性异形表现形式。雄鱼个体大于雌鱼的现象在虾虎鱼类中较为普遍,如同色韧虾虎Lentipesconcolor(Maciolek,1977)、双点虾虎鱼Gobiusculusflavescens(Pélabonetal.,2003)、沙塘鳢Odontobutisobscurus(樊晓丽等,2009)等。鱼类两性个体大小异形一般解释为性选择(Legrand & Morse,2000)和繁殖力选择(Szekelyetal.,2000)等综合因素作用的结果。性选择主要依赖于交配体制发生作用(Henson & Warner,1997),如雄性护卵、一夫多妻的交配体制,雄性为提高竞争力、交配成功率和对后代的保护,形成大个体(Snelson,1972;Parker,1992;林植华等,2007)。对黄颡鱼Pelteobagrusfulvidraco

图4 小黄黝鱼外部形态Fig. 4 Morphology of Micropercops swinhonis
a. 非繁殖期(12月标本, 上: 雄鱼, 下: 雌鱼), b. 繁殖期(3月标本, 上: 雄鱼, 下: 雌鱼), c. 世代Ⅰ繁殖群体雄鱼(下)与世代Ⅱ繁殖群体雄鱼(上)对比, d. 雄鱼从非繁殖期向繁殖期过渡的形态变化: 下. 非繁殖期, 中. 求偶及交配期, 上. 交配及护卵期
a. non-reproduction period (samples of December, upper: male, bottom: female), b. reproduction period (samples of March, upper: male, bottom: female), c. males from generation Ⅰ reproduction group (bottom) and generation Ⅱ reproduction group (upper), d. morphological changes of males from non-reproduction period (bottom), courtship period (middle), and mating and guarding period (upper)
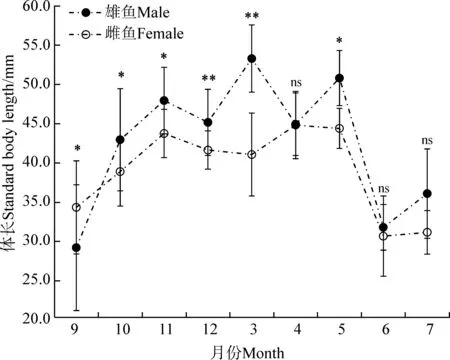
图5 小黄黝鱼雌雄逐月体长均值对比(n=253)
Fig. 5 Monthly changes of standard body length in the male and femaleMicropercopsswinhonis(n=253)
*P<0.05,**P<0.01, ns.P>0.05
(林植华,雷焕宗,2004)、棒花鱼Abbottinarivularis(林植华等,2007)等的研究发现,雄性典型的筑巢、护巢和孵卵行为是促使雄性个体显著大于雌性的重要影响因素。类似地,小黄黝鱼在繁殖时,雄鱼也具有典型的护巢行为。在护巢过程中,个体较大的雄性比小个体具有更强的护巢能力。小黄黝鱼世代Ⅰ繁殖群体雄鱼与雌鱼形态出现差别的主要为尾柄高/体高、GH/体长等指标,且在雌雄间的差异有统计学意义,提示雄鱼尾柄越大,运动能力和护巢能力越强,后代成活率就可能越高;而GH/体长与腹部容积增大有关,表明雌鱼为获得更大的怀卵量而演化出更大的腹腔。小黄黝鱼世代Ⅱ繁殖群体雄鱼与雌鱼形态差别主要体现在与生长、繁殖有关的能量分配策略上。雄鱼分配更多能量于生长以快速提升个体竞争力,而雌鱼则分配更多能量于性腺发育,是导致两者体长出现显著差异的重要原因。2个世代两性异形表现存在差异是由于两者所在生长发育阶段不同所致,同时也提示着两性异形表现在小黄黝鱼中具有较为丰富的可塑性。
繁殖力选择更多出现在雌鱼个体大于雄鱼个体的物种中(Pincheira-Donoso & Hunt,2015),如尼罗河尖吻鲈(Dadeboetal.,2005)、食蚊鱼(樊晓丽等,2016)等,雌鱼通过身体的增大而增加繁殖输出,是有利于提高种群增长率的一种繁殖策略。另一方面,因获得的后代质量更高,雄鱼倾向于选择与个体较大的雌鱼进行交配(Pélabonetal.,2003),也是促使雌鱼个体在演化过程中向大个体发展以获得更高繁殖力的重要原因。然而,繁殖力选择压力导致雌性大于雄性,但雄性小黄黝鱼大于雌性的特点提示雄性护巢、竞争雌性能够获得更高的繁殖成功率,因此,性选择压力强于繁殖力选择压力是导致雄鱼大于雌鱼的重要原因。类似地,护巢及竞争配偶作用也被认为超过了繁殖力选择压力对雌雄棒花鱼的形态塑造强度(林植华等,2007)。目前,偏向于雄性的两性异形的物种中,雄鱼护巢、争夺配偶等策略是如何促进大个体雄性出现的细节有待阐明。
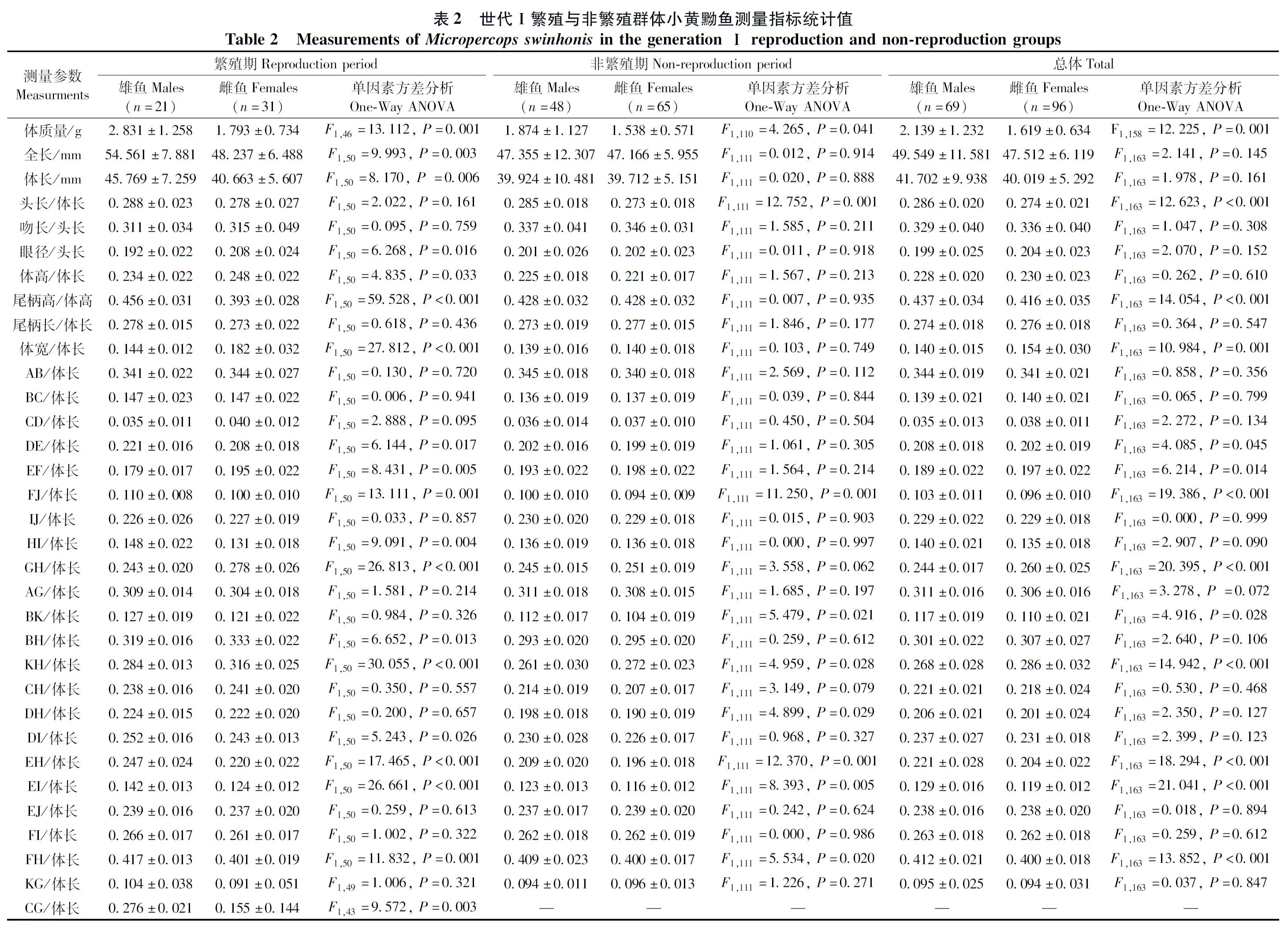
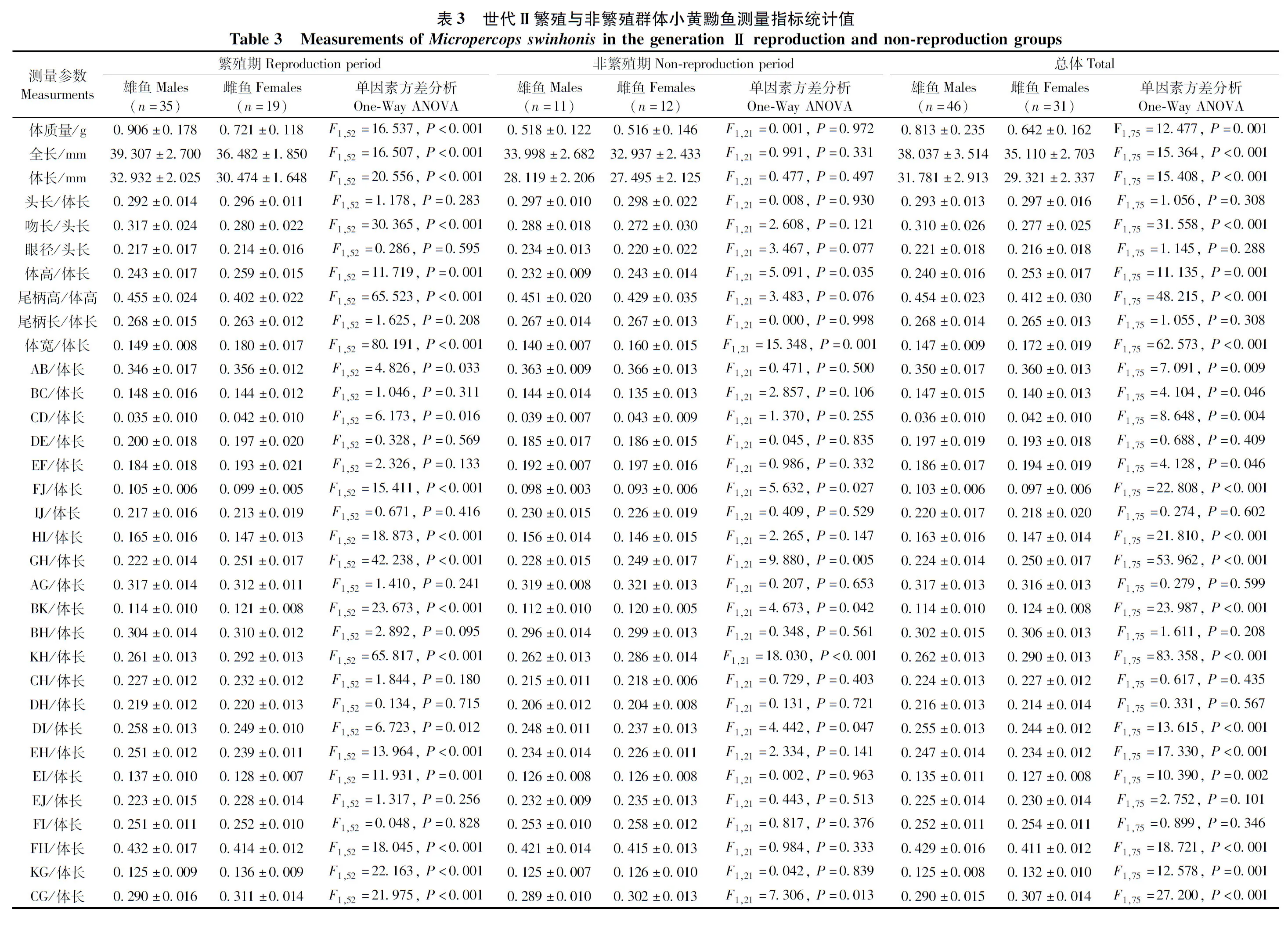
图6 主成分PC1对PC2散点图Fig. 6 Scatter plots for the principal component PC1 vs. PC2
a. 世代Ⅰ繁殖群体繁殖期, b. 世代Ⅰ繁殖群体非繁殖期, c. 世代Ⅱ繁殖群体繁殖期, d. 世代Ⅱ繁殖群体非繁殖期
Generation Ⅰ reproduction group: a. reproduction period, b. non-reproduction period; Generation Ⅱ reproduction group: c. reproduction period,d. non-reproduction period
3.2 小黄黝鱼繁殖期与非繁殖期两性异形表现差异

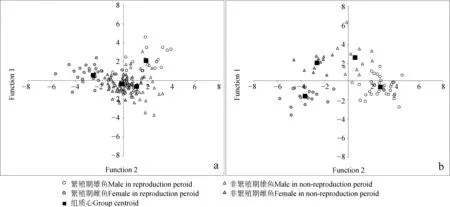
图7 判别分析联合分布Fig. 7 Combine plots for discriminant analysis
a. 世代Ⅰ繁殖群体generation Ⅰ reproduction group, b. 世代Ⅱ繁殖群体generation Ⅱ reproduction group
出两性异形,如尼罗罗非鱼Oreochromisniloticus(Dwivedietal.,2016)。在多数样品采集月份中,小黄黝鱼雄鱼个体显著或极显著大于雌鱼,这可能与两者能量分配策略不同有关,雌鱼将更多能量投入到性腺发育、繁殖输出等活动中,而分配用于身体增长的能量比例较雄鱼少,导致两性体长增长产生差异而出现上述现象。
3.3 小黄黝鱼两性异形在其入侵中的作用
生态形态学理论(张堂林等,2008)指出,形态差异提示两性生态位的差异。因此,小黄黝鱼两性异形现象可能在其入侵种群在入侵地成功建立种群过程中扮演着重要角色。雌雄形态上的差异对于降低两者在种群内对某些资源如食物的竞争,特别是对于雌鱼主要通过获取更多食物以提高繁殖输出的繁殖策略具有重要意义。而促进雄鱼形态演化的护巢、竞争雌鱼等行为能有效提高后代的质量与成活率,更有利于其种群扩张。类似现象在我国许多典型入侵种如黄颡鱼(林植华,雷焕宗,2004)、棒花鱼(林植华等,2007)、麦穗鱼(Záhorskáetal.,2013)等研究中均有所揭示。尽管如此,这种贡献对入侵种群在入侵初期快速增长过程中所起作用尚待深入分析。

