污水处理工艺对微藻及藻际细菌群落的影响
王华光,王文静,盛彦清*
污水处理工艺对微藻及藻际细菌群落的影响
王华光1,王文静2,盛彦清2*
(1.烟台振德环境监测有限公司,山东 烟台 264000;2.中国科学院烟台海岸带研究所,山东 烟台 264003)
以某啤酒厂活性污泥作为接种物富集对污水有降解作用的微藻与细菌,探讨藻菌共生体在经过不同处理的污水培养基中生长情况及藻菌群落结构的变化.微藻在两个处理组Treat. 1(过滤且灭菌污水)和Treat. 2(过滤未灭菌污水)中均生长良好;培养20d后,微藻和细菌在不同污水处理组中群落结构与原样相比,发生了显著的变化:随着藻菌在污水培养基中生长,莱茵衣藻和小球藻在Treat. 1和Treat. 2中成为优势藻类;无色杆菌属unidentified OPB35的相对丰度在两组实验组中均明显增加,溶杆菌在Treat. 1和Treat. 2中显著减少.藻菌共生体对Treat. 1和Treat. 2中的化学需氧量(COD)去除率可达到73.7%和67.9%.结果表明,Treat. 1和Treat. 2中的污水培养基对微藻及细菌的群落结构有显著的影响,但不同处理组中不同藻菌共生体对培养液的CODCr去除无明显的区别.
微藻;藻际细菌;污水处理;CODCr
随着全球能源危机和水体环境污染的加剧,利用污水扩大培养微藻提取生物柴油的工艺逐渐成为解决水环境污染和能源危机的新兴研究热点[1-2].已有研究表明,微藻对污水中的有机物、氮、磷等均具有较好的去除效果[3-5]:如蓝藻门布朗葡萄藻()对含有较高碳氢化合物浓度的经二级处理污水中的硝酸盐和磷具有较好的去除效果,同时得到比标准培养基培养更高的生物量[6];斜生栅藻()和小球藻(),蓝藻钝顶螺旋藻()与活性污泥菌落的相互作用时,可有效去除猪养殖废水中的C、N、P等[7];利用好氧污泥-微藻耦合颗粒进行污水处理的研究目前获得了较好的研究成果[8];微囊藻对锑的吸附及去除也有较好的效果[9].
制约污水培养微藻反应器的关键技术问题是污水中含有较多的杂质和微生物,如各种细菌、寄生虫、原生动物和轮虫等,从而导致微藻生长不够稳定,微藻产量低和出水水质差[10].近年来研究发现,由于细菌和微藻之间存在着互利共生,偏利共生等多种关系,部分细菌对微藻的生长和絮凝沉淀都有积极作用[11].藻菌关系的重要性在污水培养微藻获得微藻能源方面越来越受到重视,诸多相关研究正在有序开展[12-15].已有研究结果表明,将微藻和细菌进行有效结合形成运行简便、经济有效的污水处理工艺,可很好的解决微藻在复杂污水中生长不稳定的问题.但随着藻菌在污水中培养,藻类和细菌的种群结构极易发生变化.本文拟从微藻和细菌共生的角度出发,从某啤酒厂污水处理系统的好氧池中富集微藻,考察好氧池中微藻群落结构变化及藻际细菌在处理污水前后的群落结构多样性变化,同时检测其对不同污水处理组中COD的去除效果.
1 材料与方法
1.1 微藻的获取培养
取20mL污泥浓度(MLSS)4 000mg/L某啤酒厂污水处理系统的好氧池内活性污泥作为接种物,加入0.5L自制的无菌营养液(pH 7.0,121℃,30min)于1L无菌锥形瓶中,营养液中含硝酸钠(15.0g/L),磷酸氢二钾(4g/L),七水合硫酸镁(7.5g/L),七水合氯化钙(3.6g/L),柠檬酸(0.6g/L),柠檬酸铁铵(0.6g/L),乙二胺四乙酸二钠(0.1g/L),碳酸钠(2.0g/L),硼酸(2.86g/L),氯化锰(1.86g/L),硫酸锌(0.22g/L),钼酸钠(0.39g/L),五水硫酸铜(0.08g/L),六水硫酸钴(0.05g/L),九水硅酸钠(4g/L),维生素B1(0.1mg/L),维生素B12(0.5mg/L)和生物素(0.5mg/L).接种活性污泥后无菌锥形瓶置于光照强度为2000lux,25 ℃的恒温培养箱中.培养2个月后,取培养液在5 000g,10min的条件下,离心收集藻细胞.
取上一步骤中的原样藻细胞,清洗离心后的藻细胞分别接入经过不同处理工艺的培养液中. Treatment 1 (Treat. 1):滤纸(定量滤纸,中速)过滤啤酒厂污水并置于121℃,30min条件下进行高温灭菌;Treatment 2 (Treat. 2):使用滤纸过滤啤酒厂污水.每个实验组3个重复,定时取样.
依据文献[16]的方法,用紫外分光光度计测定微藻在波长666nm和653nm下的吸光度,叶绿素(Chlorophyll)的计算公式为:
Chlorophyll a (a)=15.65666−7.340653 (1)
Chlorophyll b (b)=27.05653−11.21666 (2)
Total chlorophyll=a+b (3)
实验过程中,取培养液0.45µm GF/C滤膜(waterman)过滤后,留上清液.COD的测定采用标准方法[17].
1.2 藻菌样品的采集及总DNA提取
分别取50mL原样、Treat. 1和Treat. 2 样品,超声处理后,经0.45µm聚碳酸酯膜滤膜(Millipore, Cork, Ireland)过滤后收集含有藻细胞的滤膜1,滤膜1放置于灭菌后的2mL的离心管中;收集滤液,滤液经0.2µm聚碳酸酯膜滤膜(Millipore, Cork, Ireland)过滤后,收集滤膜2放置于灭菌后的2mL的离心管中.滤膜置于-20℃的冰箱中保存.利用植物和细菌总DNA提取试剂盒(OMEGA,USA)分别提取滤膜1中微藻总DNA和滤膜2中细菌总DNA,琼脂糖DNA纯化试剂盒(天根生化科技北京有限公司)纯化,纯化后DNA保存在-80℃.高通量测序实验委托华大基因有限公司针对16S rRNA基因V4~V5区域完成.原始测序数据上传至NCBI数据库(SRR7091132-SRR7091137).使用Cut adapt软件过滤和按barcode拆分样本后,进行OTUs (Operational Taxonomic Units)聚类和物种分类分析.根据OTUs聚类结果,一方面对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况.对OTUs进行丰度、Alpha多样性计算、Venn图和花瓣图等分析,以得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTUs信息等.另一方面,可以对OTUs进行多序列比对并构建系统发生树,并进一步得到不同样品和分组的群落结构差异.
2 结果与讨论
2.1 微藻的生长
通过测定藻细胞的叶绿素a和叶绿素b含量,确定藻类在污水培养基中的生长状态.实验表明藻类在Treat. 1和Treat. 2中均生长良好(图1).0~20d,藻类在Treat. 1和Treat. 2的叶绿素的含量没有明显的区别.20d后,在Treat. 2中藻细胞的叶绿素含量明显高于Treat. 1藻细胞的叶绿素.与Treat. 2相比Treat. 1中缺少污水中有活性的细菌,大量有益于藻类生长的细菌在过滤污水中存在,有益细菌促使藻类更好的利用过滤污水中的营养物质.迟堃[18]和陶羽[19]研究污水处理菌藻共生系统时,发现细菌可促使藻体形成絮状沉淀,有利于藻类生长.实验表明:经过灭菌和未灭菌的过滤污水对微藻的生长没有显著影响,实验室中未灭菌的过滤污水更有益于微藻的生长.

图1 微藻的叶绿素含量随生长时间的变化情况
2.2 微生物群落多样性
利用Illumina Miseq平台对藻类18S rRNA 基因和细菌16S rRNA基因测序,共得到原始序列502926条,经过筛选后,共得到有效序列42966条(表1).表1中,综合考虑Chao1指数,Shannon指数和Simpson指数,实验组Treat. 1和Treat. 2中微藻和细菌群落多样性要低于原样样品,实验组Treat. 2的微生物群落结构多样性要高于实验组Treat. 1的微生物群落多样性.这可能是由于微生物Treat. 1和Treat. 2中逐渐被驯化,微生物种类趋向单一化,与污水处理关系密切的微藻和细菌在实验组中形成新的藻菌共生体并且逐渐成为优势细菌,而实验组Treat. 2中加入了污水培养基中原有的细菌,导致微生物群落多样性高于实验组Treat. 1.
2.2.1 微藻群落结构多样性 实验过程中,收集富集培养的原样、Treat. 1和Treat. 2等样品,提取微藻和细菌总DNA,对微藻和藻际细菌的群落结构多样性进行测定,同时对微藻和细菌在种或属水平相对丰度大于1%种类进行分析.基于18S rDNA对微藻群落多样性进行分析,在原样样品中检测到3种微藻,其中包括硅藻门(Diatomea),红藻门(Rhodophyta)和绿藻门(Chlorophyta)(图2A).污水处理过程中常用绿藻,如莱茵衣藻() (44.6%)、麦可藻属(9.2%)和(4.6%)[20-22]是原样样品中的优势藻类.
随营养条件的改变,实验组Treat. 1与原样样品相比优势藻类种群没有发生明显变化,如绿藻和硅藻依然作为藻类群落中的优势种群.绿藻相对丰度增加,包括(47.6%),(5.5%),(3.9%),sp. (2.9%)和sp. (10.1%)等;而(8.0%)相对丰度明显减少(图2B).硅藻相对丰度(27.9%)与原样相比有所减少,红藻sp. (3.1%)的相对丰度没有发生明显变化.微藻接种至含污水原生细菌的Treat. 2后,优势微藻群落结构发生明显变化:绿藻相对丰度明显增加,硅藻相对丰度减少,未检测到红藻;同时(49.4%),(22.2%)和(25.4%)等成为优势群;检测到未在原样和Treat. 1中出现的绿藻门绿球藻sp. (0.1%).sp.是一种潜在可利用的微藻能源的微藻,Sivasubramanian等[23]和Renuka等[24]研究中证实_sp.可利用污水处理后的出水进行生长并获得较高生物量,为未来新能源的可持续发展利用提供可能.绿藻如(25.4%)、(1.7%)和硅藻(0.6%)的相对丰度与原样相比明显减少,而红藻sp. Y16没有检测到.两组实验过程中发现和在污水培养基中作为优势藻类,是污水处理研究过程中的常见菌株.在Treat. 1中的相对丰度高于的相对丰度,在过滤并灭菌污水处理组Treat. 2则反之.微藻在Treat. 2生长时,过滤污水中存在较多的细菌种类,过滤污水灭菌后,诸多有益于的细菌被杀死,与z在实验组Exp. 2相互竞争营养物质,最终成为优势藻类.实验结果证实:对污水进行不同的处理会对藻类群落结构产生影响,微藻群落随着污水培养基的变化而变化.

表1 微藻和细菌的丰度和多样性

图2 微藻群落结构多样性
A.门; B.种
2.2.2 细菌群落结构多样性 基于16S rRNA基因,对藻类共生的藻际细菌进行细菌群落结构的测定(图3).结果显示,Treat. 1和Treat. 2中的细菌与原始样品相比,细菌群落结构差异明显.在门的水平上,原始样品和Treat. 1较为接近,而在属的水平上,过滤污水处理组和灭菌污水处理组群落结构较为接近.3个处理组中共检测到9个门类,包括变形杆菌门(Proteobacteria),拟杆菌门(Bacteroidetes),浮霉菌门(Planctomycetes),芽孢杆菌门(Gemmatimonadetes),绿菌门(Chlorobi),栖热链球门(Deinococcus- Thermus),厚壁杆菌门(Firmicutes),绿弯菌门(Chloroflexi),酸杆菌门(Acidobacteria)和其他(others).变形菌门的含量超过79%,尤其原样的微藻样品中变形菌门的含量达到95%以上.随着藻类在Treat. 1和Treat. 2培养,变形菌门的含量变低,而拟杆菌门在Treat. 1中的含量有所升高,绿菌门和浮霉菌门在Treat. 2中含量亦有所升高.

图3 藻际细菌群落结构组成
A.门;B.属
在属的水平上,微藻原样中,藻际细菌群落中溶杆菌()相对丰度可达87.4%,其次unidentified和红杆菌属()分别占7.8%和4.6%.微藻在Treat. 1和Treat. 2培养后,由于营养物质改变及污水中自带菌群等原因,细菌群落结构发生明显变化.在Treat. 1中,营养条件改变后,藻类群落结构发生变化,藻际细菌群落结构也发生变化.贪噬菌()的相对丰度达到43.7%,其次为unidentified OPB35 (35.4%),无色杆菌() (10.7%)次之.而在含有自养细菌的Treat. 2中,藻际细菌群落多样性再次发生变化, unidentified OPB35 (35.4%)相对丰度最高,其次unidentified(21.0%)和无色杆菌(12.4%).溶杆菌()在Treat. 1和Treat. 2中丰度锐减,而原样中未检测到的unidentified OPB35在Treat. 1和Treat. 2中出现较高丰度.微藻在利用污水营养物质的同时,不仅微藻群落结构发生变化,细菌群落结构也发生变化.污水中的细菌群落影响微藻群落结构,进而影响新的藻菌共生体的形成.
2.3 CODCr的变化
利用重铬酸钾法测定微藻及藻际细菌在污水处理过程中COD的变化,实验初始,过滤污水培养基和灭菌污水培养基的CODCr值为480mg/L.原样微藻在Treat. 1和Treat. 2中培养20d后,利用GF/C滤膜去除藻细胞,测定滤液的CODCr的变化. Treat. 1中CODCr值降低至128mg/L, Treat. 2的CODCr值降低至154mg/L.微藻对2种污水培养基中的CODCr去除率可分别达到73.7%和67.9%.实验证明,污水原样富集的微藻对污水中CODCr的去除具有一定的效率,藻际细菌的存在对CODCr的去除率没有明显影响,减少污水培养基的净化处理,在一定程度上可降低污水处理工艺的成本,在实际生产中有一定的参考意义.
综上所述,微藻细胞周围生长着大量共栖的细菌,微藻处理污水实际是藻类及藻际细菌的共生体在污水中产生的效果.藻际细菌不仅与微藻进行相互作用,还对污水中的营养物质进行分解利用.研究表明,藻际细菌中可能存在着制约藻细胞生长的不利细菌,也存在大量促进藻类生长的细菌.微藻与藻际细菌群落的优化组合,筛选得到有益的菌群是获取高效污水处理的微藻的重要途径.通过对藻菌相互关系的深入研究,不仅可以筛选高效污水处理的微藻,而且获得藻菌共生体的更好的污水处理组合.
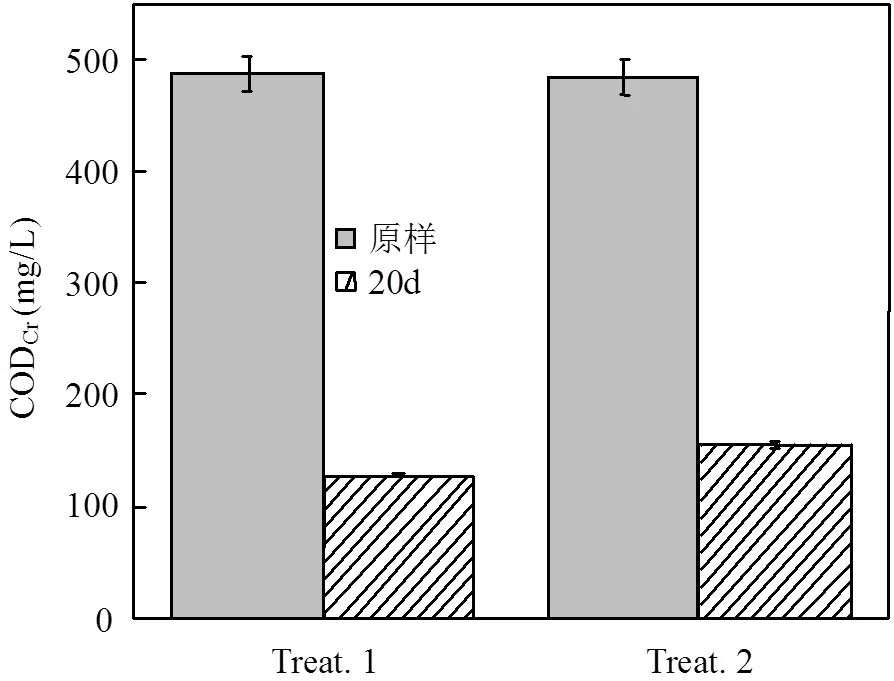
图4 不同处理组中CODCr的变化情况
3 结论
3.1 微藻在两个实验组中生长良好.随着藻菌的生长,微藻和细菌优势群落结构在不同处理组中发生显著变化.
3.2 绿藻和细菌在两组实验室中作为优势群落.
3.3 在不同前处理的污水培养基中,原样藻菌群落中形成新的藻菌共生体.这些藻菌共生体对在两组实验中的COD去除率没有明显差别.
[1] Sydney E D, Da Silva T E, Tokarski A, et al. Screening of microalgae with potential for biodiesel production and nutrient removal from treated domestic sewage [J]. Applied Energy, 2011,88:3291-3294.
[2] De Assis L R, Calijuri M L, Do Couto E D A, et al. Microalgal biomass production and nutrients removal from domestic sewage in a hybrid high-rate pond with biofilm reactor [J]. Ecological Engineering, 2017,106:191-199.
[3] Monfet E, Unc A. Defining wastewaters used for cultivation of algae [J]. Algal Research, 2017,24:520-526.
[4] Ramachandra T V, Mahapatra D M, Bhat S P, et al. Biofuel production along with remediation of sewage water through algae [M]. New Delhi: In Algae and environmental sustainability Springer, 2015:33-51.
[5] Yewalkar-Kulkarni S, Gera G, Nene S, et al. Exploiting phosphate- starved cells of Scenedesmus sp. for the treatment of raw sewage [J]. Indian journal of microbiology, 2017,57(2):241-249.
[6] Sawayama S, Minowa T, Dote Y, et al. Growth of the hydrocarbon- rich microalga Botryococcusbraunii in secondarily treated sewage [J]. Applied Microbiology and biotechnology, 1992,38(1):135-138.
[7] De Godos I, Vargas V A, Blanco S G, et al. A comparative evaluation of microalgae for the degradation of piggery wastewater under photosynthetic oxygenation [J]. Bioresource Technology, 2010, 101(14):5150-5158.
[8] 刘 琳,叶嘉琦,刘玉洪,等.好氧污泥-微藻耦合颗粒的培养及特性研究 [J]. 中国环境科学, 2017,37(7):2536-2541.
[9] 孙福红,廖海清,陈艳卿,等.微囊藻对锑(V)生物吸附作用研究 [J]. 中国环境科学, 2016,36(11):3383-3389.
[10] Cheah W Y, Ling T C, Show P L, et al. Cultivation in wastewaters for energy: A microalgae platform. Applied Energy, 2016,179:609-625.
[11] Fuentes J L, Garbayo I, Cuaresma M, et al. Impact of microalgae- bacteria interactions on the production of algal biomass and associated compounds [J]. Marine drugs, 2016,14(5):100.
[12] Ji X, Jiang M, Zhang J, et al. The interactions of algae-bacteria symbiotic system and its effects on nutrients removal from synthetic wastewater [J]. Bioresource Technology, 2018,247:44-50.
[13] Ramanan R, Kim B H, Cho D H, et al. Algae–bacteria interactions: evolution, ecology and emerging applications [J]. Biotechnology Advances, 2016,34(1):14-29.
[14] Sethupathy A, Subramanian V A, Manikandan R. Phyco-remediation of sewage waste water by using micro-algal strains [J]. International Journal of Engineering Inno vation & Research, 2015,4(2):300-302.
[15] 陈洪一,郭仕达,金文标,等.城市污水中高效COD去除菌对微藻生长的促进作用研究[J]. 环境污染与防治, 2017,39(8):895-899.
[16] Dere S, Günes T, Sivaci R. Spectrophotometric determination of chlorophyll-A, B and total carotenoid contents of some algae species using different solvents [J]. Turkish Journal of Botany, 1998,22:13-17.
[17] 国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2009:211-212
[18] 迟 堃.城市污水处理菌藻共生系统中影响藻类生长的因素研究[D]. 哈尔滨:哈尔滨工业大学, 2010.
[19] 陶 羽.混合微藻碳酸酐酶的环境调控及菌藻共生体系研究[D]. 哈尔滨:哈尔滨工程大学, 2013.
[20] Li J, Zheng X, Liu K, et al. Effect of tetracycline on the growth and nutrient removal capacity of Chlamydomonas reinhardtii in simulated effluent from wastewater treatment plants [J]. Bioresource Technology, 2016,218:1163-1169.
[21] Cho H U, Kim Y M, Park J M. Enhanced microalgal biomass and lipid production from a consortium of indigenous microalgae and bacteria present in municipal wastewater under gradually mixotrophic culture conditions [J]. Bioresource technology, 2017,228:290-297.
[22] Shetty V, Mokashi K, Sibi G. Variations among Antioxidant Profiles in Lipid and Phenolic Extracts of Microalgae from Different Growth Medium [J]. Journal of Fisheries and Aquatic Science, 2015,10(5):367.
[23] Sivasubramanian V, Subramanian V V, Murali R, et al. Algal biomass production integrated with sewage treatment and utilization as feedstock for bio-fuel [J]. Journal of Algal Biomass Utilization, 2012, 3(2):65-70.
[24] Renuka N, Sood A, Ratha S K, et al. Nutrient sequestration, biomass production by microalgae and phytoremediation of sewage water [J]. International journal of phytoremediation, 2013,15(8):789-800.
Influences of sewage treatments technologies on microalgae and bacteria community structures.
WANG Hua-guang1, WANG Wen-jing2, SHENG Yan-qing2*
(1.Yantai Zhen De Testing Group Company, Yantai 264000, China;2.Yantai Institute of Coastal Zone Research, Chinese Academy of Science, Yantai 264003, China)., 2018,38(10):3761~3766
Microalgae and bacteria communities related to sewage treatments were cultured with activated sludge from a brewery. And then, they were used to treat sewage from the brewery under two experimental conditions: Treatment 1 (Filtered and sterilized sewage) and Treatment 2 (filtered but unsterilized sewage). Compositions of microalgae and bacteria communities were analyzed during the experiments. After 20 days incubation, microbial community structures notably changed in all treatments.andsp. became dominant bacteria communities in Treatment 1and Treatment 2, and the abundances of unidentified OPB35increased significantly. Butdecreased significantly in two treatments. The removal rates of chemical oxygen demand (COD) in Treat. 1and Treat. 2were 73.7% and 67.2%, respectively. What is more, microalgae grew well in the two treatments. Results showed that microalgae communities significantly influenced bacteria community compositions in Treat. 1and Treat. 2and there were no significantly differences in the removal efficiencies of CODCrin two treatments.
microalgae;associated bacteria;sewage treatment;CODCr
X172
A
1000-6923(2018)10-3761-06
王华光(1986-),男,山东烟台人,工程师,硕士,从事水环境治理.发表论文5篇.
2018-03-14
国家自然科学基金资助项目(31600370,41373100);烟台市重点研发计划(2018ZHGY080,2018ZHGY083)
* 责任作者, 研究员, yqsheng@yic.ac.cn

