小鼠心肌缺血/再灌注损伤中TTC染色方法的改进及蛋白酶体作用机制的探讨
田 翠 来 松 徐多娇 侯翠柳 刘 洋 王红霞 杨 慧
缺血/再灌注(ischemia/reperfusion, I/R)损伤是在缺血的基础上恢复血流后组织损伤反而加重,甚至发生不可逆性损伤的现象[1],其发生机制复杂,尚未完全明了。心肌梗死面积是评价心肌缺血/再灌注损伤的重要指标[2]。目前国内外研究中用于评价心肌梗死面积的染色方法主要是TTC染色(triphenyltetrazolium chloride,2,3,5-氯化三苯基四氮唑)[3-4]和TTC-Evans blue 双染方法。TTC-Evans blue双染的方法优点是能够确定梗死面积,危险区面积和非缺血区面积[5],但其操作困难,失败率较高,并没有广泛使用。泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解,其在心血管疾病中具有重要的病理生理学意义,本实验室前期研究结果提示泛素蛋白酶体系统参与了缺血/再灌注损伤过程[6],但其作用仍需进一步探讨。本研究旨在优化目前的TTC-Evans blue双染方法,并探讨蛋白酶体各个亚基在I/R损伤中的作用。
材料与方法
1.实验材料 SPF,雄性,C57BL/6J(野生型, WT)小鼠,8周,16只,购自北京维通利华实验动物技术有限公司(动物许可证号SCXK(京) 20120001),随机分为两组:①假手术组(Sham组);②心肌缺血/再灌注组(I/R组)。
2.主要试剂 TTC和Evens blue染料均购自美国Sigma 公司;抗β1单抗、抗β2单抗、抗β5单抗、抗β1i单抗、抗β2i单抗和抗β5i单抗均购自abcam 公司;羊抗鼠IgG 抗体-辣根过氧化物酶标记购自美国Santa Cruz 公司;Tween-20 等购自美国Sigma 公司;蛋白酶体活性检测试剂盒购自美国的Promage公司;Caspase 3 活性检测试剂盒购自碧云天生物技术有限公司,TUNEL染色试剂盒购自Roche公司。
3.小鼠心肌缺血再灌注模型建立 小鼠经三溴乙醇麻醉,固定,从左侧胸壁第4、5肋间打开胸腔,暴露心脏,在左冠状动脉前降支位置处结扎,使其缺血45min,后松开再灌注2h,复制I/R模型,Sham组小鼠仅将线穿过前降支,不结扎[7]。
4.TTC-Evans blue双染方法 重新结扎前降支,再迅速分离出主动脉弓,剪断主动脉放血,主动脉逆向注入1% Evans blue;快速剪取心脏,置放在冰0.9%氧化纳氢中,解开结扎的前降支,用平头带有凹槽的7号注射器针头逆行主动脉插管并固定;缓慢将37℃温浴的1%TTC溶液注入心脏,在37℃孵育3~4min;之后剪去心耳,向心腔内注入15%的藻酸盐糊剂固形,等干燥后,置于4%多聚甲醛中固定12~24h;将心脏置于切片模具中,浇以10%琼脂糖,待冷却后用薄刀片将其均匀切成5~6片(约1 mm);按顺序正反面照相,用Image J软件计算梗死区、危险区、远端区及总面积。
5.组织总泛素化蛋白的表达检测 取心肌组织匀浆上清,SDS-PAGE 电泳后转至PVDF 膜,室温封闭60 min,孵育抗β1,β2,β5,β1i,β2i,β5i一抗(1∶1 000),4℃过夜。TBST洗膜后,室温孵育羊抗鼠IgG 抗体-辣根过氧化物酶标记二抗60min,通过凝胶成像系统成像。
6.蛋白酶体活性及Caspase 3活性检测 取心肌组织匀浆上清,用专用黑色96 荧光检测板检测泛素26 S 蛋白酶体活性。糜蛋白酶、半胱天冬酶、胰蛋白酶活性检测时分别加入的特异抑制剂为:10nmol/L bortezomib、25μmol/L Ac- APnLD- al、20 mol/L leu-peptin。37℃,避光孵育2h,Tecan 光谱仪检测荧光,激发光和发射光波长分别是360nm和465nm,检测蛋白酶体各亚基活性;另取 50~200μg 组织匀浆上清,加入50μL 的2×Reaction Buffer,加入5μL Caspase-3 Substrate 并于37℃ ,避光孵育4h,酶标仪检测405nm吸光值测定Caspase-3 活性。
7.TUNEL染色 心脏在4%多聚甲醛中固定,然后用石蜡包埋、切片(厚度5μm),按照罗氏试剂盒说明书进行TUNEL染色。采用Nikon Labophot2显微镜进行采图(×200)。选择6~8个视野,应用Image J软件统计每个视野中的细胞核数目及凋亡细胞数,计算凋亡细胞与总细胞的比值即为阳性凋亡百分数。
8.统计学方法 应用SPSS16.0 数据处理系统进行数据分析。计量资料以均数±标准差表示,各组间计量资料的比较采用单因素方差(one way ANOVA)分析。以P<0.05 为差异有统计学意义。
结 果
1.改良的TTC-Evans blue双染法可以明确显示心肌I/R损伤时的形态学变化 在I/R模型上,采用改良的TTC-Evans blue双染方法可以明确显示梗死区(infarct area,呈白色)、危险区(area at risk, AAR,呈红色)和远端区(呈蓝色)面积。与sham组相比,I/R组梗死面积/危险区面积明显增加(32.6%,n=8,P<0.01),sham组与I/R组危险区面积/总面积无显著差异,与文献报道一致[7](图1)。
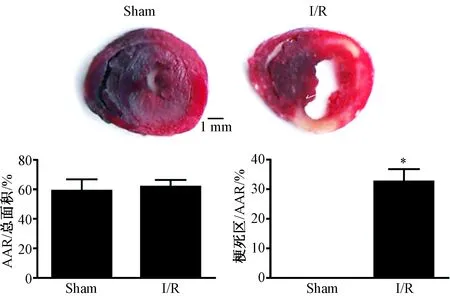
图1 I/R损伤引起心肌细胞死亡心肌组织TTC染色结果,梗死区(Infarct Area)呈黄白色,危险区(AAR) 呈红色,远端区呈蓝色(n=8,* P <0.01)
2.I/R损伤后心肌细胞凋亡明显增多 TUNEL染色结果显示,I/R损伤引起心肌细胞凋亡数明显增加,是假手术组的5.47倍(n=8,P<0.01);I/R损伤造成心肌组织中Caspase-3 的活性明显增高,为Sham组的2.8倍 (n=8,P<0.05,图2)。

图2 I/R损伤加重心肌细胞凋亡A:心肌组织TUNEL染色结果:α-actinin显示心肌细胞呈红色荧光;TUNEL染色显示凋亡的细胞呈绿色荧光;DAPI染色显示细胞核呈蓝色B:心肌组织Caspase-3活性测定结果(n=8,*P <0.05,**P<0.01)
3.I/R损伤后心肌细胞内蛋白酶体活性被抑制 为了探索心肌I/R损伤的发病机制,检测了I/R模型中危险区蛋白酶体肽酶活性变化。与Sham组相比,I/R组心肌组织蛋白酶体活性均降低,其中胰蛋白酶(β1)降低16%、半胱天冬酶(β2)降低6%、糜蛋白酶(β5) 降低32%,糜蛋白酶的变化有显著性差异(n=8,P<0.05,图3)。

图3 I/R损伤时心肌组织中蛋白酶体的活 性受到抑制(n=8,*P<0.05)
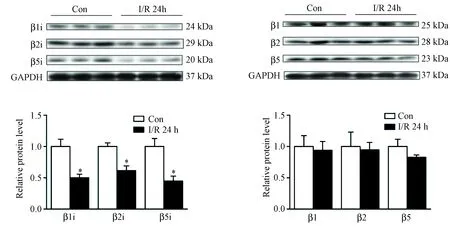
图4 I/R损伤时心肌组织中蛋白酶体及免疫蛋白酶体各亚基的表达降低(n=8,*P<0.05)
4.I/R损伤时心肌组织中蛋白酶体及免疫蛋白酶体各亚基的表达降低 进一步检测蛋白酶体亚基β1、β2、β5和免疫蛋白酶体β1i、β2i、β5i蛋白含量表达。I/R组组成型蛋白酶体亚基β1、β2、β5蛋白表达呈降低趋势,但差异无统计学意义,分别比sham组下降3%、6%和16%;而免疫蛋白酶体β1i、β2i、β5i蛋白表达显著降低,分别比sham组下降49%、48%和54%(n=8,P<0.05,图4)。
讨 论
TTC是一种脂溶性光敏感复合物,它是呼吸链中吡啶—核苷结构酶系统的质子受体,能与活细胞线粒体内的琥珀酸脱氢酶反应,生成红色化合物,从而使有活力的细胞呈现红色。而死亡细胞由于脱氢酶活力已经消失,TTC无法还原,因此梗死组织呈现白色[5-6]。TTC染色的优点是操作简单,容易实施;缺点是不能保证缺血面积的均一性,迄今为止一直没有统一标准的实验步骤。TTC- Evans blue双染色的原理是在TTC染色的基础上加上Evans blue染色。Evans blue 是一种蓝色染料,主动脉逆行灌注染料能够到达心脏除结扎的前降支以外的其他血管,渗入组织,从而使未结扎区呈现蓝色。目前国内外发表的文章中两种方法均有应该,既然TTC-Evans blue双染明显优于TTC染色,为什么还没有被普遍使用?究其原因主要有两个:第一,通过主动脉逆行灌注Evans blue时,血管闭合或者压力太大,导致蓝色灌不进去,也容易导致用力过猛蓝色过度着色;第二,TTC染色时由于需要反复多次通过主动脉灌注TTC溶液,难以固定主动脉插管。针对存在的这些问题,本实验做了三点改进:首先,剪断主动脉放血,减轻主动脉及冠状动脉内的压力;其次,使用一种自制的头部带有橡胶圈的眼科镊固定主动脉,防止滑脱,将平头且带有凹槽的(便于固定)5 mL注射器针头逆行插入主动脉,并用打结固定,保证TTC溶液和Evans blue成功灌注;另外,心脏切片时使用一种小组织切片模具,以保证心脏切片平整,并且每个组织切片的厚度一致。改良的TTC-Evans blue双染方法可以更好地显示梗死区、危险区和远端区面积,为I/R损伤引起的心肌梗死机制的研究提供了可靠形态学的支持。
I/R损伤过程伴有大量细胞凋亡及死亡,伴随细胞内大量蛋白质的降解。真核细胞内80%的蛋白质被UPS降解。UPS主要包括泛素激活酶(E1)、泛素转运酶(E2)、泛素连接酶(E3)和26S蛋白酶体。其中26S蛋白酶体,由20S催化核心颗粒和19S调节颗粒组成[9]。20S核心颗粒含有3个具有酶活性的组成型催化亚基β1、β2、β5,分别具有类似半胱天冬酶(caspase-like)、胰蛋白酶(trypsin-like)和糜蛋白(chymotrypsin-like)三种肽酶的活性,它们在维持正常的细胞周期、细胞增殖、细胞生存等方面发挥着重要的作用[10-11]。在促炎症因子如γ干扰素(INF-γ)等刺激下,β1、β2、β5亚基可被诱导型催化亚基β1i、β2i、β5i取代,形成免疫蛋白酶体[12]。目前的研究已证实蛋白酶体参与缺血再灌注的发生[6],但是蛋白酶体如何调节I/R损伤的机制尚不清楚,本实验初步探索了蛋白酶体功能与心肌I/R损伤的关系。改良的TTC-Evans blue双染色方法可以很好的显示心肌梗死区域(图1),基于此,本实验还检测了心肌细胞的凋亡及Caspase-3活性,结果发现I/R促进了心肌细胞凋亡及Caspase-3活性的增加(图2),与文献报道一致。有趣的是,危险区心肌组织中糜蛋白酶样活性显著降低(图3),而且免疫蛋白酶亚基β1i、β2i、β5i蛋白表达显著下降(图4)。此结果提示,心肌I/R时细胞内蛋白酶体尤其是免疫蛋白酶功能严重受损,加重了心肌细胞的凋亡及坏死。
本实验改良了TTC-Evans blue双染的方法,使其易于操作,提高了染色的成功率,为心肌缺血坏死性疾病研究提供可靠的形态学支持。另外发现免疫蛋白酶体的功能抑制可能加重了I/R损伤的过程,为临床研究I/R损伤机制提供新的思路,为新药物的开发提供了靶点。

