化学反应及能量转化易错问题剖析
■河南省郸城县第一高级中学 赵艳梅
化学反应与能量转化是化学热力学与动力学知识的综合,是每年高考必考内容,既有基础性试题,也有综合性问题,基础知识不扎实的同学在处理这类问题时,常常会出现一些不应有的错误。下面就其常见的一些易错题型归类分析如下,供学习时借鉴参考。
易错点一:准确理解概念
例1 下列热化学方程式中ΔH能正确表示物质的燃烧热或中和热的是( )。
B.KOH(aq)+HAc(aq)==KAc(aq)+H2O(l) ΔH=-57.3kJ·mol-1
C.C8H18(l)+12.5O2(g)==8CO2(g)+9H2O(l) ΔH=-5518kJ·mol-1
D.CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-533kJ·mol-1
错因分析:本题主要是考查燃烧热、中和热等概念,有的同学对这些概念理解不准确,对关键字词把握不到位,导致错选。
解析:反应热化学方程式中生成的是2mol水,生成硫酸钡沉淀也放热,反应的中和热不是57.3kJ·mol-1,故A项错误;HAc是弱酸,电离时要吸热,反应的中和热不是57.3kJ·mol-1,故B项错误;符合燃烧热的概念,可燃物为1mol,产物为稳定氧化物,故C项正确;反应热化学方程式中生成的水是气体,不是稳定氧化物,故D项错误。
答案:C
误区警示:准确理解概念是正确答题的基础。像燃烧热、中和热、焓变、热化学方程式等都是化学反应与能量变化知识考查中常遇到的基本概念,掌握其内涵与外延关系及注意事项,才能准确解题。
纠错巩固1:如果向足量Ba(OH)2溶液中加入100mL0.4mol·L-1HCl溶液时,放出的热量为2.292kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式及中和热的有关叙述中正确的是 ( )。
A.中和热ΔH=-57.3kJ·mol-1
B.稀的强酸与强碱反应的中和热为ΔH=-128kJ·mol-1
D.在溶液中Ba2+与SO2-4生成1mol BaSO4时会放出13.4kJ的能量
答案:D
易错点二:热化学方程式的书写
例2(1)真空碳热还原—氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s)==3AlCl(g)+3CO(g) ΔH=akJ·mol-1
3AlCl(g)==2Al(l)+AlC13(g) ΔH=bkJ·mol-1
试写出反应Al2O3(s)与C(s)反应生成Al(l)和CO(g)的热化学方程式:____。
(2)0.3mol气态高能燃料乙硼烷(B2H6)在O2中燃烧,生成固态的B2O3和液态水,放出649.5kJ热量,其热化学方程式为____。又已知:H2O(l)==H2O(g) ΔH=+44kJ·mol–1,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是____kJ。
错因分析:对于这类问题,常见的错误形式有:不标明或标错物质的状态(特别是水)、ΔH的单位或正负号出错,不注意量的关系等。
解析:(1)根据盖斯定律,将所给热化学方程式相加即可。
(2)先写出乙硼烷燃烧的化学方程式,找出乙硼烷的物质的量与ΔH之间的关系,并算出ΔH,再按照热化学方程式书写要求写出其结果。先写出乙硼烷完全燃烧生成气态水时的热化学方程式B2H6(g)+3O2(g)==B2O3(s)+3H2O(g) ΔH=-2033kJ·mol-1,再计算0.5mol乙硼烷燃烧放出的热量。
答案:(1)Al2O3(s)+3C(s)==2Al(l)+3CO(g) ΔH=(a+b)kJ·mol-1(2)B2H6(g)+3O2(g)==B2O3(s)+3H2O(l)ΔH=-2165kJ·mol-11016.5kJ
误区警示:书写热化学方程式的依据形式很多,如依据化学计算、图像图表、盖斯定律、限定信息等,因此,书写热化学方程式时,一要注意解题依据,二要遵循热化学方程式书写的基本要求,合理书写。
纠错巩固2:(1)天旱时,可用单级小火箭发射碘化银进行人工降雨,小火箭使用的主要燃料是偏二甲肼(C2H8N2)。现取6.0gC2H8N2(l)在O2中充分燃烧后生成8.8gCO2、7.2g H2O(g)和2.8gN2,同时放出热量QkJ,写出C2H8N2燃烧的热化学方程式:___。
(2)25℃、101kPa条件下充分燃烧一定量的丁烷气体放出热量为QkJ,经测定,将生成的CO2通入足量澄清石灰水中产生25g白色沉淀,写出表示丁烷燃烧热的热化学方程式:___。
答案:(1)C2H8N2(l)+4O2(g)==2CO2(g)+4H2O(g)+N2(g) ΔH===4CO2(g)+5H2O(l) ΔH=-16QkJ·mol-1
易错点三:忽略物质的聚集状态
例3已知H2(g)+Br2(l)==2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他的相关数据如表1。

表1
则表中a为( )。
A.404 B.260 C.230 D.200
错因分析:根据反应热概念,可列式:ΔH=436kJ·mol-1+akJ·mol-1-2×369kJ·mol-1=-72kJ·mol-1,计算得a=230,故选C项。该计算未考虑到题给热化学方程式中Br2呈液态,而表格中Br2呈气态,其间是存在能量差异的。
解析:根据题意可以写出Br2(l)转化为溴蒸气时的热化学方程式:Br2(l)==Br2(g) ΔH=+30kJ·mol-1,这样可得:H2(g)+Br2(g)==2HBr(g) ΔH=-102kJ·mol-1;再根据ΔH=436kJ · mol-1+akJ·mol-1-2 ×369kJ·mol-1=-102kJ·mol-1,计算得a=200。
答案:D
误区警示:物质状态不同时,化学反应的热效应是不同的,因此,反应热计算或依据计算书写热化学方程式时,都要注意物质的聚集状态,尤其是写热化学方程式时,一定不能忽略物质的聚集状态。如CH4燃烧生成气态水和生成液态水,其ΔH是不同的。
纠错巩固3:已知乙烯和乙炔燃烧的热化学方程式分别为:
2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l) ΔH=-2600kJ·mol-1
C2H4(g)+3O2(g)==2CO2(g)+2H2O(l) ΔH=-1411kJ·mol-1
又知燃烧时乙炔比乙烯的火焰温度高。据此,下列说法错误的是( )。
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少
D.1mol乙烯完全燃烧生成气态产物时,放出的热量小于1411kJ
答案:A
易错点四:不清楚物质结构
例4已知H—H键能为436kJ·mol-1,H—N键能为391kJ·mol-1,根据热化学方程式-92.4kJ·mol-1,则N≡N键的键能为( )。
A.431kJ·mol-1B.945.6kJ·mol-1
C.618.4kJ·mol-1D.649kJ·mol-1
错因分析:根据ΔH=反应物的键能之和-生成物的键能之和,可求得:ΔH=E(N≡N)+3 × 436kJ· mol-1-2 ×391kJ·mol-1=-92.4kJ·mol-1,则E(N≡N)=-618.4kJ·mol-1,选C项。上述计算结果错误,主要是对NH3的结构未理解清楚,这样导致其共价键数目未确定准。
解析:依据键能计算化学反应热时,一要弄清楚物质的结构情况,知道每摩尔物质中所含共价键的数目;二要理解ΔH计算式的列式依据,即化学反应中断键是吸热过程,成键是放热过程,因此,-92.4kJ·mol-1=E(N≡N)+3×436kJ·mol-1-2×3×391kJ·mol-1,解得:E(N≡N)=945.6kJ·mol-1。
答案:B
误区警示:依据键能计算反应热时,除把握准计算公式外,还要弄清有关物质中的共价键数目,如本题中,一个分子中含3个H—N键。其他如CH4、P4、PCl5、S8、晶体Si、SiO2晶体等物质中的共价键情况也要弄清楚。
纠错巩固4.已知图1中E1=134kJ·mol-1,E2=368kJ·mol-1,根据要求回答问题:

图1
(1)图1是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是____(填“增大”“减小”或“不变”,下同),ΔH的变化是____。请写出NO2和CO反应的热化学方程式:___。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)==CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
又知③H2O(g)==H2O(l) ΔH=-44kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为____。
(3)表2所示为部分化学键的键能参数。
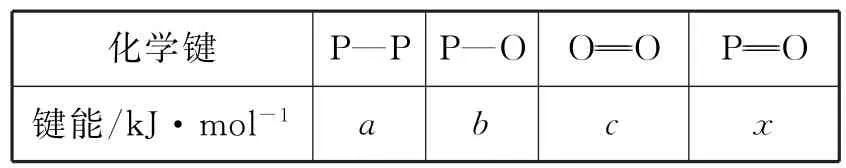
表2
已知白磷的燃烧热为dkJ·mol-1,白磷及其完全燃烧的产物的结构如图2所示,则表中x=____kJ·mol-1(用含a、b、c、d的代数式表示)。

图2
答案:(1)减小 不变 NO2(g)+CO(g)==CO2(g)+NO(g) ΔH=-234kJ·mol-1
易错点五:对图示观察不力
例5图3是乙烷、二甲醚燃烧过程的能量变化图,请回答下列问题:

图3
(1)乙烷的燃烧热ΔH=____kJ·mol-1。
(2)根据图3写出二甲醚燃烧热的热化学方程式:____。
错因分析:常见错误答案为(1)
(2)aCH3OCH3(g)+cO2(g)==dCO2(g)+H2O(l) ΔH=-485kJ·mol-1。主要问题是对图示观察不仔细,其实,根据图示信息是可以知道a、c、d的值的。
解析:根据图示,生成物H2O前的计量数为1,根据元素守恒可知,则图示中两种物质燃烧的热化学方程式分别为:
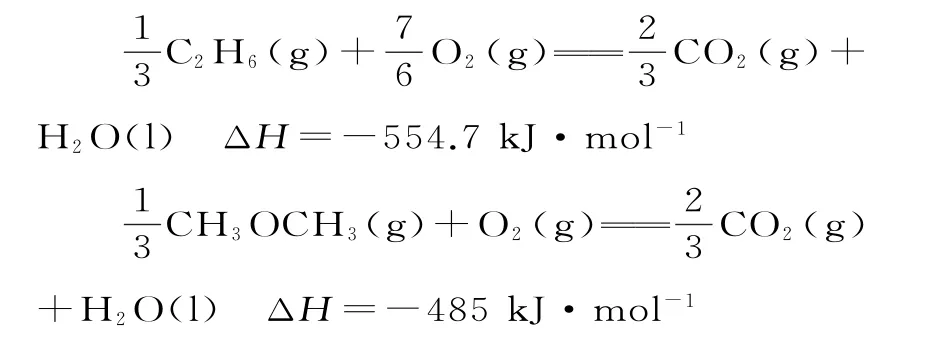
再根据燃烧热定义,可知乙烷的燃烧热ΔH=-1664.1kJ·mol-1;二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)==2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1。
答案:(1)1664.1
(2)CH3OCH3(g)+3O2(g)==2CO2(g)+3H2O(l) ΔH=-1455kJ·mol-1。
误区警示:处理图像问题时,除要弄懂点、线、面的意义外,还要注意图示中其他的一些信息,如数据、符号、字母等提示内容,从中找到对解题有帮助的东西;另外还要注意反应物和生成物的能量高低,以确定反应是吸热还是放热。
纠错巩固5:(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。图4是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___。
(2)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图5所示(图中的ΔH表示生成1mol产物的数据)。回答下列问题:
①P和Cl2反应生成PCl3的热化学方程式为____。
②PCl5分解成PCl3和Cl2的热化学方程式是____。

图4

图5
(3)科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇(CH3OH)为燃料的燃料电池。已知:
请回答下列问题:
液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为____。
答案:(1)NO2(g)+CO(g)==CO2(g)+NO(g) ΔH=-234kJ·mol-1
(3)CH3OH(l)+O2(g)==CO(g)+2H2O(l) ΔH=-443.5kJ·mol-1

