极地海洋真菌赛氏曲霉活性成分研究
刘洪成,曲振宏,姜洪芳,张锋伦,石宝俊
(1.南京野生植物综合利用研究院, 江苏 南京211111;2.南京佳洪药业有限公司,江苏 南京210042)
海洋独特的生态环境使其成为能产生新型结构先导化合物的重要生物来源,众多的生物来源中又以海洋微生物为主力军。海洋微生物的分布极其广泛,而被人类分离和鉴定的海洋微生物种类少之又少,仅约占自然界总量的1%,基本上处于尚未被开发。不同于陆地微生物,海洋微生物生长在高盐,高压,寡营养,缺氧,缺少阳光等这一海洋特殊环境中,在其生长代谢过程中,能产生结构新颖并具有多种生物活性的次级代谢产物。此外,海洋微生物具备生长周期短、资源丰富多样、适于大规模培养、受其他因素限制较小等优势。作为海洋微生物重要组成之一的真菌也一直成为大家的焦点,从真菌中开发出具有多重生物活性的新型药物是解决目前药物短缺的一个重要手段。
目前,真菌已经成为药学领域研究较为透彻的微生物来源,从真菌中已经分离出了大量的生物活性物质,其中具有细胞毒性的物质包括大分子的多糖和蛋白质,还包括小分子的萜类、大环内脂类和生物碱类。据已有研究显示,从赛氏曲霉中分离出的单体化合物具有显著的细胞毒活性和抗肿瘤活性。 赛氏曲霉PFW-13的真菌从海南省海口市白沙门海滩浮游物质中分离出来,发酵产物显示明显的坏死细胞毒性活性和细胞周期抑制。通过活性追踪方法,从六个吲哚、喹唑啉生物碱类似物中分离其活性位点。采用流式细胞术联合形态学测定,MTT和SRB方法评估单体化合物的体外抗肿瘤活性。 在抗菌实验中,化合物14-norpseurotin A、hydrohelvolic acid和helvolic acid对大肠杆菌、枯草芽孢杆菌、溶壁微球菌显示不同的抗菌活性。
当前应用于临床的药物耐药性不断增强,不仅给医生的治疗带来障碍,更是对病人身体极大伤害。耐甲氧西林金黄色葡萄球菌(MRSA)引起的医院感染事件自1961年在英国首次报道以来,MRSA的检出率逐年上升,从医院检出到社区检出,可见其感染性极强,目前以其高致病性和多药耐药性被列为世界上最难解决的三大感染性顽疾之一。随着NICU出现了首例MRSA感染患儿之后,MRSA成为了危重新生儿感染的一个主要原因,对新生儿家庭以及对社会造成了严重的负担。耐药菌的存在给整个社会带来了严重的弊端,需要我们寄予重视,并且采取行之有效的方式解决,开发用于抑制临床耐药菌的新型结构先导化合物乃当务之急。
通过对实验室中现有的23株真菌进行活性筛选,发现海洋真菌赛氏曲霉(Aspergillussydowii)活性较为显著,结合现有对赛氏曲霉活性研究现状,现拟从中筛选纯化出最适用于抑制临床耐药菌的新型结构化合物。
1 实验材料
1.1 土样
南极长城站(62.22 °S, 58.96 °W)附近海域的海泥,于-40 ℃保存。
1.2 试剂
酵母提取物(英国OXOID), 胰蛋白胨(英国OXOID), 青霉素(上海生工生物工程技术服务有限公司), 链霉素(上海生工生物工程技术服务有限公司), 替加环素(大连美仑生物技术有限公司), 氟康唑(北京百灵威科技有限公司), 孟加拉红培养基(生化试剂)(国药集团化学试剂有限公司), RPMI 1640培养基(BIOFIL公司), 柱层层析硅胶(试剂级)(青岛海洋化工厂分厂), 薄层层析硅胶(化学纯)(青岛海洋化工有限公司), 硅胶板(青岛海洋化工厂分厂), ODS(Shimadzu公司), Sephadex LH-20(Pharmacia公司), 琼脂糖(Agarose LE)(Genebase Gene-tech Co.,Ltd.), Premix STAR max(南京诺维赞生物科技有限公司), ITS1和ITS4(南京诺维赞生物科技有限公司).
1.3 仪器
超净工作台(苏净集团安泰公司), GHX-9050B-1恒温培养箱(恒温摇床上海福玛实验设备有限公司), MLS-3751L高压灭菌锅(松下健康医疗器械株式会社), BioRad-T100 PCR仪(美国BioRad公司), TGL-16B 高速台式离心机(上海安亭科学仪器厂), 高效液相色谱仪(JASCO公司), HiQ sil C18w分析色谱柱(Hanbon公司), HiQ sil C18-15半制备色谱柱(YMC公司) , AVANCE AV-500核磁共振仪(Bruker公司), 恒温摇床(常州国华电器有限公司), 凝胶成像仪及分析系统(BioRad公司), 水平电泳槽(南京大学仪器厂), 高速台式离心机(上海安亭), YY-4稳压稳流电泳仪(南京新校园生物技术研究所), 酶标仪(BIO-RAD)。
1.4 培养基
大米培养基:大米100 g,海水晶30 g,无水硫酸镁0.3 g,水1000 mL。
LB液体培养基:胰蛋白胨5 g,酵母提取物2.5 g,氯化钠5 g,蒸馏水500 mL,pH 7.0。
YPD液体培养基:蛋白胨10 g,酵母提取物5 g,葡萄糖10 g,蒸馏水500 mL,pH 7.0。
1.5 抗性指示菌来源
耐甲氧西林金黄色葡萄球菌(Methicillin-resistant stphylococcus aureus, MRSA);耐甲氧西林表皮葡萄球菌(Methicillin-resistant stphylococcus epidermidis, MRSE);大肠杆菌(Escherichia coli ATCC 11229);白色念珠菌(Candida albicans)。
2 实验方法
2.1 菌株的分离纯化
2.1.1 土样处理
采用梯度稀释法,向9 g极地土样中加入90 mL无菌水,用玻璃珠充分搅拌混匀,吸取1 mL上清液加入9 mL的无菌水中,吹打均匀,以此浓度依次作10-1,10-2,10-3,10-4倍的梯度稀释。
2.1.2 菌株分离
用移液器分别吸取500 μL 不同稀释倍数的上清液,加入孟加拉红固体培养基上,将上清液用无菌涂布棒均匀涂布在整个平板上。将平板倒置28 ℃恒温培养箱中培养4~7 d。
2.1.3 菌株纯化培养
待长出单菌落后,根据三区平板划线法,挑取单菌落,接种于孟加拉红培养基中,将平板倒置28 ℃恒温培养箱中培养4~7 d。
2.1.4 保存菌株
待划线后纯化的菌落长成,挑取单菌落,接种于孟加拉红斜面培养基上,放置28 ℃恒温培养箱中培养4~7 d。待长出菌落后,加入无菌液体石蜡封藏,于-20 ℃冰箱保存。
2.2 菌种鉴定
2.2.1 基因组DNA提取
基因组DNA提取按照真菌基因组DNA提取试剂盒(Sangon Biotech公司)进行。
具体操作步骤如下:
基因组DNA的1%琼脂糖凝胶电泳:加样后于电压100~120 V电泳,并于254 nm观察,得到一条清晰、明亮的条带。
2.2.2 rDNA-ITS序列扩增
以提取的真菌基因组DNA为模板,通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')为上、下游引物,如表1~2反应体系和反应步骤进行PCR。

表1 PCR反应体系
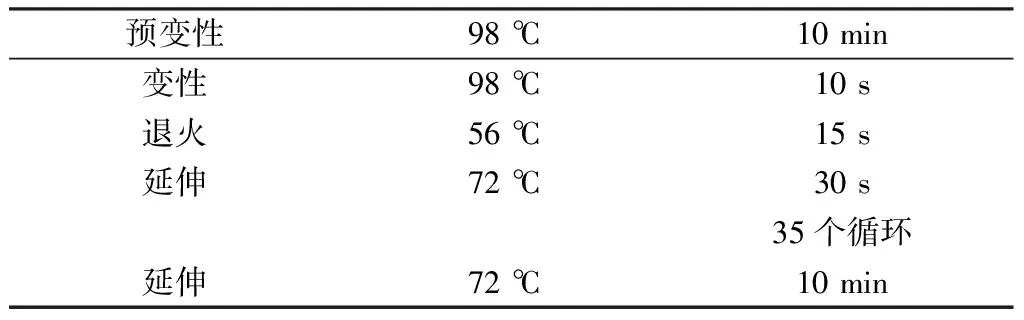
表2 PCR反应步骤
根据PCR产物的1%琼脂糖凝胶电泳结果(条带清晰、明亮),确定PCR产物结果与预PCR结果一致,可进行下一步测序操作。
2.2.3 扩增产物测序与系统进化树的构建
移送专业测序公司测序。 将所测得的真菌 rDNA-ITS序列在GenBank数据库中进行序列比对,并从数据库中选取相似度高的菌株,用Clustal X软件,进行多序列比对,然后用Mega4.1软件中的邻接法构建系统进化树。
2.4 菌株的发酵和发酵产物的预处理
2.4.1 接种培养
选取一个平板,刮取6 g干燥孢子,稀释到60 mL的无菌水中,摇匀,制成孢子悬液。
将该孢子悬液取1 mL接种到大米培养基中,放置28 ℃恒温培养箱静置培养20 d。
2.4.2 大米培养基的处理
将培养20 d的大米培养基碾碎后,用2 L 95%乙醇超声提取3次,提取液经过减压浓缩得到65 g棕色浸膏,再将浸膏溶解于150 mL水中,然后依次用石油醚、氯仿、乙酸乙酯、正丁醇等体积分别萃取3次,减压浓缩,得到7.23 g石油醚相,0.52 g氯仿相,1.06 g乙酸乙酯相,13.56 g正丁醇相。
2.5 SP-1次级代谢产物的分离
2.5.1 乙酸乙酯相的分离
采用ODS反相色谱柱对乙酸乙酯相(约1.06 g)进行分离。(1 BV=150 mL),采用甲醇∶水为流动相进行梯度洗脱(20%→40%→60%→100%),每个梯度洗脱4个柱体积。通过TLC分析,合并相同流分,得到4个组分:Fr.1(133.1 mg),Fr.2(137.4 mg),Fr.3(111.7 mg),Fr.4(18.9 mg)。
采用硅胶柱层析,对Fr.2(137.4 mg) 进行分离。将Fr.2溶解后拌入0.3 g硅胶(100~200目),烘干,称取7 g硅胶H,作柱填料(1 BV=25 mL)。以氯仿∶甲醇(20∶1→15∶1→8∶1→4∶1→1∶1)为流动相,进行梯度洗脱。通过TLC分析,合并相同流分,得到5个组分:Fr.2-1(3.2 mg),Fr.2-2(55 mg),Fr.2-3(20.8 mg),Fr.2-4(10.9 mg),Fr.2-5(7.3 mg)。
采用硅胶柱层析,对Fr.3(111.7 mg)进行分离。将Fr.3溶解后拌入0.5 g硅胶(100-200目),烘干,称取10 g硅胶H,作柱填料(1 BV=30 mL)。采用氯仿∶甲醇(20∶1→15∶1→8∶1→4∶1→1∶1)为流动相,进行梯度洗脱。通过TLC分析,合并相同流分,得到5个组分:Fr.3-1(0.6 mg),Fr.3-2(8.5 mg),Fr.3-3(0.7 mg),Fr.3-4(67.8 mg),Fr.3-5(7 mg)
对Fr.3-4(67.8 mg)进行液相制备,以15%乙腈(0.1%甲酸)为流动相,以210 nm为检测波长。得到化合物L-1(47.4 mg,出峰时间21 min)和L-2(6.7 mg,出峰时间26 min),均为白色固体化合物。
对Fr.2-2(55 mg)进行液相制备,以15%乙腈(0.1%甲酸)为流动相,以210 nm为检测波长,得到无色针状结晶L-3(3.3 mg,出峰时间16 min)。
乙酸乙酯相的分离流程图如图1。
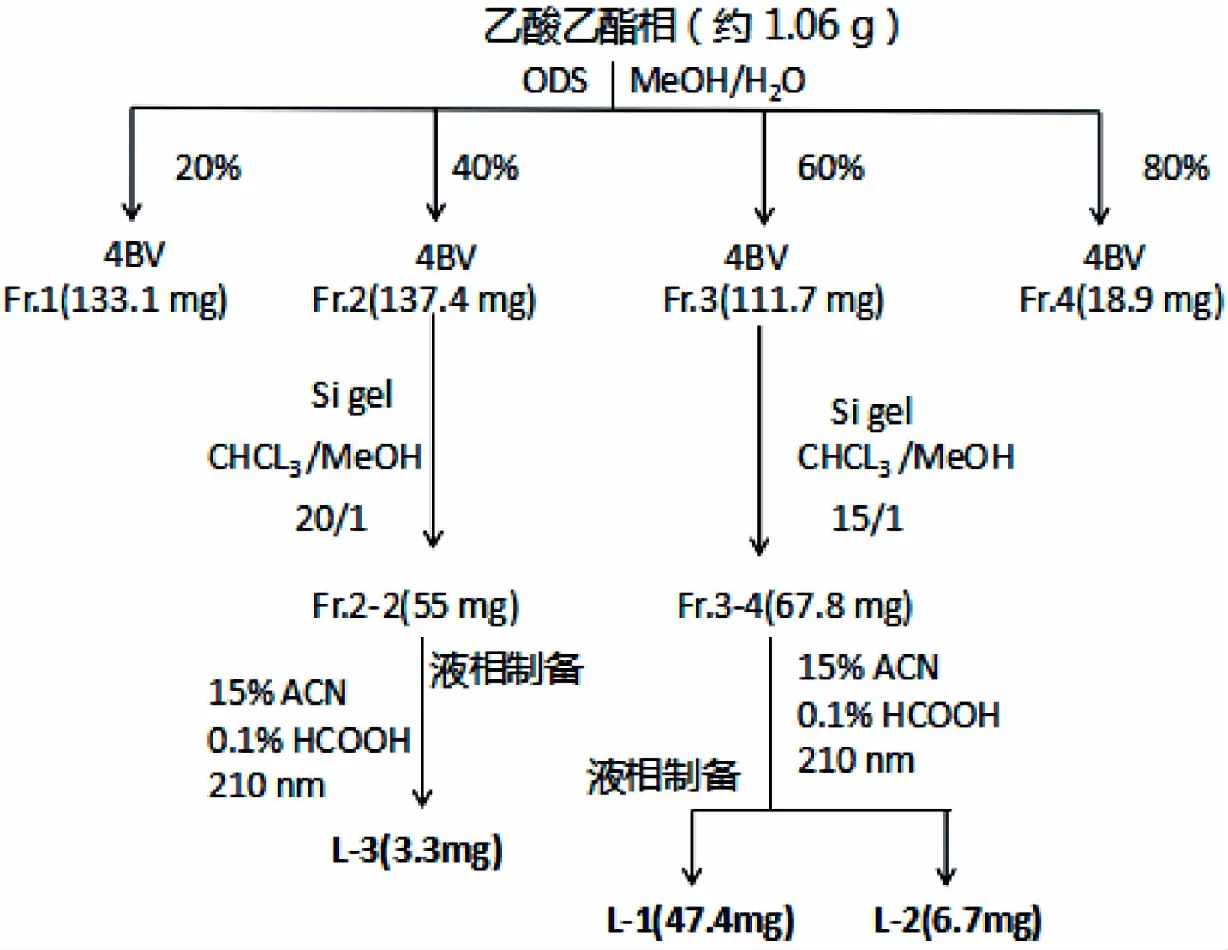
图1 乙酸乙酯相的分离流程
2.5.2 正丁醇相的分离
采用ODS反相色谱柱,对正丁醇相(13.56 g)进行分离。(1 BV=150 mL),采用甲醇∶水(10%→20%→40%→60%→100%)为流动相,进行梯度洗脱,每个梯度洗脱4个柱体积。通过TLC分析,合并相同流分,得到5个组分:Fr.1(350 mg),Fr.2(421.8 mg),Fr.3(111 mg),Fr.4(167.9 mg),Fr.5(121.5 mg)。
将正丁醇相Fr.1(350 mg)和乙酸乙酯相Fr.1(133.1 mg)合并,采用硅胶层析色谱柱对其进行分离。将样品溶解后拌入1 g硅胶(100~200目),烘干,称取15 g硅胶H,作柱填料。(1 BV=40 mL),采用氯仿:甲醇为流动相进行梯度洗脱(25∶1→18∶1→15∶1→10∶1→5∶1→3∶1→1∶1),通过TLC分析,合并相同流分,得到12个组分:Fr.1-1(4.1 mg),Fr.1-2(42.5 mg),Fr.1-3(5.8 mg),Fr.1-4(51 mg),Fr.1-5(35.4 mg),Fr.1-6(21.7 mg),Fr.1-7(7.2 mg),Fr.1-8(7.8 mg),Fr.1-9(13.5 mg),Fr.1-10(10.5 mg),Fr.1-11(45.9 mg),Fr.1-12(97.2 mg)。
Fr.1-5经过重结晶得到白色固体化合物,命名为L-4(10 mg)。Fr.1-9经过重结晶,得到无色针状晶体,命名为L-5(4 mg)。
正丁醇相的分离流程图如图2:

图2 正丁醇相的分离流程
2.5.3 氯仿相的分离
将氯仿相(0.52 g)以甲醇为流动相,经Sephadex LH-20分离。通过TLC分析,合并相同流分,得到9个组分:Fr.1(10.7 mg),Fr.2(24.3 mg),Fr.3(19.4 mg),Fr.4(90 mg),Fr.5(83.5 mg),Fr.6(19.2 mg),Fr.7(127.2 mg),Fr.8(5 mg),Fr.9(9.3 mg)。Fr.6经过重结晶,得到白色粉末化合物,命名为L-6(4.7 mg)。
对Fr.4(90 mg)采用硅胶柱层析进行分离。将Fr.4溶解后拌入0.4 g硅胶(100-200目),烘干,称取10 g硅胶H,作柱填料。(1 BV=30 mL),采用氯仿:甲醇为流动相进行梯度洗脱(40∶1→35∶1→30∶1→25∶1→20∶1→15∶1→10∶1→5∶1→3∶1),通过TLC分析,合并相同流分,得到8个组分:Fr.4-1(6.2 mg),Fr.4-2(8.5 mg),Fr.4-3(5.3 mg),Fr.4-4(2.3 mg),Fr.4-5(11.7 mg),Fr.4-6(5.2 mg),Fr.4-7(7.2 mg),Fr.4-8(25.2 mg)。Fr.4-2经过重结晶,得到白色粉末状化合物,命名为L-7(5.1 mg)。
氯仿相的分离流程图如图3:

图3 氯仿相的分离流程图
2.6 化合物的结构鉴定
运用现代波谱技术,对分离得到的单体化合物进行结构鉴定。将样品化合物用相应的氘代试剂溶解,应用AVANCE AV-500核磁共振仪,得到其核磁共振波谱信息(1H-NMR,13C-NMR)。
2.7 化合物MIC值的测定
2.7.1 抗细菌MIC值的测定
以MRSA, MRSE, 大肠杆菌作为指示菌,将其冻存甘油管于37 ℃水浴活化后,以0.1%接种量接种于LB液体培养基,在37 ℃,200 r/min条件下培养4~8 h,再用LB液体培养基进行稀释,得到105 CFU/mL细菌悬液。
每组样品设置10个浓度梯度,3个平行实验。用LB培养基对高浓度样品溶液进行稀释,得到1 mg/mL样品溶液,使溶剂含量小于1 %。向第1孔加入160 μL LB培养基,第2~10孔加入100 μL LB培养基,取40 μL浓度为1 mg/mL的样品溶液加入第1孔,再依次对各孔进行2倍稀释,使各孔浓度分别为200, 100, 50, 25, 12.5, 6.25, 3.13, 1.56, 0.78, 0.39 μg/mL;再向各孔加入100 μL 105 CFU/mL菌悬液,37 ℃静置培养12 h。阳性药物为替加环素。以200 μL LB培养基为调零组,100 μL LB培养基和100 μL 菌液为空白对照组。以完全无菌生长的最低浓度,作为最低抑菌浓度(MIC)。
2.7.2 抗真菌MIC值的测定
以白色念珠菌作为指示菌,将其冻存甘油管于30 ℃水浴活化后,以0.1%接种量接种于YPD液体培养基,30 ℃,200 r/min培养16 h,再用RPMI 1640培养基进行稀释,得到103 CFU/mL菌悬液。
每组样品设置10个浓度梯度,3个平行实验。用RPMI 1640培养基对样品进行稀释,得到1 mg/mL样品溶液,使溶剂含量小于1%。第1孔加入160 μL RPMI 1640培养基,第2~10孔加入100 μL RPMI 1640培养基,取40 μL浓度为1 mg/mL的样品溶液加入第1孔,再依次对各孔进行2倍稀释,使各孔浓度分别为200, 100, 50, 25, 12.5, 6.25, 3.13, 1.56, 0.78, 0.39 μg/mL;再向各孔加入100 μL 103 CFU/mL菌悬液,30℃静置培养24 h。阳性药物为氟康唑。以200 μL RPMI 1640培养基为调零组,100 μL RPMI 1640培养基和100 μL 菌液为空白对照组。以完全无菌生长的最低浓度,作为最低抑菌浓度(MIC)。
3 实验结果
3.1 菌株的序列分析
以ITS1和ITS4作为扩增引物,得到的扩增产物长度为500~750 bp。将PCR产物经1.0%琼脂糖凝胶电泳后,得到结果与预期结果一致。将PCR产物送至专业测序公司(南京思普金生物科技有限公司)进行测序。
SP-1的rDNA-ITS测序结果如下:
CTTTATGTTGAACCTGTGGAAGGATCATTACTGAGTGCGGGCTGCCTCCGGGCGCCCAACCTCCCACCCGTGAATACCTAACACTGTTGCTTCGGCGGGGAGCTCCCTCGGGGGCGAGCCGCCGGGGACTACTGAACTTCATGCCTGAGAGTGATGCAGTCTGAGTCTGAATATAAAATCAGTCAAAACTTTCAACAATGGATCTCTTGGTTCCGGCATCGATGAAGAACGCAGCGAACTGCGATAAGTAATGTGAATTGCAGAATTCAGTGAATCATCGAGTCTTTGAACGCACATTGCGCCCCCTGGCATTCCGGGGGGCATGCCTGTCCGAGCGTCATTGCTGCCCATCAAGCCCGGCTTGTGTGTTGGGTCGTCGTCCCCCCCGGGGGACGGGCCCGAAAGGCAGCGGCGGCACCGTGTCCGGTCCTCGAGCGTATGGGGCTTTATCACCCGCTCGACTAGGGCCGGCCGGGCGCCAGCCGACGTCTCCAACCATTTTTCTTCAGGTTGACCTCGGATCAGGTAGGGATACCCGCTGAACTTAAGCATATCAAT
利用NCBI中的BLAST工具,将该测序结果上传至GenBank数据库,发现菌株SP-1的rDNA-ITS序列与赛氏曲霉(Aspergillussydowii)的序列相似性达到98%,选取部分相似性较高的菌株,构建系统进化树如图4所示,最终鉴定该菌株为赛氏曲霉。

图4 SP-1的系统发育树
3.2 单体化合物形态和结构解析
3.2.1 化合物L-1的结构解析
1H-NMR(500 MHz, in CD3OD) δ(ppm):7.48(1H, dd,J=8.0, 1.0 Hz), 7.31(1H, d,J=8.0 Hz), 7.42(1H, d),1.65(3H, s), 1.39(2H, m), 1.38(2H, m), 1.37(2H, m), 1.15(3H, s), 1.14(3H, s);
13C-NMR(500 MHz, in CD3OD) δ(ppm):169.9(C), 156.9(C), 137.9(C), 131.7(C), 127.8(CH), 121.6(CH), 118.7(CH), 78.0(C), 71.4(C), 45.0(CH2), 29.2(CH3), 29.1(CH3), 29.0(CH3), 20.1(CH2) 。
化合物L-1为白色粉末状。分子式为C15H22O5。1H-NMR 在6~8 ppm间显示有三个芳香氢信号,在高场区有三个明显的甲基信号,同时在高场区还存在三个明显的亚甲基信号;13C-NMR显示化学位移δ169.9说明有羰基的存在,156.9, 137.9, 131.7, 127.8, 121.6, 118.7显示有6个SP2杂化的碳原子,结合氢谱可知其归属于芳香环的6个碳原子。
与文献[16]比对, L-1的核磁数据与其报道的化合物8一致,因此确定L-1为hydroxysydonic acid。
3.2.2 化合物L-2的结构解析
1H-NMR(500 MHz, in CD3OD) δ(ppm):7.48(1H, dd,J=8.0, 1.0 Hz), 7.41(1H, d,J=1.0 Hz), 7.30(1H, d,J=8.0 Hz), 3.99(2H, dd,J=10.5, 5.9 Hz), 3.30(2H, d,J=10.5 Hz), 2.00(2H, m), 1.85(2H, m), 1.64(3H, s), 1.55(1H, m), 1.39(2H, m), 1.35(2H, m), 1.20(2H, m),1.08(2H, m), 0.87(3H, d,J=6.5 Hz);
13C-NMR(500 MHz, in CD3OD):170.2(C), 157.1(C), 138.0(C), 132.1(C), 127.9(CH), 121.7(CH),118.8(CH), 80.5(CH2), 78.1(C), 43.9(CH2), 36.9(CH), 34.8(CH2), 29.0(CH3), 22.6(CH2), 17.1(CH3)。
化合物L-2为白色粉末。分子式为C15H22O5,其不饱和度为5。1H-NMR 显示在6-8 ppm 间有一个芳香氢信号存在,在高场区显示有甲基信号存在;13C-NMR显示化学位移在170.2说明化合物中存在羰基,157.1, 138.0, 132.1, 127.9, 121.7, 118.8则归属于芳香碳原子。
通过与文献[16]比对,L-2的核磁数据与其报道中的化合物2一致,因此确定L-2为12-hydroxysydonic acid 。
3.2.3 化合物L-3的结构解析
1H-NMR(500 MHz, in CD3OD) δ(ppm):7.08(2H, d,J=8.5 Hz), 6.72(2H, d,J=8.5 Hz), 3.47(2H, s);
13C-NMR(500 MHz, in CD3OD):174.3(C), 156.0(C), 129.9(CH), 126.9(C), 114.8(CH), 39.8(CH2) 。
化合物L-3为无色针状结晶。分子式为C8H8O3,其不饱和度为5。1H-NMR 显示在6-8 ppm 间有两种芳香氢信号存在,且为双峰,化学位移分别为7.08(2H, d), 6.72(2H, d),提示化合物可能存在对位二取代苯环结构,在高场区显示亚甲基信号存在。13C-NMR显示化学位移在174.3表明有羰基存在,化学位移在156.0, 129.9, 126.9 , 114.8则归属于芳香碳信号,化学位移显示在39.8,则表示有饱和碳的存在。
通过与文献[17]比对,L-3的核磁数据与其中报道的化合物2一致,因此确定化合物L-3为对羟基苯乙酸(4-hydroxyphenylacetic acid) 。
3.2.4 化合物L-4的结构解析
1H-NMR(500 MHz, in CD3OD) δ(ppm):δ3.2(2H, t,J=6.9), 2.31(2H, t,J=7.4), 1.92(3H, s), 1.78(2H, m,J=7.1 Hz);
13C-NMR(500 MHz, in CD3OD): 176.9(C), 173.4(C), 39.8(CH2), 32.2(CH2), 25.8(CH2), 22.5(CH3)。
化合物L-4 为白色粉末。分子式为C6H11O3N。不饱和度为2。1H-NMR在高场区显示有甲基信号的存在。化学位移3.2(2H, t,J=6.9), 2.31(2H, t,J=7.4), 1.78(2H, m,J=7.1 Hz)显示,为三个连接在一起的亚甲基信号,13C-NMR显示有两个羰基信号,其化学位移在176.9, 173.4。
通过与文献[18]比对,L-4的核磁数据与其中报道的化合物7一致,因此确定化合物L-4为4-乙酰氨基丁酸(4-acetylaminobutanoic acid) 。
3.2.5 化合物L-5的结构解析
1H-NMR(500 MHz, in DMSO-d6) δ(ppm):8.34(1H, s), 8.14(1H, s), 5.88(1H, d,J=6.2 Hz), 4.61(1H, q,J=5.6 Hz), 4.14(1H, d,J=3.1 Hz), 3.96(1H, d,J=3.2 Hz), 3.67(1H, m), 3.55(1H, m);
13C-NMR(500 MHz, in DMSO-d6):152.4(CH), 149.1(C), 119.3(C), 156.2(C), 139.9(CH), 87.9(CH), 73.4(CH), 70.6(CH), 85.9(CH), 61.7(CH2)。
化合物L-5为无色针状结晶。1H-NMR在低场区显示出一个亚甲基信号,其化学位移是7.32(2H, s),显示有2个活泼氢信号。13C-NMR显示化学位移在152.4(CH), 149.1(C), 119.3(C), 156.2(C), 139.9(CH),表明为芳香碳信号。
通过与文献[19]比对,L-5的核磁数据与其报道中的腺嘌呤一致,因此确定化合物L-5为腺嘌呤(adenosine) 。
3.2.6 化合物L-6的结构解析
1H-NMR(500 MHz, in DMSO-d6) δ(ppm):10.89(1H, s), 7.88(1H, s), 7.69(1H, s), 7.51(1H, d,J=7.8 Hz), 7.35(1H, d,J=8.1 Hz), 7.19(3H, m), 7.08(1H, t,J=7.2 Hz), 7.01(2H, m), 6.76(2H, d,J=6.2 Hz), 4.01(1H, s), 3.89(1H, s), 2.84(1H, m), 2.57(1H, m), 2.52(1H, m), 1.91(1H, m);
13C-NMR(500 MHz, in DMSO-d6):166.7(C), 166.1(C), 136.5(8), 136(CH), 129.6(CH), 128.0(CH), 127.5(C), 126.3(CH), 124.3(CH), 120.8(CH), 118.7(CH), 118.4(CH), 111.3(CH), 108.8(C), 55.6(CH), 55.2(CH), 39.8(CH2), 29.6(CH2) 。
化合物L-6为白色粉末。1H-NMR在6-8 ppm 间显示有5种芳香氢信号存在,表明该化合物有可能含有两个苯环结构,在低场区显示有一个活泼氢信号;13C-NMR显示化学位移在166.7(C), 166.1(C)表明有2个羰基存在,化学位移在136.5(8), 136(CH), 129.6(CH), 128.0(CH), 127.5(C), 126.3(CH), 124.3(CH), 120.8(CH), 118.7(CH), 118.4(CH), 111.3(CH), 108.8(C)则分别归属于12个芳香碳。
通过与文献[20]比对,L-6的核磁数据与其报道中的化合物5一致,因此确定化合物L-6为Cyclo-(L-Trp-L-Phe) 。
3.3 抑菌活性的分析
抑菌活性分析见表3。

表3 化合物L-1~L-6的抑菌活性
4 讨 论
本实验以极地土样为样本来源,以筛取最具生物活性的菌株为主要目的,通过初步筛选得出菌株SP-1最具生物活性研究潜力。
本实验鉴定出来的赛氏曲霉,其产生的6个单体化合物中,L-1,L-2,L-3具有抑菌活性,其中,L-1, L-2和L-3对耐甲氧西林金黄色葡萄球菌均有抑菌活性。随着目前耐甲氧西林金黄色葡萄球菌的检出率越来越高,普遍及各类人群(以新生儿为主),而目前用于该菌感染的最佳手段仍然是采用抗生素治疗方案,大多采用万古霉素、克林霉素或万古霉素联合庆大霉素或利福平等两种抗生素协同使用,或三种抗生素联合使用的治疗方法。众所周知,大多数抗生素的耐药性也是处于不断增强中。L-1,L-2,L-3具有开发成新型抗耐药菌药物的潜力,从而促进临床抗耐药菌药物的研究进展。
目前,国内外对海洋真菌的研究虽取得很大进展,但研究过程中仍存在不足。在对海洋真菌相关化合物的基因组研究中发现,菌株的生物合成基因包含许多生物代谢途径,然而实验室相对复杂苛刻的海洋环境来说,所能激活菌株的代谢途径比较单一,表现在菌株次级代谢产物上就是形成的化合物结构类型比较少,在OSMAC(One Strain-Many Compounds)的策略发起时,该局限性得到了一定的改善。在针对众多潜力菌株时,采用该策略,通过改变发酵培养基、发酵条件来激活菌株沉默的代谢途径,从而产生一系列结构新颖、生物活性千差万别的天然产物。该策略使菌株次级代谢产物的结构类型大大增加,不仅可以产生常规条件下的化合物,更是可以产生独特环境、非常规条件下的新型化合物,从而更加系统地对潜力菌株进行结构分析和生物活性的研究,从而提高了潜力菌株的筛选价值。
据已有研究显示,从赛氏曲霉中可以分离出具有细胞毒活性和抗肿瘤活性的单体化合物,碱性蛋白酶广泛存在于真菌中,主要存在的种属是赛氏曲霉,即赛氏曲霉还作为碱性蛋白酶产生菌株的潜力菌株正在进行研究。
因此,我们可以将赛氏曲霉作为潜力菌株,从开发抗肿瘤药物和碱性蛋白酶方面对其进一步深入研究。同时可以采用OSMAC策略,以提高其筛选价值。

