黑青稞麸皮结合态酚类物质大孔树脂分离纯化工艺优化
杨希娟,党 斌※,张 杰,张文刚,陈丹硕
黑青稞麸皮结合态酚类物质大孔树脂分离纯化工艺优化
杨希娟1,2,3,党 斌1,2,3※,张 杰1,2,张文刚1,2,陈丹硕4
(1. 青海大学农林科学院,西宁 810016;2. 青海省青藏高原农产品加工重点实验室,西宁 810016;3. 青海大学省部共建三江源生态与高原农牧业国家重点实验室,西宁 810016;4. 青海省青稞资源综合利用工程技术研究中心,西宁 810016)
为了筛选对黑青稞麸皮结合酚类物质具有良好吸附、解吸性能的树脂,并建立其分离纯化工艺,评价其体外抗氧化活性,提高黑青稞麸皮的加工利用价值。本研究通过静态吸附和解吸试验比较了10种大孔树脂对黑青稞麸皮结合酚中总酚和总黄酮的分离纯化效果,筛选出AB-8为最佳吸附树脂类型,其静态吸附4 h可达到饱和;优化的吸附和解吸工艺参数为:黑青稞麸皮结合酚提取液pH值为3.0,上样质量浓度1.5 mg/mL,上样速度为1.5 mL/min,60%乙醇溶液作为洗脱剂进行动态洗脱,洗脱流速为1.5 mL/min;优化工艺条件下,经LC/MS检测,AB-8大孔树脂能显著提高71.43%以上不同种类单体酚的含量,且阿魏酸、丁香酸、苯甲酸、鞣花酸、杨梅素和芦丁是纯化后黑青稞麸皮结合酚中的主要酚类物质;体外抗氧化活性表明,黑青稞麸皮结合酚粗提物和纯化物均具有较强的体外抗氧化活性,纯化后的黑青稞麸皮结合酚溶液清除DPPH·、ABTS·+自由基及FRAP铁离子还原能力均显著增强。研究结果表明AB-8大孔树脂对黑青稞麸皮结合酚中总酚和总黄酮有较好的分离纯化效果,具有潜在的工业应用前景。
粮食;酚;树脂;黑青稞;结合酚;大孔树脂;分离纯化;抗氧化活性
0 引 言
青稞是是青藏高原最具特色的农作物,是藏区农牧民的主要口粮[1],其种植面积约占青藏高原地区粮食作物的60%以上,产量占该地区粮食总产量的58%~60%[2-3]。黑色青稞是一类珍贵的青稞种质资源[4-5]。在青藏高原区域,由于其含有丰富的营养及功能化学成分而受到人们的关注,被开发各种类型的食品。但是在其产品的加工利用过程中,大部分仅仅利用了黑青稞的面粉部分,造成了大量麸皮的产生和浪费。青稞麸皮中富含多种酚类化合物,如酚酸、黄酮、花青素等[6]。大量研究证明,谷物中的酚类化合物作为重要的膳食抗氧化组分,对预防人类机体氧化应激和心血管疾病具有突出的防护作用[7-8]。但是关于黑青稞中多酚的相关研究还非常有限。
可食植物中天然存在的大部分多酚都是以游离或结合(与多糖或蛋白通过酯键和醚键)的形式存在[9-10]。在谷物中主要以结合态存在形式为主,且80%以上存在于谷物的麸皮和胚乳中[11-12]。结合酚是黑青稞中的主要酚类物质存在形式[13],但是关于黑青稞结合酚的相关研究较少。当前大部分研究多关注的是青稞中游离酚的提取、纯化、含量及抗氧化活性测定[14-15],从而忽略了其结合酚的相关研究。虽然目前已有学者研究了青稞中结合酚的提取方法及酚类物质组成与含量[13,16],但是还未见关于黑青稞结合酚分离纯化方面的相关报道。现已证明植物多酚具有抗氧化、抗肿瘤等多种生理功能[17-19],但是由于溶剂提取法提取的青稞结合酚粗提液中杂质较多,会对其多酚含量及其活性评价造成干扰,因此有必要对其结合酚粗提液进行纯化,去除蛋白质和糖分等杂质,从而得到纯度更高的结合酚类物质,科学地评价黑青稞结合酚的生物活性。
大孔吸附树脂是一种性质稳定的高分子材料,具有良好选择性、吸附性和易于再生等优点,且不会受到酸碱和有机溶剂的影响,从而被广泛用于然产物中活性物质的分离纯化[20]。不同类型大孔树脂对总酚和总黄酮等酚类物质的分离效果比较已在短葶飞蓬[21]、鱼腥草[22]、沙枣[23]、金钱柳叶[24]、苦荞[25]、荔枝果肉[26]等植物中进行了相关报道。但是不同植物来源提取物由于所含酚类物质不同,因此适合其分离的树脂差异也很大。而关于黑青稞中结合酚分离纯化的研究还未见报道。我们前期试验结果证明了黑青稞麸皮中提取的游离酚得率为0.18%,而结合酚得率为2.40%。因此,对黑青稞结合酚进行分离纯化的研究有望提高黑青稞麸皮的加工利用率和附加值。因此本文研究以黑青稞麸皮粗提物为原料,通过比较 10 种不同类型大孔树脂对黑青稞麸皮结合酚中总酚和总黄酮的吸附和解吸效果,筛选对黑青稞麸皮结合酚类物质具有良好吸附、解吸性能的树脂,并优化分离工艺参数,建立其分离纯化工艺,评价其体外抗氧化活性,旨在为提高黑青稞麸皮的加工利用率和附加值提供理论科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验材料与试剂
黑青稞麸皮(结合酚含量质量分数279.66 mg/100 g,总酚质量分数为470.57 mg/100 g,以没食子酸质量表示;结合黄酮质量分数29.59 mg/100 g,总黄酮质量分数为53.57 mg/100 g,以芦丁质量表示;结合酚类物质的得率为2.40 %),黑青稞为青海省农林科学院作物育种栽培研究所青稞研究室培育的947品系。该材料于2016年3月至8月在青海省农林科学院试验田(西宁)种植。样品收获后脱粒,室温晾干,去除颗粒石子。用实验室小型磨粉机磨粉后进行麸皮和面粉的分离,收集麸皮为本试验所用。
大孔树脂:NKA-9、NKA-2、HPD-826、HPD-100、H1020、D101、X-5、AB-8型大孔树脂均购自北京索莱宝科技有限公司;DA201-C、S-8型大孔树脂购自郑州华溢科技新材料股份有限公司。不同型号树脂的物理性质如表1所示。
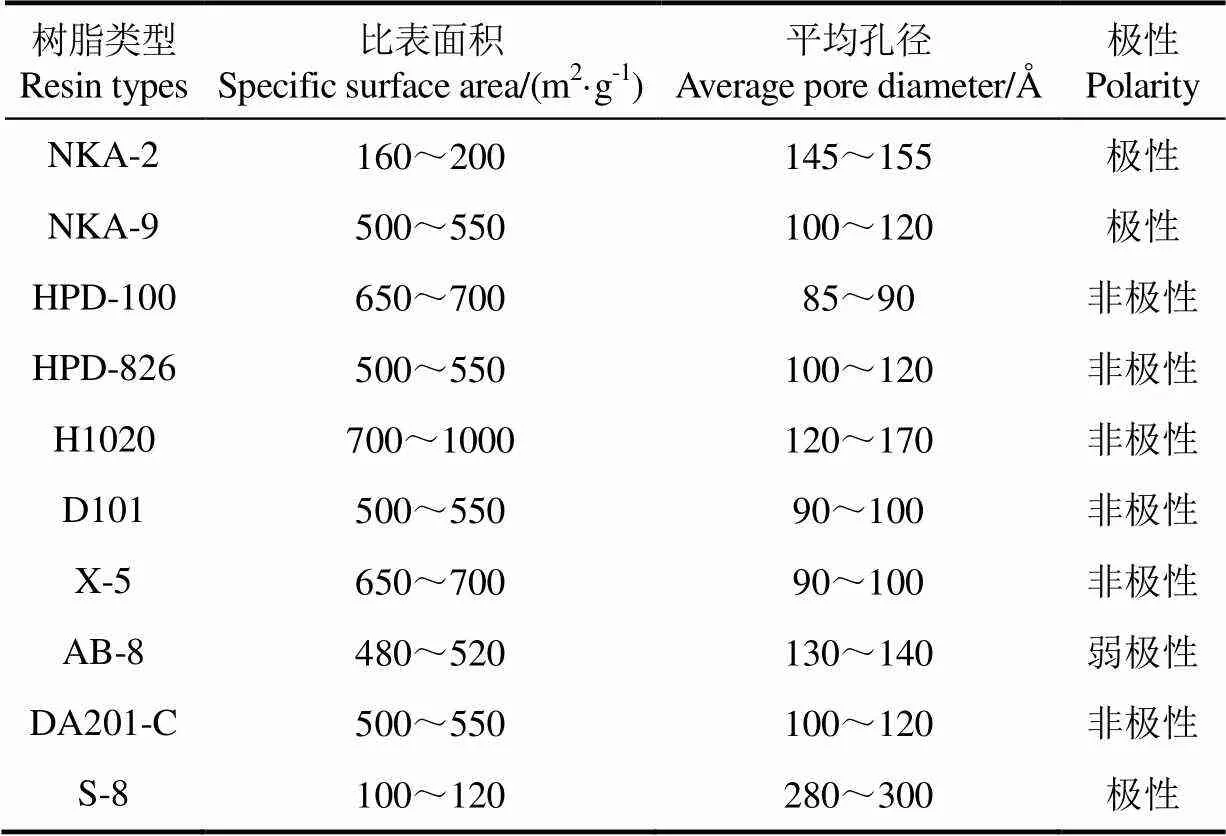
表1 10种大孔树脂的物理参数
试剂:DPPH(1,1-二苯基-2-三硝基苯肼)、TPTZ(三吡啶三吖嗪)、Trolox(水溶性维生素E)、ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐],Sigma公司;没食子酸、根皮酚、原儿茶酸、绿原酸、儿茶酸、2,4-二羟基苯甲酸、香草酸、丁香酸、4-香豆酸、芦丁、阿魏酸、水杨酸、咖啡酸、鞣花酸、原花青素A2、原花青素B2、柚皮苷、橙皮苷、苯甲酸、邻香豆酸、杨梅素、槲皮素、藜芦酸、柚皮素、山柰酚标准品(纯度≥98.0%),上海源叶生物科技有限公司;福林酚(优级纯),北京索莱宝科技有限公司;丙酮、乙醇、甲醇、氢氧化钠、乙酸乙酯、碳酸钠、亚硝酸钠、硝酸铝、盐酸均为市售分析纯。
1.1.2 试验仪器
CD1型法国雷诺肖邦磨粉机(法国肖邦科技公司);AL204万分之一分析天平(梅特勒-托利多仪器(上海)有限公司);KQ-500DE型数控超声波清洗器(昆山市超声波仪器有限公司);DKB-600B型电热恒温水浴锅(上海一恒科学仪器有限公司);Retavapor R-215旋转蒸发仪(瑞士布奇有限公司);N4S紫外可见分光光度计(上海仪电分析仪器有限公司);Christ ALPHA 1-4 LD plus冷冻干燥机(德国Christ有限公司); SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司); SHA-C 恒温振荡器(常州国华仪器有限公司);层析柱(规格直径1.6×20 cm)(上海沪西分析仪器厂有限公司);HL-2D定时数显恒流泵(上海沪西分析仪器厂有限公司);DBS-100电脑全自动部分收集器(上海沪西分析仪器厂有限公司)。Q-Exactive高效液相质谱联用仪(Thermo Fisher美国赛默飞世尔科技公司)
1.2 试验方法
1.2.1 青稞麸皮结合酚提取
参考文献方法[16],将提取青稞游离酚后的残渣采用酸法对其进行处理,乙酸乙酯萃取5次,合并乙酸乙酯萃取相,在45 ℃条件下真空浓缩至浸膏状,得青稞结合酚粗提液,于-20 ℃避光保存以备用。
1.2.2 总酚、总黄酮的测定
纯化过程中青稞结合酚总酚含量测定采用Folin- Ciocalteu法,以没食子酸为标准品,总酚含量以每100 g提取物(干基)中所含相当于没食子酸的质量表示[16];总黄酮含量的测定采用硝酸铝比色法,以芦丁为标准品,总黄酮含量以每100 g提取物(干基)中所含相当于芦丁的质量表示[27]。
1.2.3 大孔树脂纯化黑青稞麸皮结合酚的条件优化
1)树脂预处理
分别称取适量型号为 NKA-9、NKA-2、HPD-826、HPD-100、H1020、D101、DA201-C、S-8、X-5、AB-8的大孔树脂按照文献方法[28]进行预处理,以除去制备和贮存中残留的杂质。
2)最佳树脂类型的筛选
吸附率的计算:称取经预处理的湿树脂NKA-9、NKA-2、HPD-826、HPD-100、H1020、D101、DA201-C、S-8、X-5、AB-8各0.5 g,按照编号依次加入100 mL三角瓶中,加入一定浓度样品液50 mL于各三角瓶,置恒温水浴震荡器中,25℃,120 r/min恒温振荡24 h后抽滤,取滤液测定青稞总酚含量[26]。根据公式(1)计算树脂吸附率。
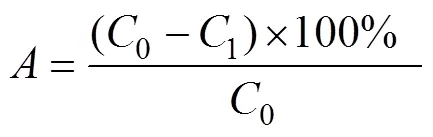
式中为吸附率,%;0吸附前溶液初始多酚浓度,mg/mL;1吸附后溶液剩余多酚质量浓度mg/mL。
解吸率计算:用蒸馏水清洗2次树脂,用滤纸吸干树脂表面水分,转入100 mL三角瓶中,加入95%的乙醇50 mL,于25℃下恒温振荡解吸12 h(120 r/min),取上清液测定总酚含量[29-30]。根据公式(1)计算树脂解吸率()。
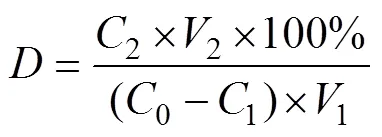
式中为解析率,%;2解析后溶液中总酚含量,mg/mL;1吸附溶液体积,mL;2解析溶液体积,mL。
3)青稞结合酚大孔树脂静态吸附解吸动力学曲线
参考文献方法[31]称取已筛选的湿树脂1 g,加入50 mL青稞结合酚粗提液于各三角瓶,在25 ℃,120 r/min下恒温振荡24 h,每隔1 h吸取上清液0.5 mL测定多酚质量浓度。分别以时间和吸附率为横纵坐标,绘制静态吸附曲线。
将吸附饱和树脂用蒸馏水清洗2 次,用滤纸吸干树脂表面水分,加入95%的乙醇50 mL于三角瓶中,于25 ℃,120 r/min下恒温振荡解吸12 h,每隔1 h吸取上清液0.5 mL测定多酚质量浓度。分别以时间和解吸率为横纵坐标,绘制静态解吸曲线。
4)pH值对青稞结合酚吸附效果的影响
分别称取5份0.5 g AB-8树脂,预处理后,分别装入5个50 mL的三角瓶中,取青稞结合酚粗提液10 mL于各瓶中,用0.01 mol/mL的NaOH溶液和HCl溶液调节青稞结合酚提取液的pH值至2、3、4、5、6、7,25 ℃下120 r/min恒温振荡12 h,测量青稞多酚的质量浓度,计算吸附率。
5)上样液质量浓度优化
分别称取4份0.5 g AB-8树脂,预处理后,分别装入4个50 mL的三角瓶中,分别加入质量浓度为0.05、0.10、0.15、0.25 mg/mL的青稞结合酚粗提液,25 ℃,120 r/min恒温振荡12 h,测定多酚质量浓度,计算树脂对多酚的吸附率。
6)洗脱剂种类优化
称取4份0.5 g AB-8树脂,经预处理,分别装入50 mL三角瓶中,分别加入青稞结合酚粗提液 10 mL于各瓶中,25 ℃,120 r/min恒温振荡12 h,测定其多酚质量浓度。用蒸馏水冲洗吸附饱和的树脂至表面无醇味溢出,用滤纸吸干表面水分,装入三角瓶中,分别加入体积分数70%的甲醇、乙醇、丙酮、乙酸乙酯各25 mL,25 ℃,120 r/min恒温振荡12 h,测定解析液中多酚质量浓度,计算解吸率。
7)洗脱剂体积分数优化
先利用AB-8树脂充分吸附青稞结合酚提取液,然后取出吸附饱和的树脂,用蒸馏水冲洗树脂至表面无醇味,用滤纸吸干树脂表面水分后转入瓶中,分别加入体积分数30%、40%、50%、60%、70%、80%、90%的乙醇溶液25 mL,25 ℃,120 r/min恒温振荡12 h,测量解析液中多酚质量浓度,计算解吸率。
8)上样速度优化
称取15 g AB-8树脂,预处理后,湿法装柱(柱长200 mm,内径16 mm)。经蒸馏水平衡后分别用0.5、1.0、1.5、2.0、2.5 mL/min流速上柱吸附,收集流出液,测定多酚质量浓度,计算其吸附率。
9)洗脱剂洗脱流速对青稞结合酚解吸率的影响
将15 g AB-8树脂预处理后,加入一定体积的青稞结合酚溶液,充分震荡吸附12 h后湿法装柱(柱长200 mm,内径16 mm),先用约2倍柱体积(bed volume)的蒸馏水冲洗树脂,去除吸附在树脂表面的溶液,再用60%乙醇溶液分别以0.5、1.0、1.5、2.0 mL/min流速洗脱,收集不同流速下的洗脱液,测其多酚质量浓度并计算其解吸率。
1.2.4 纯化后青稞结合酚提取液单体酚组成及含量high performance liquid chromatography/mass spectrum (HPLC/MS)分析
1)色谱条件
将纯化后的游离酚配制成浓度为1 mg/mL的溶液,用0.45m滤膜过滤,LC-MS检测分析。色谱条件为:Dionex Ultimate 3000 RSLC 色谱系统;Hypersil GOLD Aq,100 mm×2.1 mm,1.9m色谱柱;流动相A:0.9%乙酸水溶液,流动相B:甲醇溶液;梯度洗脱条件(0 min,流动相A 98%/流动相B 2%;2 min,流动相A 95%/流动相B 5%;5 min,流动相A 80 % /流动相B 20%;8 min,流动相A 20%/流动相B 80%; 9~10 min,流动相B 100%;11~12 min,流动相A 98%/流动相B 2%);流速0.3L/min;进样量3L。
2)质谱分析条件
选用Thermo Q-Exactive 质谱系统,负离子测定模式,喷雾电压设定为2.8 kV,护套气体流量:22 arbitrary units,辅助气体流量:2 arbitrary units,毛细管温度:300 ℃,加热器温度:300 ℃,扫描模式:全扫描(分辨率70 000),扫描范围100~1 500 m/z。
1.2.5 青稞纯化后结合酚体外抗氧化试验
DPPH·自由基清除能力、FRAP 抗氧化能力及ABTS·+ 自由基清除能力均参考Yang等[27]的方法。DPPH清除能力以Trolox为标准物,517 nm处测吸光值,绘制标准曲线并进行回归处理,得回归标准曲线方程为=-0.004 2+0.916 3(0~140mol/L,²=0.992 8)。样品的DPPH·清除能力以每100 g提取物(干基)中所含 相当于水溶性维生素E当量(mol / 100 g )表示,下同。
FRAP抗氧化能力以Trolox作为标准品,在波长593 nm下测定吸光度,绘制标准曲线,得回归方程:=0.007 2-0.001 2(0~300mol/L,²=0.999 2)。样品的 FRAP抗氧化能力以以每100 g提取物(干基)中所含相当于水溶性维生素E当量(mol /100 g )表示。
ABTS·+清除能力以Trolox为标准物,734处测吸光值,绘制标准曲线并进行回归处理,得回归标准曲线方程为=-0.001+0.624 2(0~300mol/L,²=0.990 7)。样品的ABTS·+清除能力以每100 g提取物(干基)中所含相当于水溶性维生素E当量(mol /100 g)表示。
1.3 数据分析
所有结果以平均值±标准差(±SD)表示,作3次重复。方差分析(ANOVA)和显著性检验用SPSS21.0软件进行SNK-q处理。平均值间的统计显著性为0.05。
2 结果与分析
2.1 黑青稞麸皮结合酚大孔吸附树脂的筛选
大孔树脂的吸附与解吸特性不仅与其自身三维结构(如比表面积、孔径和孔容积等)密切相关,还与被吸附物质的极性和分子大小有关[32]。从表2看出,DA201-C 与H1020树脂对黑青稞麸皮总酚的静态吸附率在参试的10种大孔树脂中最高,分别为87.07%和86.98%,且两者无显著差异,其次为AB-8和S-8类型树脂;黑青稞麸皮总酚解析率最高的树脂型号为AB-8(93.72%),其显著高于其他参试树脂类型,其次为X-5和NKA-2。10种大孔树脂对黑青稞麸皮总黄酮的静态吸附试验中,NKA-9的吸附率最高(86.00%),其次为AB-8(74.01%)和NKA-2(73.71%);总黄酮的解析率试验中,X-5(96.60%)和HPD100(93.50%)的解析率最高,且两者之间无显著差异,其次为S-8(87.22%)和AB-8(75.67%)。此研究结果说明大孔树脂对黑青稞麸皮结合酚类物质的吸附存在一定的选择性,这与红小豆[28]及玫瑰果[30]多酚的研究结果一致。因此综合考虑大孔树脂对黑青稞麸皮结合酚提取物中总酚和总黄酮的吸附率和解吸率结果,发现AB-8树脂对黑青稞麸皮中总酚及总黄酮均具有较高的吸附能力,且对总酚的解析率最高,对总黄酮的解析率较高,因此本试验选用对黑青稞麸皮结合型总酚及总黄酮吸附和解吸性能均较好的大孔树脂AB-8进行吸附动力学研究。
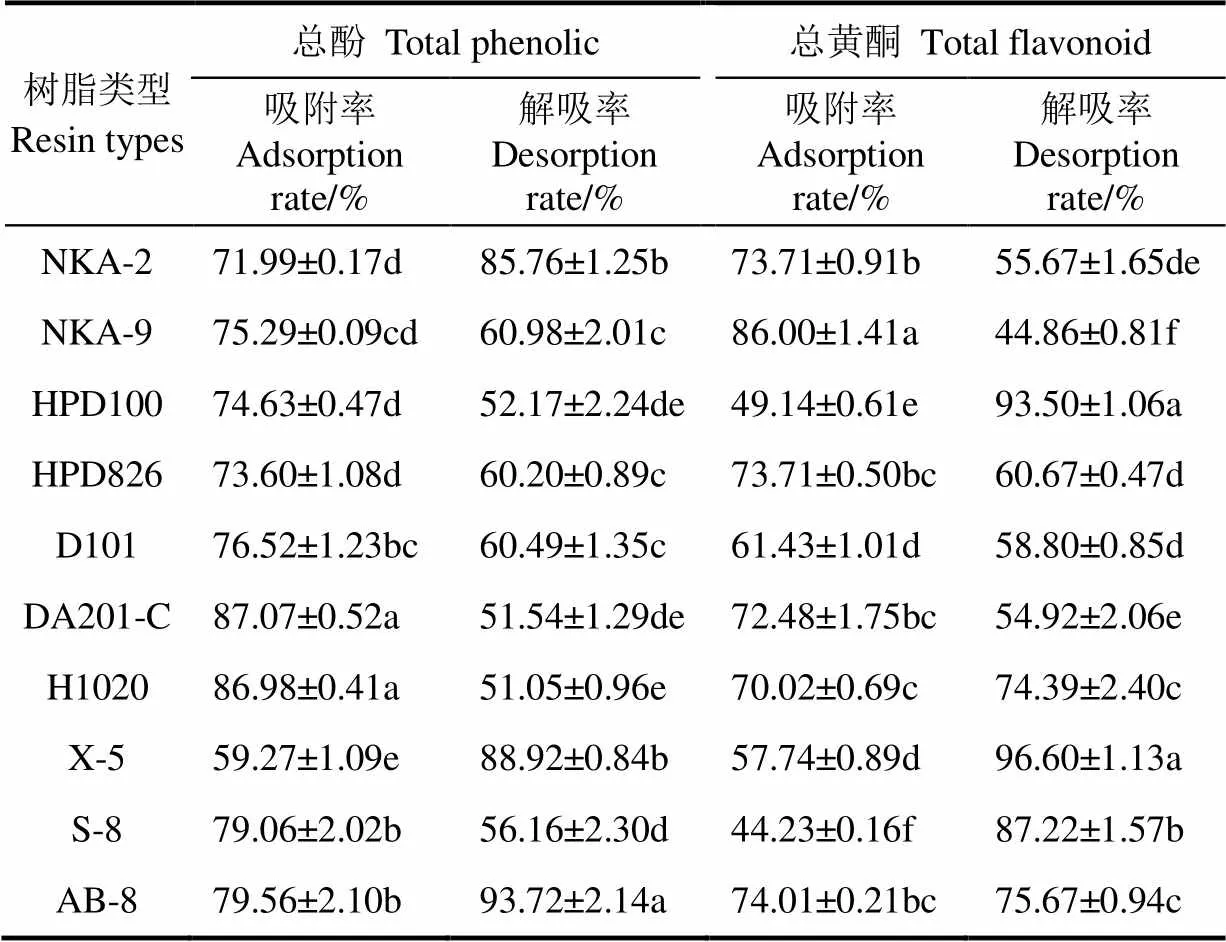
表2 不同极性大孔树脂对黑青稞麸皮结合酚提取物总酚和总黄酮静态吸附率与解吸率比较
注:结果以平均值±标准差(=3)来表示。采用 Duncan 分析,以不同小写字母表示差异显著(<0.05)。
Note:Results are mean±SD (=3). Numbers followed by different letters are significantly different at the level of<0.05 according to Duncan test.
2.2 AB-8大孔树脂的静态吸附、解析分析
从图1可以看出,AB-8树脂对于黑青稞麸皮结合酚提取物中总酚和总黄酮的吸附率均随着时间的延长呈现先增加后逐渐趋于稳定的趋势,4 h后,AB-8树脂对总酚(61.79%)和总黄酮(58.50%)的吸附率基本达到饱和,所以AB-8树脂的静态吸附时间为4 h。5 h时,AB-8树脂对黑青稞麸皮结合酚提取物中总酚和总黄酮的解吸率均达到饱和,其后随着解吸时间的延长,解吸率呈现稳定的趋势。因此AB-8树脂静态解吸时间为5 h。
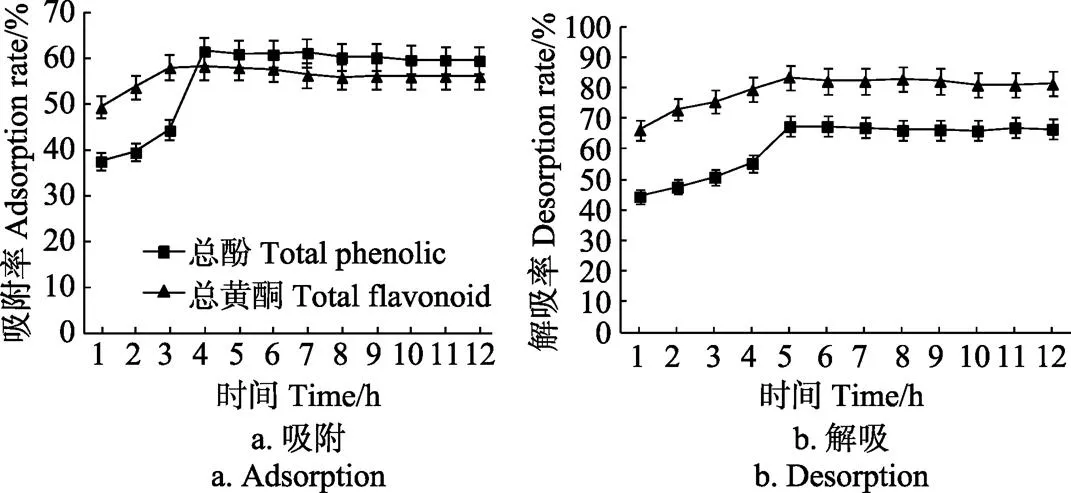
图1 AB-8大孔树脂静态吸附与解吸曲线
2.3 AB-8树脂纯化黑青稞麸皮结合酚的条件优化
2.3.1 pH值对树脂吸附效果的影响
pH值对AB-8树脂吸附黑青稞麸皮青稞结合酚的影响见图2。如图2所示,随着pH值的增加,总酚及总黄酮吸附率均呈现先增加后降低的趋势,在pH值为3时吸附率最高,总酚和总黄酮的吸附率分别达到78.61%和69.32%。所以选择3作为树脂最适的pH值。
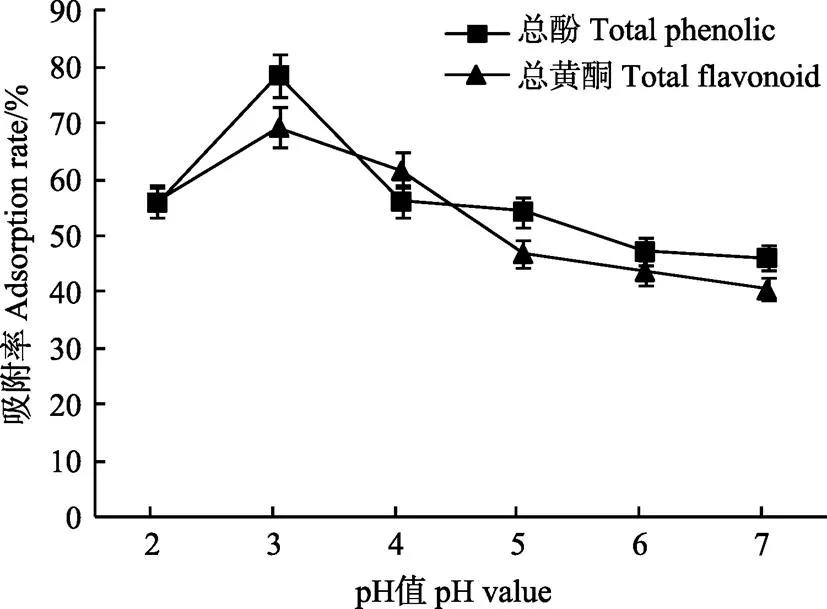
图2 pH值对AB-8树脂吸附效果的影响
2.3.2 上样液质量浓度对树脂吸附效果的影响
上样液质量浓度对AB-8树脂吸附效果的影响如图3所示。随着上样液质量浓度的增加而呈现先增加后稳定的趋势,在质量浓度达到1.5 mg/mL时,AB-8树脂对黑青稞麸皮结合酚中总酚(72.37%)及总黄酮(68.65%)的吸附率达到最大,超过1.5 mg/mL时,树脂的吸附率趋于稳定,所以选择1.5 mg/mL为最适的质量浓度。
2.3.3 洗脱剂种类对树脂静态解吸率的影响
如图4所示,不同种类洗脱溶剂显著影响AB-8树脂对黑青稞麸皮结合酚中总酚及总黄酮的解吸率(<0.05)。甲醇对黑青稞麸皮结合酚提取液中总酚的解吸率最高,其次为乙醇,但是乙醇对总黄酮的解析率最高,其次为甲醇。由于青稞结合酚中多酚与黄酮的极性不同,因此不同洗脱溶剂对其的解吸效果有差异。综合考虑到乙醇的安全性,故最终选择乙醇作为适宜的洗脱剂。
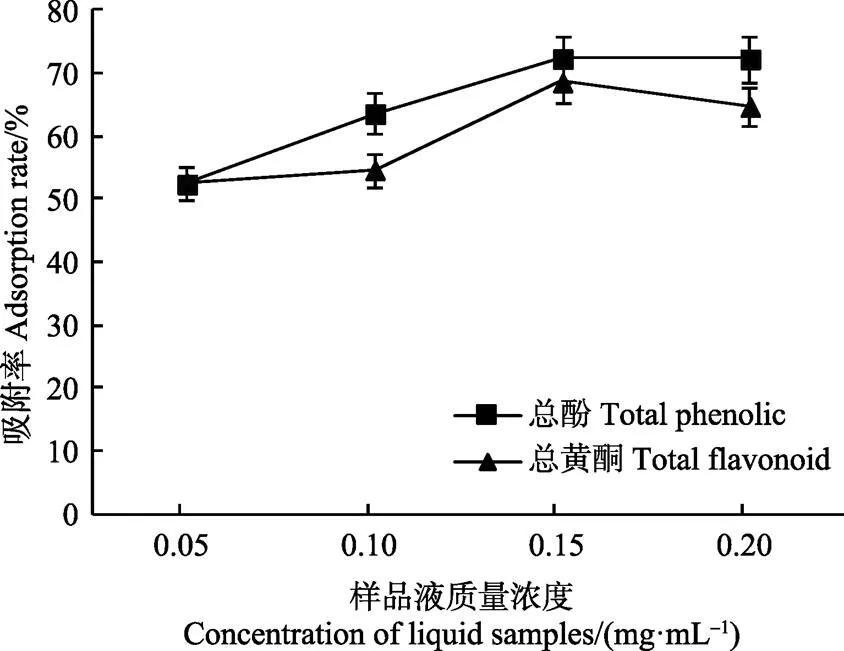
图3 上样液质量浓度对AB-8树脂吸附效果的影响
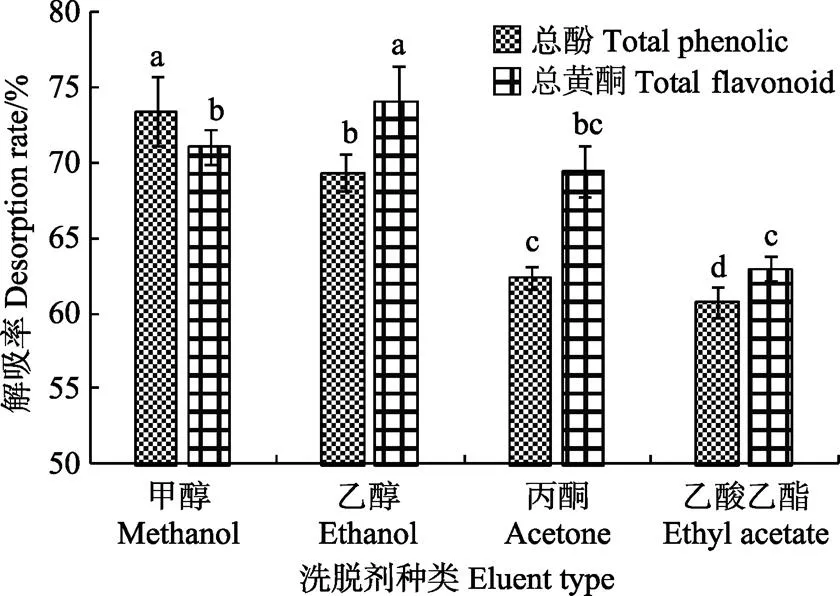
图4 洗脱剂种类对AB-8树脂静态解吸率的影响
2.3.4 洗脱剂体积分数对树脂静态解吸率的影响
如图5所示,当乙醇体积分数小于60%时,AB-8树脂的解吸率随着乙醇体积分数的增加而逐渐增大。当乙醇体积分数达到60%时,树脂对黑青稞麸皮中总酚和总黄酮的解吸率均达到最高,分别为76.99%和89.82%;之后随着乙醇体积分数的增加,其解吸率反而下降。多酚通过与树脂间形成氢键从而被吸附,乙醇体积分数增大,有利于对氢键的破坏,使更多的多酚类物质被洗脱下来[31]。但是醇体积分数的增加会减少其中的水分含量,从而导致一些水溶性多酚类物质不能被溶解[31],从而降低了树脂的解吸率。因此60%的乙醇溶液为黑青稞麸皮多酚类物质的最佳解吸剂。
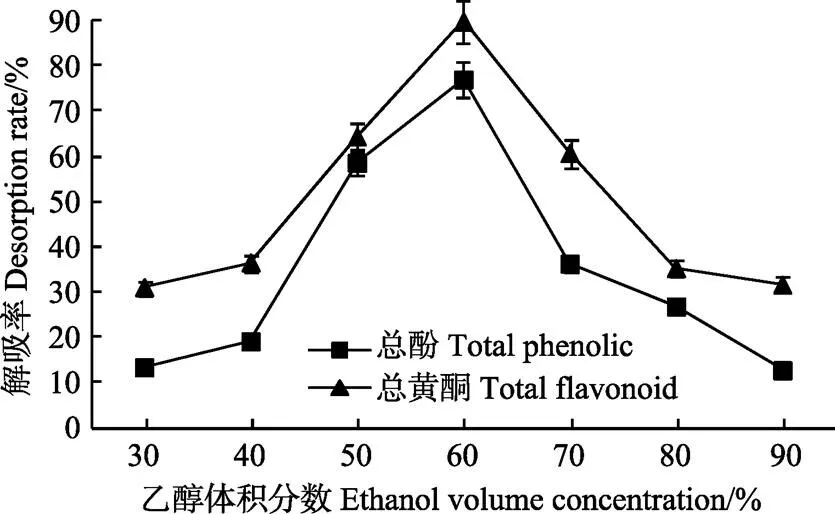
图5 洗脱剂体积分数对AB-8树脂静态解吸率的影响
2.3.5 上样速度对树脂吸附率的影响
动态吸附时,样品的上样速度影响大孔树脂对青稞麸皮结合酚中总酚和总黄酮的吸附效果。如图6所示,上样速度小于1.5 mL/min时,酚类物质分子与大孔树脂可以充分接触,树脂对黑青稞麸皮结合酚的总酚吸附率较高。上样速度较大时,酚类分子还未来得及充分与树脂接触吸附,就已经通过了树脂,从而降低了树脂的吸附率[28];当上样速度小于1.0 mL/min时,树脂对黑青稞麸皮结合酚的总黄酮吸附率达到最高(83.75%),其后随着上样速度的增加,树脂的吸附率下降。考虑到上样速度过慢会延长工作时间,从而增加成本,且树脂对总黄酮的吸附率在上样速度为1.0(83.75%)和1.5 mL/min(79.15%)时差异不显著(>0.05),因此本试验选择黑青稞麸皮结合酚提取液的上样速度为1.5 mL/min。
2.3.6 洗脱剂洗脱流速对树脂动态解吸率的影响
用不同流速的60%乙醇溶液洗脱被树脂吸附的黑青稞麸皮结合酚中总酚和总黄酮的结果如图7所示,当洗脱流速为1.5 mL/min时,树脂对总酚(80.94%)和总黄酮(89.84%)的解吸率均达到最高;当洗脱流速超过1.5 mL/min时,随着洗脱剂流速的增加,树脂的解吸率出现下降。这主要是因为洗脱流速较慢时,解吸液与树脂接触充分,能够更好地破坏氢键,使多酚类物质被解吸出来。相反,由于洗脱流速的加快使得洗脱液与树脂接触的时间缩短,从而一部分多酚类物质来不能被及时解吸出来,降低了树脂的解吸率[31]。因此本试验选择1.5 mL/min做为洗脱流速。
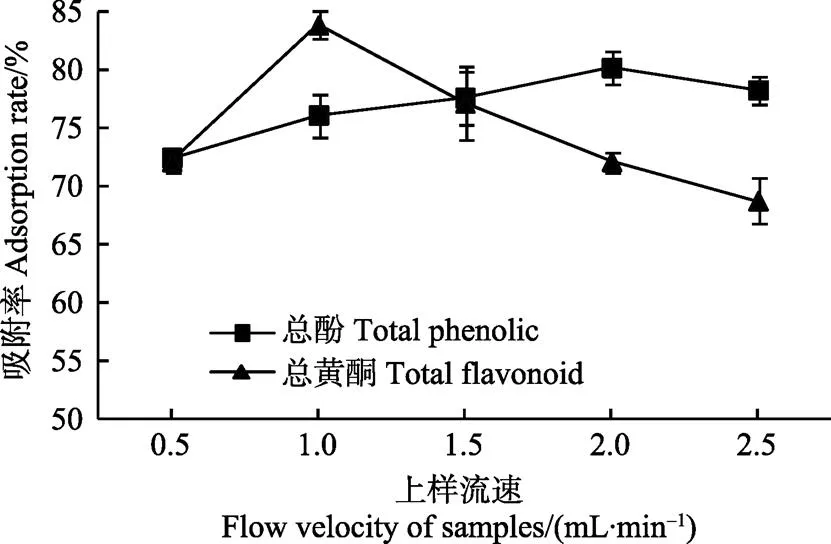
图6 上样速度对AB-8树脂动态吸附效果的影响
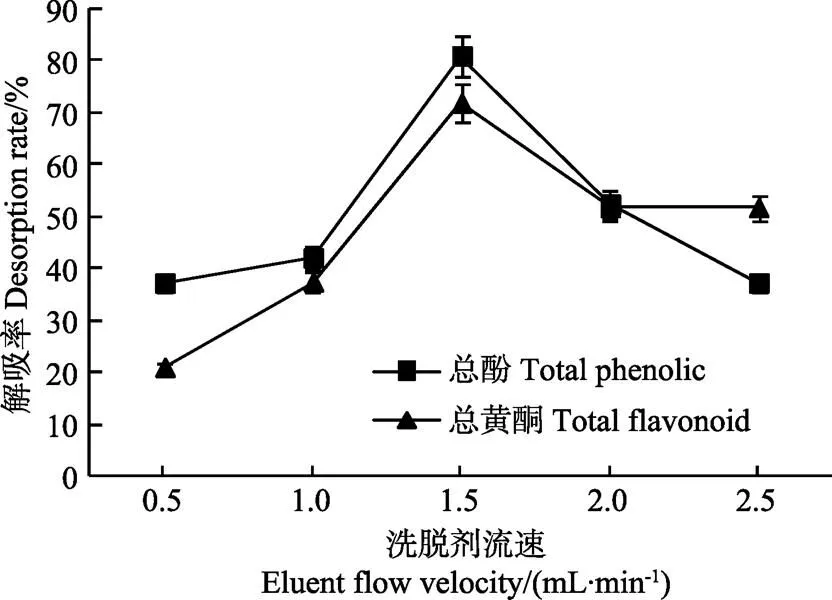
图7 60%乙醇洗脱流速对AB-8树脂动态吸附效果的影响
2.4 黑青稞麸皮结合酚单体组成分析
本研究黑青稞麸皮结合酚中共检测了21种单体酚类物质,单体酚种类及纯化前后的质量分数见表3。AB-8大孔树脂能很好地分离纯化黑青稞麸皮结合酚提取物中酚类物质,纯化前检测到18种单体酚化合物,纯化后检测到20种单体酚化合物。其中没食子酸、原儿茶酸、2,4-二羟基苯甲酸只在纯化后的黑青稞麸皮结合酚提取物中检测到,水杨酸和山奈酚经过树脂纯化后未检测到。不同的单体酚种类由于其极性及结构的不同,其用于酚类物质分离纯化最适的大孔树脂种类和极性差异也较大。因此要选择适宜于多种单体酚分离的大孔树脂种类也较难。现已有文献报道了云南黑青稞多酚的纯化工艺[33],确定了HPD-826树脂为青稞多酚纯化最适大孔树脂,该研究中黑青稞多酚是采用溶剂提取的游离型多酚,与本研究中筛选的AB-8树脂作为黑青稞结合酚纯化的最佳树脂的结果不同。说明黑青稞中游离酚与结合酚的组成及含量的差异导致了其筛选的适宜树脂类型有本质的区别,对比前人研究结果,黑青稞中游离酚适合非极性树脂纯化,而结合酚适合弱极性树脂纯化。
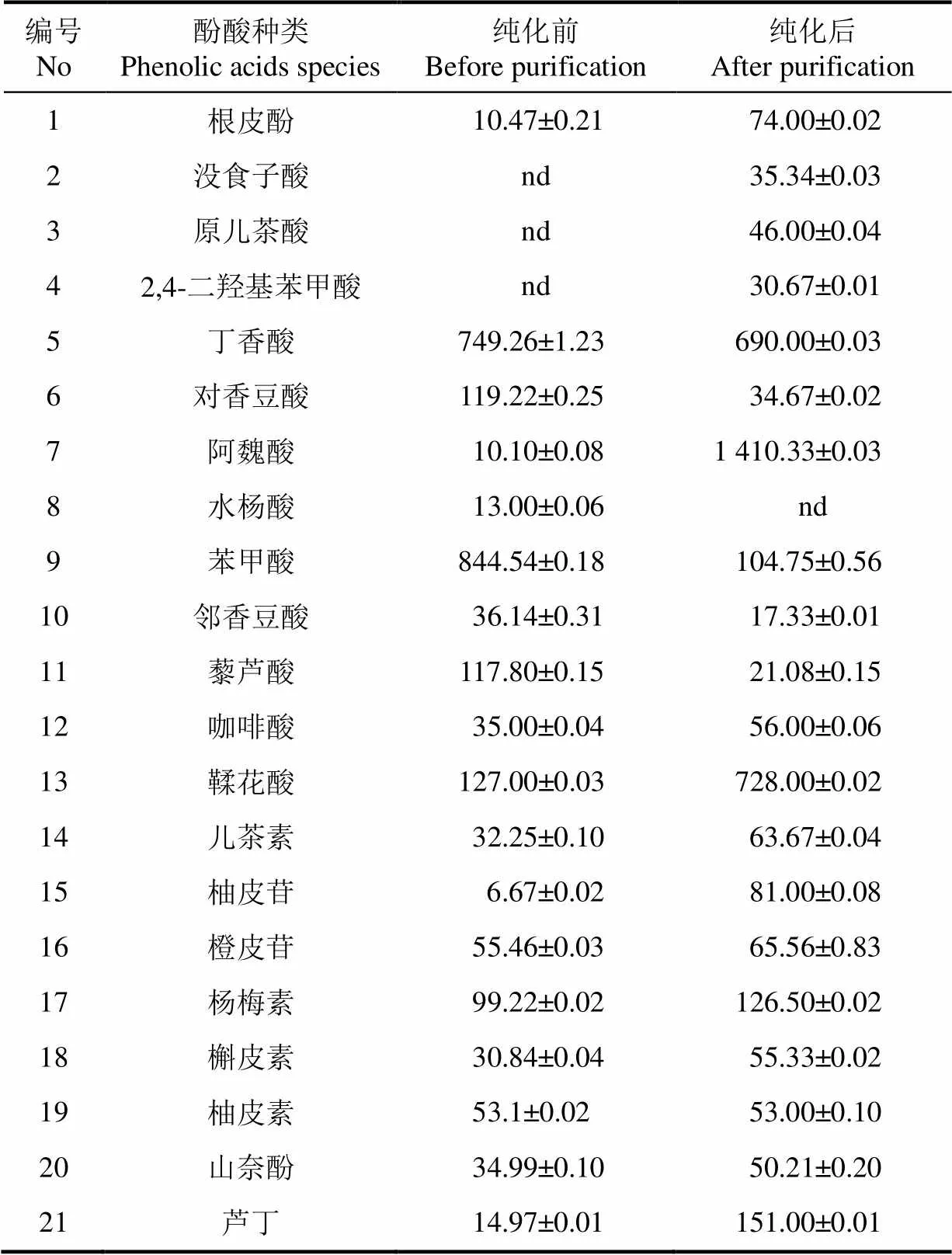
表3 AB-8大孔树脂纯化前后黑青稞麸皮结合酚提取液中单体酚种类及质量分数
注:nd 表示未检出。
Note:nd, not detected.
本试验中选择的AB-8树脂纯化黑青稞麸皮结合酚,其中丁香酸、对香豆酸、苯甲酸、邻香豆酸、藜芦酸在纯化后含量显著降低(<0.05),其余单体酚酸含量均显著增加,尤其是检测的8种单体黄酮的含量均显著高于纯化前的含量(<0.05)。其中阿魏酸的含量提高了141倍以上,成为黑青稞麸皮结合酚的主要酚酸,这与Zielinski[34]报道的阿魏酸是大麦中主要酚酸的结果一致。说明AB-8大孔树脂对黑青稞麸皮中的结合酚有较好的的分离纯化效果,能保留和提高黑青稞麸皮结合酚中71.43%以上不同种类单体酚的含量。
此外,本试验发现纯化后黑青稞麸皮结合酚中阿魏酸、丁香酸、苯甲酸、鞣花酸、杨梅素和芦丁六者合计占总酚的82.44%(3210.25/3893.81),因此这6种物质是纯化后黑青稞麸皮结合酚中的主要酚类物质。这与Yang等[27]报道的没食子酸、丁香酸、4-香豆酸、苯甲酸、藜芦酸、柚皮素、橙皮苷、槲皮素、芦丁是蓝粒青稞结合酚主要酚类物质的结果不同,说明不同颜色的青稞中其多酚组成及含量有差异,且首次在黑青稞结合酚中发现含有丰富的鞣花酸。但是本研究只是初步通过有限的标准品鉴定出黑青稞麸皮结合酚的酚类物质组成及含量,由于青稞麸皮结合酚提取物中酚类物质种类较多且成分复杂因此其酚类化合物的鉴定还需要进一步纯化制备出单体组分,通过核磁等手段确证。本研究的结果可为下一步的纯化和鉴定提供分离条件的选择和结构解析的参考。
2.5 抗氧化活性测定
以往研究多是关注青稞粗提液的抗氧化活性,因其所含杂质较多而影响了对其抗氧化活性的评价。而本研究测定了纯化后的黑青稞麸皮结合酚提取物的抗氧化能力,对于评价黑青稞麸皮结合酚的抗氧化能力更具有科学性。由表4可以看出,黑青稞麸皮结合酚粗提物具有较强的抗氧化活性,其抗氧化活性高于Yang等[27]报道的蓝粒青稞结合酚的抗氧化活性。经AB-8大孔树脂分离纯化后,黑青稞麸皮结合酚溶液的DPPH·、ABTS·+自由基清除能力及FRAP铁离子还原能力均显著提高,分别为纯化前的2.03、19.49及2.25倍。表明AB-8大孔树脂较适用于黑青稞麸皮结合酚提取物中多酚类物质的分离纯化。因此本研究结果可为黑青稞麸皮中结合酚的进一步利用提供理论依据。
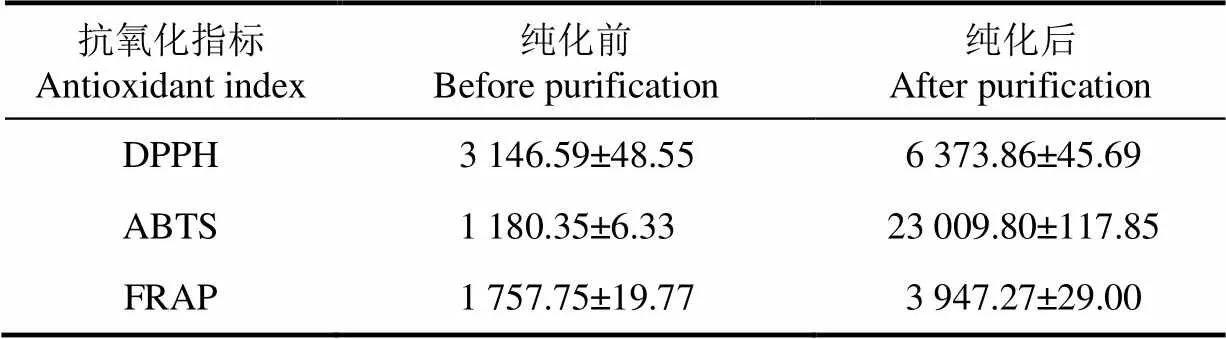
表4 AB-8大孔树脂纯化前后黑青稞麸皮结合酚提取液抗氧化活性比较
3 结 论
1)通过静态吸附和解吸试验比较了NKA-9、NKA-2、HPD-826、HPD-100、H1020、D101、X-5、AB-8等10种大孔树脂对黑青稞麸皮结合酚中总酚和总黄酮的分离纯化效果,从中筛选出AB-8为最佳吸附树脂类型。该树脂对黑青稞麸皮结合酚提取物具有良好的吸附和解吸性能。
2)通过静态和动态吸附及解析级试验得到AB-8大孔树脂对黑青稞麸皮结合酚中总酚和总黄酮的最佳吸附和解析工艺条件为:黑青稞麸皮结合酚提取液调整pH值为3,上样质量浓度1.5 mg/mL,上样速度为1.5 mL/min,60%乙醇溶液作为洗脱剂进行动态洗脱,洗脱流速为1.5 mL/min。
3)经LC/MS分析,AB-8大孔树脂在最优工艺条件下分离纯化的黑青稞麸皮结合酚中能检测到更多的单体酚种类,且能显著提高其中71.43%以上不同种类单体酚的含量。阿魏酸、丁香酸、苯甲酸、鞣花酸、杨梅素和芦丁是纯化后黑青稞麸皮结合酚中的主要酚类物质。
4)黑青稞麸皮结合酚粗提物和纯化物均具有较强的体外抗氧化活性,经AB-8大孔树脂分离纯化后,黑青稞麸皮结合酚溶液的DPPH·、ABTS·+自由基清除能力及FRAP铁离子还原能力均显著增强。AB-8大孔树脂分离黑青稞麸皮结合酚类物质是可行的,且具有潜在的工业应用前景。
[1] Liu Z F, Yao Z J, Yu C Q, et al. Assessing crop water demand and deficit for the growth of spring highland barley in Tibet China[J]. Journal of Integrative Agriculture, 2013, 12(3): 541-551.
[2] 刘新红. 青稞品质特性评价及加工适宜性研究[D]. 西宁:青海大学,2014. Liu Xinhong. Study on Quality Evaluation and Processing Suitability of Hulless Barley[D]. Xining: Qinghai University, 2014. (in Chinese with English abstract)
[3] 龚凌霄. 青稞全谷物及其防治代谢综合征的作用研究[D].杭州:浙江大学,2013. Gong Lingxiao. Studies on Whole Grain of Tibetan Hulless Barley and Its Effect on Metabolic Syndrome[D]. Hangzhou: Zhejiang University, 2013. (in Chinese with English abstract)
[4] Bothmer R V, Sato K, Komatsuda T, et al. Diversity in Barley (): The Domestication of Culticated Barley[M]. Amsterdam, Netherlands: Elsevier Science, 2003.
[5] Sparks G A, Malcolm J P. Barley identification by grain characters in New Zealand[J]. New Zealand Journal of Crop and Horticulture Science, 1978, 6: 1-10.
[6] Gong L X, Jin C, Wu L J, et al. Tibetan hullless barley (L.) as a potential source of antioxidants[J]. Cereal Chemistry, 2012, 89(6): 290-295.
[7] Liu R H. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46(3): 207-219.
[8] Okarter N, Liu R H. Health benefits of whole grain phytochemicals[J]. Critical Reviews in Food Science and Nutrition, 2010, 50(3): 193-208.
[9] Sun J, Chu Y F, Wu X Z, Liu R H. Antioxidant and antiproliferative activities of common Fruits[J]. J Agric Food Chem, 2002, 50: 7449-7454
[10] Klepacka J, Gujska E, Michalak J. Phenolic compounds as cultivar and variety distinguishing factors in some plant products[J]. Plant Foods Hum Nutr, 2011, 66: 64-69.
[11] 李富华,郭晓晖,夏春燕,等. 全谷物酚类化合物抗氧化活性研究进展[J]. 食品科学,2012,33(13):299-304. Li Fuhua, Guo Xiaohui, Xia Chunyan, et al. Research advance in antioxidant activity of phenolic compounds in whole grains[J]. Food Science, 2012, 33(13): 299-304. (in Chinese with English abstract)
[12] Perez-jimenez J, Torres J L. Analysis of non-extractable phenolic compounds in foods: The current state of the art[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 12713-12724.
[13] 杨希娟,党斌,徐菲,等. 不同粒色青稞酚类化合物含量与抗氧化活性的差异及评价[J]. 中国粮油学报,2017,32(9):34-41. Yang Xijuan, Dang Bin, Xu Fei, et al. Difference and evaluation of phenolics contents and antioxidant activity of colored hulless barley[J]. Journal of the Chinese Cereals and Oils Association, 2017, 32(9):34-41. (in Chinese with English abstract)
[14] Zhao H F, Dong J J, Lu J, et al. Effects of extraction solvent mixtures on antioxidant activity evaluation and their extraction capacity and selectivity for free phenolic compounds in barley (L.)[J]. Journal of Agricultural and Food Chemistry, 2006, 54, 7277-7286.
[15] 刘清,李玉,姚惠源. 大麦提取物的体外抗氧化活性研究.食品工业科技,2007,28(2):131-136. Liu Qing, Li Yu, Yao Huiyuan. Study on antioxidant activity in vitro of barley extract[J]. Science and Technology of Food Industry, 2007, 28(2): 131-136. (in Chinese with English abstract)
[16] 徐菲,杨希娟,党斌,等. 酸法提取青稞麸皮结合酚工艺优化[J]. 农业工程学报,2016,32(17):301-308. Xu Fei, Yang Xijuan, Dang Bin, et al. Optimization of combined phenols extraction with sulfuric acid from hulless barley bran[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(17): 301-308. (in Chinese with English abstract)
[17] Pulido R, Bravo L, Saura C F. Antioxidant activity of dietary polyphenols as determined by a modified ferric reducing/ antioxidant power assay[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3396-3402.
[18] Balasundram N, Sundram K, Samman S. Phenolic compounds in plants and agri-industrial by-products: Antioxidant activity, occurrence, and potential uses[J]. Food Chemistry, 2006, 99(1): 191-203.
[19] Uddin R, Saha M R, Subhan N, et al. HPLC-analysis of polyphenolic compounds in Gardenia jasminoides and determination of antioxidant activity by using free radical scavenging assays[J]. Advanced Pharmaceutical Bulletin, 2014, 4(3): 273-281.
[20] Ignat I, Volf I, Popa V I. A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables[J]. Food Chemistry, 2011, 126(4): 1821-1835.
[21] Gao M, Huang W, Liu C Z. Separation of scutellarin from crude extracts of Erigeron breviscapus (vant.) Hand. Mazz. by macroporous resins[J]. Journal of Chromatography B, 2007, 858: 22-26.
[22] Zhang Y, Li S F, Wu X W, et al. Macroporous resin adsorption for purification of flavonoids in Houttuynia cordata Thunb[J]. Chinese Journal of Chemical Engineering, 2007, 15(6): 872-876.
[23] 王雅,樊明涛,赵萍,等. 大孔树脂对沙枣多酚的动态吸附解析性能研究. 西北农林科技大学学报:自然科学版,2010,38(12):215-220. Wang Y, Fan M T, Zhao P, et al. Dynamic absorption and desorption of polyphenols fromL. by macroporous absorbent resins[J]. Journal of Northwest A & F University: Natural Science Edition, 2010, 38(12): 215-220. (in Chinese with English abstract)
[24] 吴彩娥,方升佐,冯宗帅,等. 青钱柳叶总黄酮大孔树脂纯化工艺. 农业机械学报,2009,40(6):133-137. Wu Caie, Fang Shengzuo, Feng Zhongshuai, et al. Purification process of total flavonoids inleaves with macroporous resins[J]. Transactions of the Chinese Society for Agricultural Machinery, 2009, 40(6): 133-137. (in Chinese with English abstract)
[25] 于智峰,王敏,张家峰. 大孔树脂精制苦荞总黄酮工艺条件的优化研究[J]. 农业工程学报,2007,23(4):253-257. Yu Zhifeng, Wang Min, Zhang Jiafeng. Optimization of purifying technology of tartary buckwheat total flavonoids with macroporous resin[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2007, 23(4): 253-257. (in Chinese with English abstract)
[26] 苏东晓,张瑞芬,张名位,等. 荔枝果肉酚类物质大孔树脂分离纯化工艺优化[J]. 中国农业科学,2014,47(14):2897-2906. Su Dongxiao, Zhang Ruifen, Zhang Mingwei, et al. Separation and purification of polyphenol in litchi pulp by macroporous resin[J]. Scientia Agricultura Sinica, 2014, 47(14): 2897-2906. (in Chinese with English abstract)
[27] Yang X J, Dang B, Fan M T. Free and bound phenolic compound content and antioxidant activity of different cultivated blue highland barley varieties from the Qinghai- Tibet Plateau[J]. Molecules, 2018, 23, 879-899.
[28] 陶莎,黄英,康玉凡,等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报,2013,29(23): 276-285. Tao Sha, Huang Ying, Kang Yufan, et al. Technology of separation and purification and its efficiency of adzuki bean polyphenols with macroporous adsorption resins[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(23): 276-285. (in Chinese with English abstract)
[29] 刘清,李虎虎,姚惠源,等. 大孔吸附树脂分离富集大麦多酚的研究[J]. 食品科学,2007,28(11):98-102. Liu Qing, Li Huhu, Yao Huiyuan. Study on isolation and enrichment of barley polyphenols by macroporous resin[J]. Food Science, 2007, 28(11): 98-102. (in Chinese with English abstract)
[30] 甘芝霖,倪元颖,郭悦,等. 大孔树脂分离纯化玫瑰果多酚及其抗氧化性[J]. 农业工程学报,2015,31(24):298-306. Gan Zhilin, Ni Yuanying, Guo Yue, et al. Separation and purification of rosehip polyphenols by macroporous resin and its antioxidant activity[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(24): 298-306. (in Chinese with English abstract)
[31] 朱洁,王红宝,孔佳君,等. 梨幼果多酚的纯化及其抗氧化性[J]. 食品科学,2017,38 (5):14-20. Zhu Jie, Wang Hongbao, Kong Jiajun, et al. Purification and antioxidant activity of polyphenols from young pear fruits[J]. Food Science, 2017, 38(5): 14-20. (in Chinese with English abstract)
[32] 汪洪武,刘艳清. 大孔吸附树脂的应用研究进展[J]. 中药材,2005(4):353-356. Wang Hongwu, Liu Yanqing. Progress in the application of macroporous adsorption resin[J]. Journal of Chinese Medicinal Materials, 2005(4):353-356. (in Chinese with English abstract)
[33] 张一鸣,吴跃中,杨士花,等. 云南黑青稞多酚的提取及纯化工艺研究[J]. 食品科技,2018,43(5):206-213. Zhang Yiming, Wu Yuezhong, Yang Shihua, et al. Optimization of extraction and purification of polyphenols from Yunnan black hulless barley[J]. Food Science and Technology, 2018, 43(5): 206-213. (in Chinese with English abstract)
[34] Zielinski H. Low molecular weight antioxidants in the cereal grain: A review[J]. Pol J Food Nutr Sci, 2002, 11:3-9.
Process optimization on separation and purification of bound polyphenol in black highland barley bran by macroporous resin
Yang Xijuan1,2,3, Dang Bin1,2,3※, Zhang Jie1,2, Zhang Wengang1,2, Chen Danshuo4
(1.810016,; 2.810016,; 3.810016,; 4.810016,)
Highland barley grows in the Qinghai-Tibet Plateau at an elevation of 1 400~4 700 m, and it is the major crop in the Qinghai-Tibet Plateau region, as well as the main food for farmers and herdsmen in Tibetan areas for sustenance. Black highland barley is a precious germplasm resource. Black highland barley has attracted extensive attention due to its rich nutrition and functional chemical components in the Qinghai-Tibet Plateau region. It has been developed into various types of food. But in the process of black highland barley, lots of brans were produced and wasted. The black barley bran is rich in phenolic compounds including phenolic acids and flavonoids. At present, most of the reports on polyphenols in black highland barley have been about free phenolics. There are few reports about bound phenolics. There have been no reports regarding research on separation and purification of bound phenolic compounds and their antioxidant activities in black highland barley bran from the Qinghai-Tibet Plateau region. This paper focuses on the separation and purification technology of bound polyphenols in barley highland bran and its antioxidant activity. The aim of this study was selecting a resin which has a good adsorption and desorption performance of phenols of black highland barley bran, optimizing the separation process parameters and evaluating its antioxidant activity in vitro, thus improving value of processing and utilization about black highland barley barley bran. The separation and purification process of black highland barley barley bran polyphenol was established by macroporous resin. The static adsorption and desorption performance of ten different polarities macroporous resins (NKA-9, NKA-2, HPD-826, HPD-100, H1020, D101, X-5 and AB-8) to total phenolics and flavonoids of black highland barley barley bran bound extraction were compared to select suitable resin for purification of phenolic compounds. AB-8 macroporous resin exhibited the best capability of adsorption and desorption of total phenolics and total flavonoids in black highland barley bran, it was selected as the best adsorption resin type of separation and purification of bound phenolics. And the macroporous resin reached equilibrium within 4 h. The optimum conditions for adsorption and desorption of bound phenolics were as following: pH value of black highland barley bran bound phenolic extract was adjustment to 3.0, sample concentration was 1.5 mg/mL, the polyphenol was passed through the AB-8 resin at a flow rate of 1.5 mL/min, followed by desorption with 60% ethanol at a flow rate of 1.5 mL/min. Under optimum technology conditions, Ab-8 macroporous resin could significantly increase the content of over 71.43% individual phenolics, the most abundant bound phenolics were ferulic acid, syringic acid, benzoic acid, ellagic acid, myricetin and rutin in the purified black highland barley bran. Among the three antioxidant systems, the crude and purified extracts of bound polyphenols in black highland barley bran both showed a relatively higher capacity to scavenge DPPH×and ABTS×+. It also had a relatively stronger ferric reducing antioxidant power (FRAP). But the antioxidant capacity of the purified bound polyphenol performed was better than crude sample on this study. In conclusion, AB-8 macroporous resin could be applied to purify total phenolics and total flavonoids of bound polyphenol in litchi pulp black highland barley bran. It has potential industrial application prospect.
grain; polyphenols; resins; black highland barley; bound polyphenol; macroporous resin; separation and purification; antioxidant activity
10.11975/j.issn.1002-6819.2018.21.037
TS255.1
A
1002-6819(2018)-21-0295-09
2018-07-08
2018-09-14
青海省科技厅应用基础项目(2016-ZJ-711);北京大学翁洪武科研原创基金(2018年度);青海省重点实验室科技创新平台建设项目(1-6);青海省“高端创新人才千人计划”(2016年度);青海省第二批“135”高层次人才培养计划(2017年度)
杨希娟,副研究员,博士生,主要从事食品功能化学与营养方面的研究。Email:156044169@qq.com
党 斌,副研究员,主要从事农产品精深加工方面的研究。Email:danbgin811@tom.com
杨希娟,党 斌,张 杰,张文刚,陈丹硕. 黑青稞麸皮结合态酚类物质大孔树脂分离纯化工艺优化[J]. 农业工程学报,2018,34(21):295-303. doi:10.11975/j.issn.1002-6819.2018.21.037 http://www.tcsae.org
Yang Xijuan, Dang Bin, Zhang Jie, Zhang Wengang, Chen Danshuo. Process optimization on separation and purification of bound polyphenol in black highland barley bran by macroporous resin[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(21): 295-303. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.21.037 http://www.tcsae.org

