南亚热带森林丛枝菌根真菌与土壤结构的关系
钟思远, 张静, 褚国伟, 夏艳菊, 唐旭利,*
南亚热带森林丛枝菌根真菌与土壤结构的关系
钟思远1,2, 张静1,2, 褚国伟1, 夏艳菊1,2, 唐旭利1,*
1. 中国科学院华南植物园, 广州 510650 2. 中国科学院大学, 北京 100049
研究了南亚热带不同演替阶段森林土壤理化性质、团聚体组成、微生物群落结构以及球囊霉素相关蛋白(GRSP)含量, 探讨丛枝菌根真菌(AMF)与土壤结构的关系。结果表明: 1)南亚热带森林土壤养分、大团聚体(粒径>2000 μm)含量、平均重量直径(MWD)、AMF生物量以及GRSP含量均随演替而增加。2)不同演替阶段森林土壤团聚体组成的差异主要发生在10—20 cm土层, 该土层总GRSP含量、易提取GRSP占比、AMF生物量、土壤有机碳(SOC)含量与其MWD具有显著正相关性。3)相关性分析表明, 在南亚热带森林, AMF生物量与其总GRSP含量、易提取GRSP占比、土壤微生物量、SOC含量具有显著正相关性; 总GRSP含量、易提取GRSP占比、AMF生物量、土壤微生物量、SOC含量与其大团聚体含量、MWD具有显著正相关性, 而与其中、小型团聚体含量具有显著负相关性。以上研究结果表明, AMF能够通过分泌GRSP、改变土壤微生物群落、促进土壤碳固持等措施影响南亚热带森林土壤结构稳定性。
丛枝菌根真菌; 土壤团聚体; 球囊霉素相关蛋白; 土壤微生物; 南亚热带森林
1 前言
土壤团聚体是土壤结构的基本单位, 良好的团聚体结构是土壤肥力的物质基础[1], 在自然生态系统中具有重要作用, 与水土流失、生态系统恢复、土壤碳动态以及全球变化都有着密切关系[2]。土壤团聚体的形成和稳定是一个非常复杂的过程, 包括一系列化学、物理和生物作用以及它们之间的协同作用[3], 受到土壤有机质、土地利用方式、土壤微生物、管理措施等的影响。
微生物是影响土壤团聚体形成和稳定的最重要和最活跃的生物因素, 不同微生物与不同类型土壤结构稳定性之间的关系一直是生态学中的研究热点[4]。研究表明, 真菌对团聚体形成的作用最大, 其次为放线菌、细菌[5]。菌根真菌与高等植物营养根系所形成的菌根联合体, 是自然界中一种普遍存在的共生现象。据估计, 菌根真菌能与陆地上约80%的维管植物形成共生体[6]。研究表明, 菌根真菌能在不同的尺度通过不同的机制作用于土壤团聚体: 菌根真菌能够通过对植物群落的调节而影响土壤结构, 其菌丝还可以通过生物的(影响微生物群落结构等)、生化的(释放分泌物等)以及物理的(菌丝对于土壤微小颗粒的缠绕等)过程影响土壤团聚体的形成和稳定[7]。此外, 丛枝菌根真菌(Arbuscular mycorrhizal fungi, AMF)菌丝分泌的特异性蛋白——球囊霉素相关蛋白(Glomalin-Related Soil Protein, GRSP)[8], 具有“超级胶水”的功能, 也被认为是促进土壤团聚体形成和稳定的重要因素[9-10]。
目前关于丛枝菌根真菌影响土壤团聚体形成的研究大都集中于农田[11]和草地[12]。在研究手段上多以室内盆栽实验为主[13], 而盆栽实验往往比野外测定更易检测出丛枝菌根真菌对于土壤团聚体的影响[14], 其研究成果是否能够推演自然生态系统, 特别是组成、结构复杂的森林生态系统中还不得而知[15]。以往对于南亚热带森林演替过程的研究大多关注其碳、氮、磷等状态量的变化[16-18], 而较少关注微生物动态, 鲜有微生物与土壤物理结构的研究。有研究表明, 在丛枝菌根真菌以及球囊霉素相关蛋白的作用下, 不同种类植物根际的土壤团聚体组成存在明显差异[10], 并且菌根真菌影响土壤团聚体形成的方式也因环境条件而异[7]。本地区季风常绿阔叶林(Monsoon evergreen broad leaved forest, BF)各演替阶段的森林生态系统菌根化比例接近70%[19], 菌根资源较为丰富。南亚热带森林丰富的菌根资源是否对土壤团聚体的形成和稳定性维持存在可以检测的影响及其潜在的机制是值得研究的问题。
针对上述研究背景, 本研究以南亚热带地带性森林类型——季风常绿阔叶林及其演替系列上处于演替早期的马尾松()林(Pine forest, PF)和演替中期的针阔叶混交林(Mixed pine and broadleaf forest, MF)为对象, 以土壤团聚体为载体, 以丛枝菌根真菌为切入点, 通过分析不同演替阶段森林的土壤理化性质、团聚体组成、微生物群落结构、球囊霉素相关蛋白含量等指标, 旨在探讨丛枝菌根真菌与南亚热带森林土壤结构之间的关系, 以期进一步了解丛枝菌根真菌在南亚热带森林自然演替过程中所发挥的作用。
1 材料与方法
1.1 研究地概况
研究地位于广东省肇庆市鼎湖山自然保护区(23°10′N, 112°34′E), 面积1145 hm2, 是中国第一个自然保护区。该区属于南亚热带季风气候, 年平均温21.4 ℃, 年平均相对湿度为80%, 年平均降雨量为1927 mm, 有明显的干湿季, 每年4至9月为湿季, 10月至次年3月为旱季。研究区主要土壤类型为赤红壤, 是南亚热带的地带性土壤类型, 自然酸化严重, pH值在4.1—4.9之间。土壤质地以壤土为主, 但多含石砾[20]。
本文选择季风常绿阔叶林自然演替系列上3 种典型演替阶段的森林, 包括马尾松林、针阔叶混交林和季风常绿阔叶林为研究对象, 这3种森林类型在群落自然演替系列上存在先后继承关系, 即: 马尾松林→针阔叶混交林→季风常绿阔叶林。上述森林群落分布在鼎湖山自然保护区海拔200—300 m处, 为此高度的主要森林类型[21]。
1.2 样品采集
于2015年11月在马尾松林、针阔混交林、季风常绿阔叶林每个林内各选择3个坡向相同、坡度基本一致样点挖取剖面进行采样。采集0—10、10—20、20—40、40—60 cm土壤样品, 每个样品分两部分保存, 一份100 g左右用于微生物群落结构分析的鲜土装入密封袋中, 并置于放有冰袋的保温箱中保存, 另一份300 g左右用于土壤团聚体分析的各层原状土样装于硬质塑料盒中, 在实验室将原状土沿其自然结构轻轻剥成直径为10—12 mm 的小土块, 并剔除粗根和小石块。土样平摊在通风透气处, 自然风干[22]。其中部分样品用于土壤理化性质分析, 风干后剔除碎石等杂物, 过2 mm筛后装袋备用。
1.3 土壤理化性质分析
土壤有机碳(Soil Organic Carbon, SOC)、全氮、全磷分别采用重铬酸钾氧化-外源加热法、半微量开氏法、钼锑抗比色法测定[23]。
1.4 土壤团聚体分析
土壤自然风干后, 用土壤粒径分析仪(DM200- III, 上海德玛信息技术有限公司, 上海)在不影响土壤团聚体结构的情况下对土壤进行粒径分析。团聚体粒径分为<53 μm, 53—250 μm, 250—2000 μm及> 2000 μm共4个等级。分析时将53 μm、250 μm和2000 μm三个标准筛盒自下而上装配, 称取200 g风干土置于2000 μm筛盒中, 再将筛盒与筛盖装好, 一起置于筛桶中浸泡 5 min后以50 HZ·MIN-1上下震荡30 min。分别收集各孔径筛盒以及筛桶中的土壤悬液, 筛盒及桶壁上的残留物用蒸馏水反复冲洗后一并加以收集[24]。操作完毕后将湿筛法获得的4个粒径的团聚体组分置于60 ℃烘箱中烘干称重, 并按照彭思利等[25]的方法计算平均质量直径(Mean Weight Diameter,MWD)。
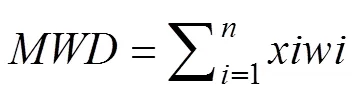
式中:是筛分出来的任一粒径范围团聚体的平均重量直径;是任一粒径范围团聚体的重量占土壤样品干重的百分比。求和是所有粒径范围的团聚体数量。反映土壤团聚体大小分布状况, 其值越大表示团聚体的平均粒径团聚度越高, 稳定性越强[26]。
本研究以250 µm为界线将水稳性团聚体分为大团聚体(Macro-aggregates, A)和微团聚体(Micro- aggregates, M)2类。根据窦森等[1]研究, 对水稳性团聚体进行进一步划分, 其中大团聚体(A)又可分为>2000 µm的大团聚体(A1)和250—2000 µm的中型团聚体(A2)两类; 微团聚体(M)分为53—250 µm(M1)和<53 µm(M2)两类。
1.5 微生物群落结构组成测定
土壤微生物群落结构组成采用改进后的磷脂脂肪酸法( Phospholipid Fatty Acid, PLFA)测定[27]。称取相当于8 g干土重的新鲜土壤样品, 经浸提、分离、提纯后萃取磷脂, 并酯化形成脂肪酸甲酯, 利用气象色谱仪(Hewlett-Packard 6890, 安捷伦, 美国)测定微生物各种磷脂脂肪酸的含量。利用土壤微生物特定的磷脂脂肪酸含量和碳内标19: 0的浓度来计算各微生物生物量及群落的丰富度。单个PLFA 的含量采用nmol·g-1干土进行描述, PLFA 的相对丰度用mol%表示, 并用标准命名法进行分类命名[28-30]。
1.6 球囊霉素相关蛋白含量测定
本研究采用张静等[31]在Wright 等[8]的基础上改进的方法测定土壤中球囊霉素相关蛋白含量。按照提取方法, 分别测定易提取球囊霉素相关蛋白( Easy Extractable GRSP, EE-GRSP)和总球囊霉素相关蛋白( Total GRSP, T-GRSP) 含量。
1.7 统计分析方法
采用SPSS Statistics 20.0中单因素方差分析比较同一林型不同土层间以及同一土层不同林型间的土壤养分含量、团聚体组成、PLFAs含量以及GRSP含量的差异和显著性, 多重比较采用最小显著极差法(LSD)。用Person相关系数检验团聚体组成与土壤养分含量、GRSP含量以及微生物群落结构之间的相关性, 用Excel、SigmaPlot 12.5软件绘制图表。
2 结果与分析
2.1 不同演替阶段土壤养分含量
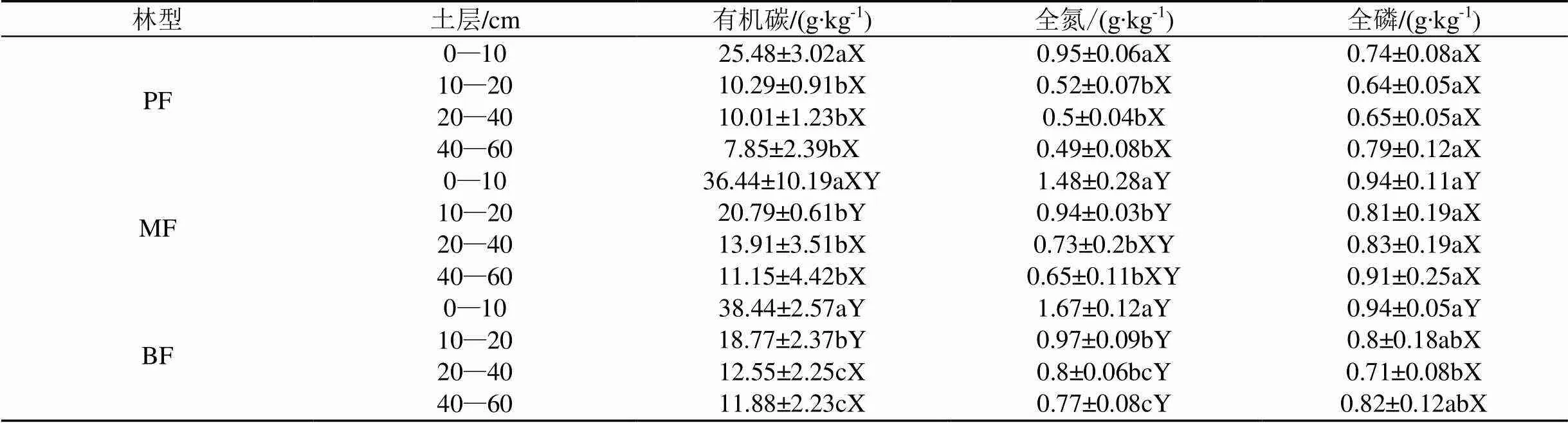
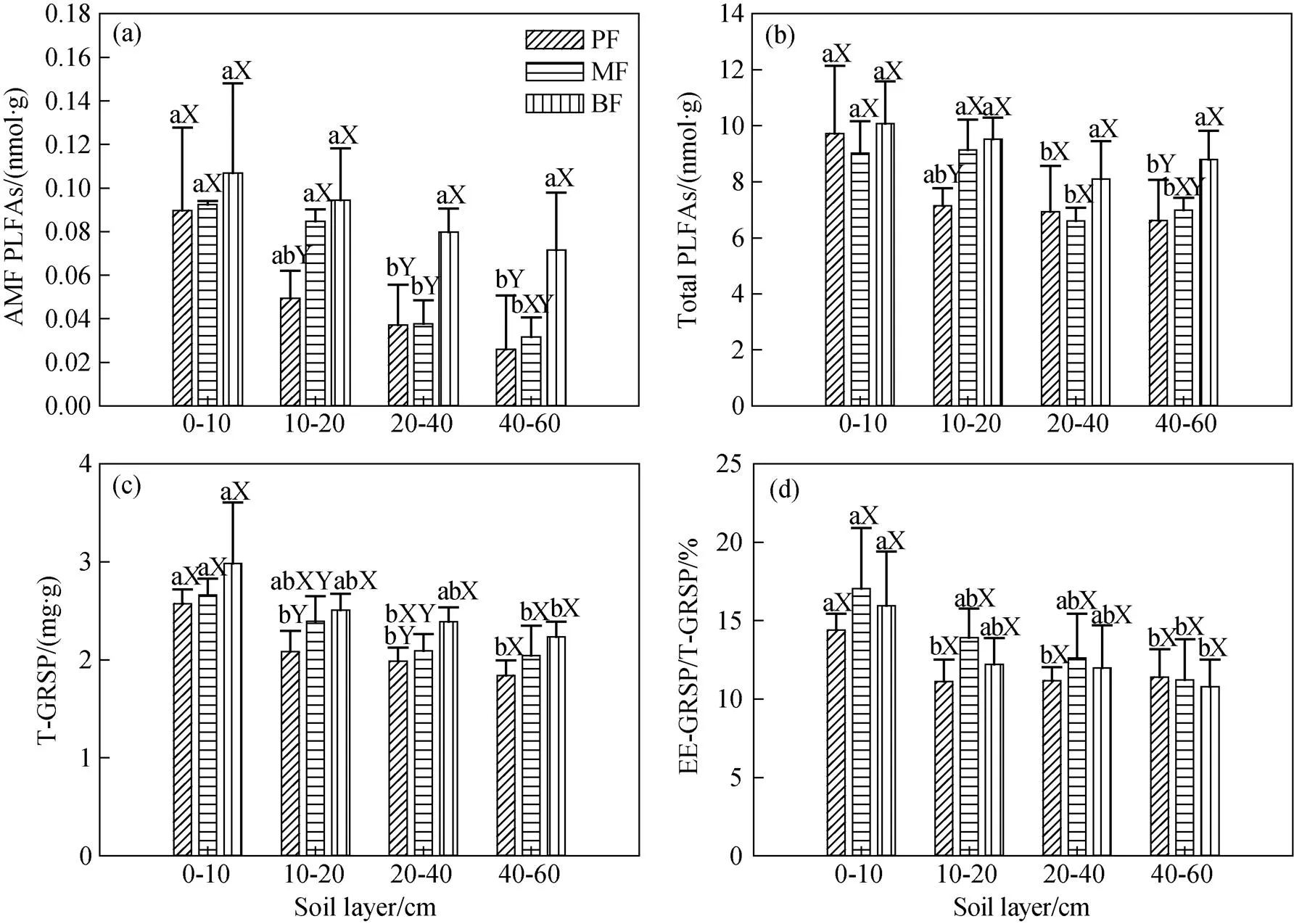
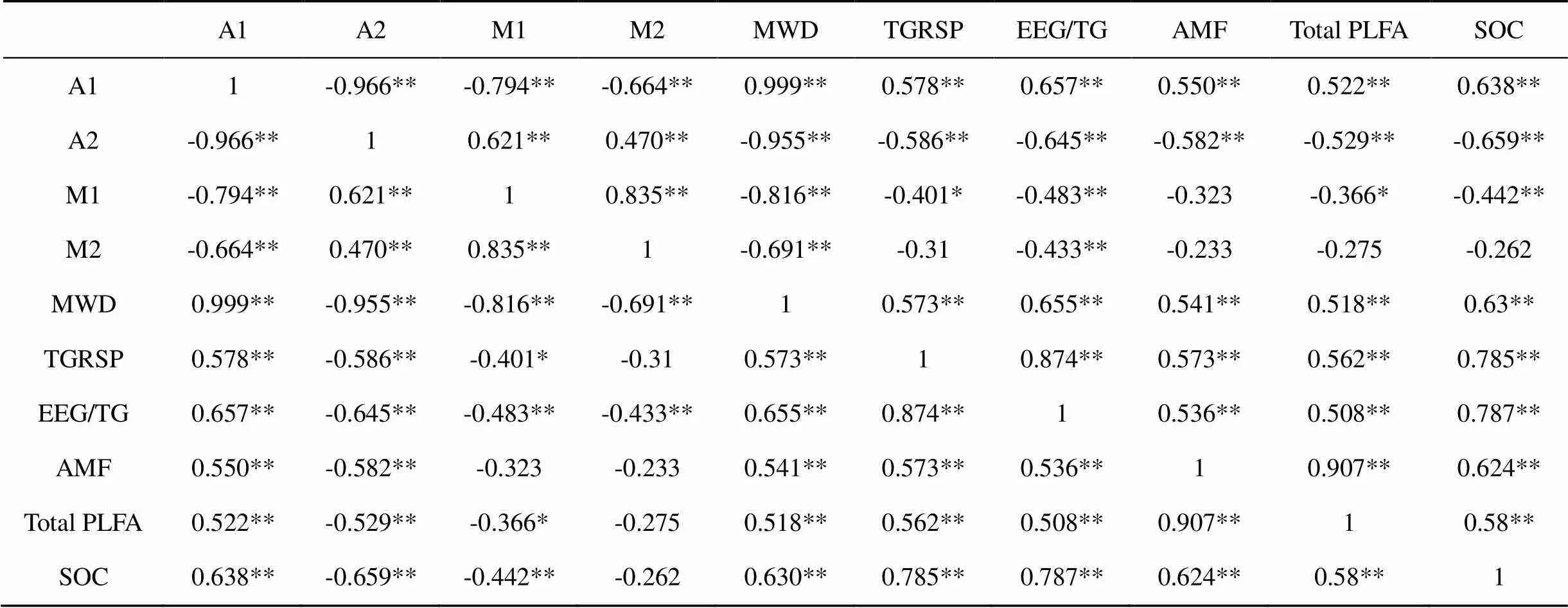
随着演替进行, 土壤有机碳、全氮、全磷含量均有所增加, 表现为PF 不同土层间, 土壤有机碳、全氮含量均呈现出随土层的加深而减少的趋势, 在各演替阶段差异均达到统计显著水平(<0.05)。土壤全磷含量也表现出随土层的加深而减少的趋势(表1)。 在所有的取样土层中, 各演替阶段森林土壤团聚体组成均为A1>A2>M1>M2。随着演替进行, A1和MWD均增加; 而M1和M2却显著降低(<0.05), A2也具有类似趋势, 但三个林型间差异并不显著(>0.05) (图1)。 表1 不同演替阶段土壤养分含量 注: PF,马尾松林; MF,针阔叶混交林; BF, 季风常绿阔叶林。不同大写字母表示不同林型间差异显著, 不同小写字母表示不同土层间差异显著(<0.05)。下同。 注: a、b、c、d、e分别表示不同演替阶段森林土壤A1(>2000 µm团聚体)、A2(250—2000 µm团聚体)、M1(53—250 µm团聚体)、M2(<53 µm团聚体)以及MWD分布特征(平均值±标准误差)。 土壤团聚体组成在不同林型间的差异主要发生在10—20 cm土层, 其中A1和MWD均表现为PF 不同土层间, A1和MWD均随着土层加深而呈下降的趋势; 而A2则随着土层加深而有所增加, M1、M2也有深层土大于表层土的趋势(图1)。 随着演替的进行, 丛枝菌根真菌生物量、土壤微生物量、T-GRSP含量均增加(图2)。丛枝菌根真菌生物量以及土壤微生物量在PF中最低, 分别为0.05±0.02、7.60±1.92 nmol∙g-1; 其次为MF , 分别为0.06±0.03、7.94±1.41 nmol∙g-1; 在BF中最高, 分别为0.15±0.09、9.13±1.28 nmol∙g-1(图2a、b)。T-GRSP含量也表现为PF(2.14±0.3 mg∙g-1)< MF(2.33±0.37 mg∙g-1) 丛枝菌根真菌生物量以及土壤微生物量在不同林型间的差异主要发生在10—20 cm土层, 表现为PF显著低于MF、BF(<0.05)。该土层T-GRSP含量随着演替的进行逐渐增加, EEG/TG则表现为PF< BF 不同土层间, 土壤微生物量呈现出随土层的加深而减少的趋势, 丛枝菌根真菌生物量也随着土层的加深而有所降低, 在MF中这种现象尤其明显, 差异达到统计显著水平(<0.05)。T-GRSP含量、EEG/ TG均随着土层的加深而表现出逐渐降低的趋势, T-GRSP含量在PF各土层间差异显著(<0.01)。 为探明南亚热带森林不同土层土壤结构与丛枝菌根真菌相关指标之间的关系, 对各土层MWD与其T-GRSP、EEG/TG、AMF生物量、土壤有机碳含量进行相关性分析。结果表明, 10—20 cm土层MWD与其T-GRSP、EEG/TG、AMF生物量、有机碳含量存在显著的正相关关系(P<0.05); 而在其他土层, MWD与其各项指标间均不具有显著相关性(表2)。 注: a、b、c、d分别表示不同演替阶段森林土壤中丛枝菌根真菌生物量、土壤总微生物生物量、总球囊霉素相关蛋白含量以及易提取球囊霉素相关蛋白所占比例(平均值±标准误差)。 表2 各土层MWD与丛枝菌根真菌、球囊霉素相关蛋白、土壤有机碳相关性检验 注: *,<0.05; **,<0.01;=9. 为探明南亚热带森林土壤团聚体组成与丛枝菌根真菌相关指标之间的关系, 对各粒径土壤团聚体、MWD、T-GRSP、EEG/TG、AMF生物量、土壤微生物量、有机碳含量进行相关性分析。结果表明: 南亚热带森林与其A1含量具有极显著正相关性(<0.01), 而与其A2、M1、M2含量具有极显著负相关性(<0.01)(表3)。 T-GRSP、EEG/TG、AMF生物量、土壤微生物量、有机碳含量与其、A1含量具有显著正相关性(<0.05), 而与其A2、M1、M2含量具有负相关性(表3)。 丛枝菌根真菌生物量与其T-GRSP含量、EEG/TG、土壤微生物量、有机碳含量间均具有极显著正相关性(<0.01)(表3)。 本研究结果表明, 南亚热带森林土壤大团聚体(>2000 µm团聚体)含量、MWD随着森林演替增加,而中、微型团聚体(250—2000 µm、53—250 µm以及<53 µm团聚体)含量则随演替有所降低 (图1)。说明随着演替的进行土壤结构稳定性不断增强, 演替顶级季风常绿阔叶林土壤结构明显优于演替初期的马尾松林, 这与早期的研究结果一致[32]。对在土壤团聚体形成过程中发挥重要作用的土壤微生物进行了探讨, 发现本地区丛枝菌根真菌生物量以及土壤微生物量均随演替有所增加(图2a、b)。研究表明, 土壤微生物数量随土壤养分含量的增加而增加[34], 而在南亚热带森林, 与土壤微生物关系密切的碳、氮、磷等养分含量均随演替而升高(表1), 这可能是造成土壤微生物数量随演替而增加的原因之一。岳琳艳等[33]研究也表明: 随着演替的进行, 土壤微生物组成将发生显著改变。GRSP作为土壤团聚体形成过程中的重要胶结物质[10,35], 其含量也随演替而呈现逐渐增加的趋势(图2c)。EE-GRSP是GRSP中新近产生或即将分解的部分[15], 而GRSP在土壤中的周转时间较长[36], 故其在T-GRSP中所占比例能在一定程度上反映丛枝菌根真菌分泌GRSP的能力, 本研究发现, EEG/TG在各林型间无显著差异(图2d),说明随着演替的进行, 南亚热带森林中丛枝菌根真菌分泌GRSP的能力无明显变化。 表3 南亚热带森林土壤团聚体组成与丛枝菌根真菌、球囊霉素相关蛋白、土壤有机碳相关性检验 注: *,<0.05; **,<0.01;=36。 在南亚热带各演替阶段森林中, MWD以及大团聚体含量均随着土层的加深而降低(图1a、e), 土壤微生物量以及GRSP含量在土壤剖面上也表现出类似的趋势(图2a、b、c), 这可能与土壤有机质含量有关[37], 其作为土壤团聚体形成的重要胶结物质以及土壤微生物的主要能量来源, 随土壤深度增大, 有机质的来源不断减少, 而成土时间增加, 分解作用导致的有机质含量降低幅度增大, 有机质含量不断减少(表1)。温达志等[38]研究发现, 在本地区, 对于大团聚体形成具有重要作用的细根主要分布在近地表层, 随土层的加深, 其生物量明显减少, 这也可能是造成土壤结构随土层变化的原因之一。 南亚热带不同演替阶段森林土壤团聚体组成的差异主要发生在10—20 cm土层(图1); 微生物群落结构组成差异也主要发生在10—20 cm土层(图2a、b), 这与梁健等[39]研究结果相似: 10—20 cm土层中的微生物群落受植被演替变化的影响较大, 并且该土层T-GRSP含量也随着演替的进行明显增加(图2c)。为探究10—20 cm土层土壤结构出现差异的原因及其与丛枝菌根真菌的关系, 对各土层MWD与其丛枝菌根真菌相关指标进行相关性分析发现, 在南亚热带森林10—20 cm土层中, MWD与其T-GRSP含量、EEG/TG、丛枝菌根真菌生物量、土壤有机碳含量具有显著的正相关性(表2), 说明T-GRSP含量、丛枝菌根真菌生物量及其分泌GRSP的能力、土壤有机碳含量是影响10—20 cm土层土壤结构稳定性的重要因素。这与彭思利等[25]研究结果类似, 其发现接种丛枝菌根真菌能够显著提高土壤中有机质以及GRSP含量, 从而使得土壤水稳性大团聚体数量以及MWD显著增加。Wu et al.[13]的研究也同样发现菌根真菌能够通过直接或间接的作用来影响土壤团聚体的稳定性。 为探究丛枝菌根真菌对南亚热带森林土壤结构的影响及其作用机制, 对土壤团聚体组成与丛枝菌根真菌相关指标进行相关性分析发现: 在南亚热带森林中, T-GRSP、EEG/TG、丛枝菌根真菌生物量、土壤微生物总量、有机碳含量与其MWD、大团聚体A1含量具有显著正相关性, 而与其A2、M1、M2含量则具有较为显著的负相关关系; 同时发现, 丛枝菌根真菌生物量与其T-GRSP含量、EEG/TG、土壤微生物总量、有机碳含量间均具有极显著正相关性(表3)。说明在南亚热带森林中, 丛枝菌根真菌能够通过分泌GRSP、增加土壤微生物量、促进土壤碳固持等措施促进中、微型团聚体胶结成大团聚体, 从而有利于大团聚体的形成与稳定, 增强土壤结构稳定性, 而对中、微型团聚体的形成具有显著的抑制效应[4,10,40], 从而使得本地区土壤团聚体组成均为以大团聚体为主, 而中、微型团聚体次之(即A1>A2>M1>M2)(图1)。这与Wright等[9]的研究结果一致, 表明丛枝菌根真菌及其分泌物GRSP对于增强土壤团聚体的稳定性具有重要影响, 丛枝菌根真菌通过其菌丝对土壤颗粒的缠绕、促进土壤碳固持以及影响土壤微生物群落结构等促进土壤水稳性团聚体的形成及稳定[7], 而其分泌物GRSP为具有超强粘性作用的糖蛋白, 并且与菌丝相比, 其在土壤环境中周转较慢, 用14C标记实验表明GRSP在土壤中的周转时间可达6~42年之久[36], 所以其在形成和稳定土壤团聚体方面具有较大的优势。 本研究结果表明, 南亚热带森林土壤养分含量、大团聚体含量、土壤结构稳定性、微生物生物量和GRSP含量均随演替增加。不同演替阶段森林土壤团聚体组成变化主要发生在10—20 cm土层, 丛枝菌根真菌是引起该土层土壤稳定性出现差异的原因之一。在南亚热带森林中, 丛枝菌根真菌能够通过分泌GRSP、增加土壤微生物量、促进土壤碳固持等措施促进大团聚体的形成与稳定, 增强土壤结构稳定性。 [1] 窦森, 李凯, 关松. 土壤团聚体中有机质研究进展[J]. 土壤学报, 2011, 48(2): 412–418. [2] DIAZ-ZORITA M, PERFECT E, GROVE J H. Disruptive methods for assessing soil structure[J]. Soil & Tillage Research, 2002, 64(1/2): 3–22. [3] AMÉZKETA E. Soil Aggregate Stability: A Review[J]. Journal of Sustainable Agriculture, 1999, 14(2/3): 83–151. [4] 李娜, 韩晓增, 尤孟阳,等.土壤团聚体与微生物相互作用研究[J]. 生态环境学报, 2013, 22(09): 1625–1632. [5] 尹瑞龄. 微生物与土壤团聚体[J]. 土壤学进展, 1985, (4): 24–29. [6] SMITH S E, READ D J. Mycorrhizal symbiosis[M]. 3 rd ed. London: Academic Press ,2008: 13–611. [7] RILLIG M C, MUMMEY D L. Mycorrhizas and soil structure[J]. New Phytologist, 2006, 171(1): 41–53. [8] WRIGHT S F, UPADHYAYA A. Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J]. Soil Science, 1996, 161(9): 575–586. [9] WRIGHT S F, UPADHYAYA A. A survey of soils for aggregate stability and glomalin, a glycoprotein produced by hyphae of arbuscular mycorrhizal fungi[J]. Plant and Soil, 1998, 198(1): 97–107. [10] RILLIG M C, WRIGHT S F, EVINER V T. The role of arbuscular mycorrhizal fungi and glomalin in soil aggregation: comparing effects of five plant species[J]. Plant and Soil, 2002, 238(2): 325–333. [11] SPOHN M, GIANI L. Impacts of land use change on soil aggregation and aggregate stabilizing compounds as dependent on time[J]. Soil Biology & Biochemistry, 2011, 43(5): 1081–1088. [12] RILLIG M C, MAESTRE F T, LAMIT L J. Microsite differences in fungal hyphal length, glomalin, and soil aggregate stability in semiarid Mediterranean steppes[J]. Soil Biology & Biochemistry, 2003, 35(9): 1257–1260. [13] WU Q S, CAO M Q, ZOU Y N, et alDirect and indirect effects of glomalin, mycorrhizal hyphae, and roots on aggregate stability in rhizosphere of trifoliate orange[J]. Scientific Report, 2014, 4: 5823. [14] LEIFHEIT E F, VERESOGLOU S D, LEHMANN A, et al. Multiple factors influence the role of arbuscular mycorrhizal fungi in soil aggregation-a meta-analysis[J]. Plant and Soil, 2014, 374(1-2): 523–537. [15] RILLIG M C. Arbuscular mycorrhizae, glomalin, and soil aggregation[J]. Canadian Journal of Soil Science, 2004, 84(4): 355–363. [16] ZHOU G Y, LIU S G, LI Z,et al.Old-growth forests can accumulate carbon in soils[J]. Science, 2006, 314(5804): 1417–1417. [17] MO J M, LI D J, GUNDERSEN P. Seedling growth response of two tropical tree species to nitrogen deposition in southern China[J]. European Journal of Forest Research, 2008, 127(4): 275–283. [18] HUANG W, LIU J, WANG Y P,et al. Increasing phosphorus limitation along three successional forests in southern China[J]. Plant and Soil, 2012, 364(1-2): 181–191. [19] 郑克举, 唐旭利, 张静, 等. 季风常绿阔叶林演替系列菌根资源及其与群落多样性的关系[J]. 生态环境学报, 2013, 22(5): 729–738. [20] 吴厚水. 鼎湖山自然保护区水热状况及其与生态环境的关系[J]. 热带地理, 1982, (4): 14–20. [21] 周国逸, 周存宇, LIU S G, 等. 季风常绿阔叶林恢复演替系列地下部分碳平衡及累积速率[J]. 中国科学(D辑:地球科学) , 2005, 35(6): 502–510. [22] 顾伟, 李志安, 邹碧, 等. 华南热带人工林土壤有机碳含量及其稳定性特征[J]. 热带亚热带植物学报, 2007, 15(5): 369–376. [23] 刘光崧.土壤理化分析与剖面描述[M]. 北京: 中国标准出版社, 1996. [24] 龙凤玲, 李义勇, 方熊, 等. 大气CO2浓度上升和氮添加对南亚热带模拟森林生态系统土壤碳稳定性的影响[J]. 植物生态学报, 2014, 38(10): 1053–1063. [25] 彭思利, 申鸿, 郭涛. 接种丛枝菌根真菌对土壤水稳性团聚体特征的影响[J]. 植物营养与肥料学报, 2010, 16(3): 695–700. [26] SALAKO F K, HAUSE R. Influence of different fallow management systems on stability of soil aggregates in southern nigeria[J]. Communications in Soil Science and Plant Analysis, 2001, 32(9/10):1483–1498. [27] BOSSIO D A, SCOW K M. Impact of carbon and flooding on the metabolic diversity of microbial communities in soils[J]. Applied and Environmental Microbiology, 1995, 61(11): 4043– 4050. [28] 王卫霞, 罗达, 史作民, 等. 岷江干旱河谷造林对土壤微生物群落结构的影响[J]. 生态学报, 2014, 34(4): 890–898. [29] 罗达, 史作民, 唐敬超, 等. 南亚热带乡土树种人工纯林及混交林土壤微生物群落结构[J]. 应用生态学报, 2014, 25(9): 2543–2550. [30] FANG X, ZHOU G Y, LI Y L, et al. Warming effects on biomass and composition of microbial communities and enzyme activities within soil aggregates in subtropical forest[J]. Biology and Fertility of Soils, 2016, 52(3): 353–365. [31] 张静, 唐旭利, 郑克举, 等. 赤红壤地区森林土壤球囊霉素相关蛋白测定方法[J]. 生态学杂志, 2014, 33(1): 249–258. [32] 闫俊华, 周国逸, 陈忠毅. 鼎湖山三种演替群落与其土壤结构及其某些水文效应耦合研究[J]. 资源生态环境网络研究动态, 2000, 11(1):6–11. [33] 岳琳艳, 郑俊强, 韩士杰, 等. 长白山温带森林不同演替阶段土壤化学性质及微生物群落结构的变化[J]. 生态学杂志, 2015, 34(9): 2590–2597. [34] 章家恩, 刘文高, 胡刚. 不同土地利用方式下土壤微生物数量与土壤肥力的关系[J]. 土壤与环境, 2002, 11(2): 140–143. [35] WILSON G W, RICE C W, RILLIG M C, et al. Soil aggregation and carbon sequestration are tightly correlated with the abundance of arbuscular mycorrhizal fungi: results from long-term field experiments[J]. Ecology Letter, 2009, 12(5): 452–461. [36] RILLIG M C, WRIGHT S F, NICHOLS K A, et al. Large contribution of arbuscular mycorrhizal fungi to soil carbon pools in tropical forest soils[J]. Plant and Soil, 2001, 233(2): 167–177. [37] 陈庆强, 沈承德, 孙彦敏, 等. 鼎湖山土壤有机质深度分布的剖面演化机制[J]. 土壤学报, 2005, 42(1): 1–8. [38] 温达志, 魏平, 孔国辉, 等. 鼎湖山南亚热带森林细根生产力与周转[J]. 植物生态学报, 1999, 23(4): 74–82. [39] 梁健. 子午岭植物群落演替与土壤养分及微生物群落的关系[D]. 陕西: 陕西师范大学, 2011. [40] TISDALL J M, OADES J M. Organic-matter and water-stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141–163. The relationship between arbuscular mycorrhizal fungi and soil structure in southern subtropical forest ZHONG Siyuan1,2, ZHANG Jing1,2, CHU Guowei1, XIA Yanju1,2, TANG Xuli1,* 1. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China 2. University of Chinese Academy of Sciences, Beijing 100049, China The aim of this study is to understand the relationship between arbuscular mycorrhizal fungi (AMF) and soil structure in southern subtropical forests. Soil properties, soil aggregate compositions, microbial community structure and glomalin-related soil protein (GRSP) concentrations were measured. The results are as follows. (1) Soil nutrients, macro aggregate(particle size>2000μm) concentration, mean weight diameter(MWD), AMF biomass and GRSP concentration increased with the forest succession.(2) The variations of soil aggregate composition in southern subtropical forests mainly occurred in 10-20 cm soil layer. Correlation analysis presented that MWD had a significantly positive correlation with the total GRSP (T-GRSP) concentration, the ratio of easy extractable GRSP to T-GRSP (EE-GRSP/T-GRSP), the AMF biomass and the soil organic carbon (SOC) content in 10-20 cm soil layer. (3) Correlation analysis indicated that AMF biomass had a significantly positive correlation with the T-GRSP concentration, EE-GRSP/T-GRSP, soil microbial biomass and SOC content. The T-GRSP concentration, EE-GRSP/T-GRSP, AMF biomass, soil microbial biomass and SOC content had a significantly positive correlation with macro aggregate concentration and MWD, but had a significantly negative correlation with micro aggregate concentration in southern subtropical forests. Our results suggested that AMF could influence the stability of soil structure by secreting GRSP, changing soil microbial community and promoting SOC sequestration in southern subtropical forests. arbuscular mycorrhizal fungi; soil aggregation; glomalin-related soil protein; soil microbe; southern subtropical forest 10.14108/j.cnki.1008-8873.2018.05.003 X833 A 1008-8873(2018)05-016-09 2017-03-03; 2017-09-09 国家自然科学基金项目(31270499) 钟思远(1992—), 男, 湖南长沙人, 硕士研究生, 主要从事生态系统生态学研究, E-mail: syzhong@scbg.ac.cn 通信作者:唐旭利, 女, 博士, 副研究员, 主要从事生态系统生态学研究, E-mail: xltang@scbg.ac.cn 钟思远, 张静, 褚国伟, 等. 南亚热带森林丛枝菌根真菌与土壤结构的关系[J]. 生态科学, 2018, 37(5): 16-24. ZHONG Siyuan, ZHANG Jing, CHU Guowei, et al. The relationship between arbuscular mycorrhizal fungi and soil structure in southern subtropical forest[J]. Ecological Science, 2018, 37(5): 16-24.2.2 不同演替阶段土壤水稳性团聚体分布特征

2.3 不同演替阶段土壤微生物群落结构以及球囊霉素相关蛋白含量
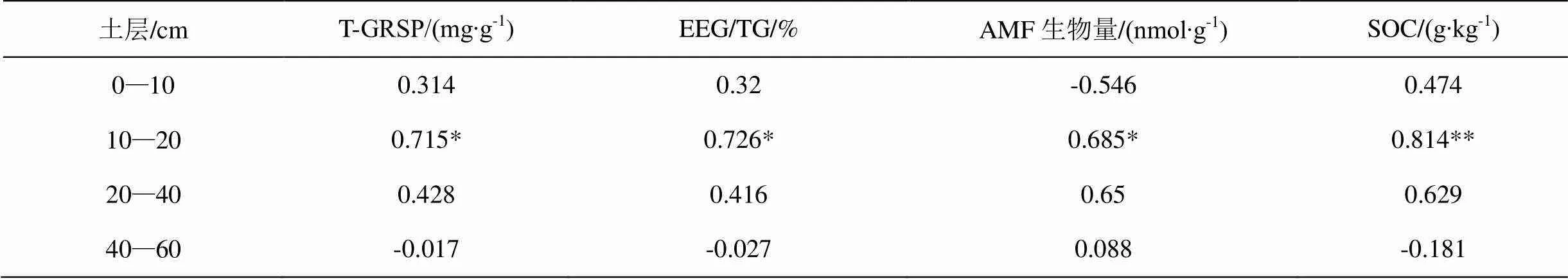
2.4 各土层MWD与丛枝菌根真菌相关指标的相关性分析
2.5 南亚热带森林土壤团聚体组成与丛枝菌根真菌相关指标的相关性分析
3 讨论
5 结论

