二价阳离子在低盐水改变砂岩润湿性中的作用
杨 杰, 董朝霞, 向启贵, 雷 宇, 胡金燕, 彭 锋, 王兴睿
( 1. 中国石油西南油气田分公司 安全环保与技术监督研究院,四川 成都 610000; 2. 中国石油大学(北京) 科学技术研究院,北京 102249; 3. 页岩气评价与开采四川省重点实验室,四川 成都 610000 )
0 引言
岩心驱替实验和现场矿场试验等表明,向砂岩油藏中注入低浓度盐水(一般注入水的矿化度低于5.0 g/L),能够提高砂岩油藏采收率[1-6]。在低盐水驱提高砂岩油藏采收率过程中,注入低盐水可以改变岩石表面的润湿性[7-9]。地层水中的二价阳离子通过低盐水驱改变砂岩表面润湿性,从而提高砂盐油藏采收率[10-12]。当用精制模拟油(不含极性组分的油)进行实验时,润湿性没有发生改变,Tang G Q等[13]提出,原油中的极性组分(尤其是酸性组分)在低盐水改变砂岩表面润湿性过程中具有重要作用。Ligthelm D J等[14]提出低盐水效应(低盐水提高采收率)的机理为双电层扩散机理,即地层水中存在较多的二价阳离子(Ca2+),能够充当桥梁作用,将原油中带负电的酸性物质与负电性的砂岩表面连起来,使酸性物质吸附于砂岩表面,由于酸性组分另一端为石油烃,将导致砂岩表面亲油性更强;注入低盐水时,盐水/石油(酸性组分)界面、矿物/盐水界面之间的阳离子数量减少,两个界面的负电性增强且静电斥力增大,双电层——酸性组分层、矿物表面发生扩散,当盐水矿化度减小到一定程度时,静电斥力超过二价阳离子架桥的力,酸性组分从矿物表面脱落,岩石表面亲水性增强,从而提高砂岩油藏采收率。
Nasralla R A等[15]测试盐水—原油—砂岩体系中盐水接触角,高盐水在砂岩矿物表面的接触角较大,表明砂岩表面亲水性较弱,低盐水在砂岩表面的接触角较小,表明砂岩表面的亲水性较强;Zeta电位测试结果表明,在高盐环境下,油/水界面、砂岩表面的负电性很弱,Zeta电位的绝对值很小;随盐水矿化度降低,两个界面负电性逐渐增强,Zeta电位的绝对值增大。Nasralla R A等[16]测试盐水—原油—砂岩体系中盐水接触角和Zeta电位,盐水浓度增大使岩石矿物表面、油/水界面的负电性减弱,也使岩石表面亲油性增强。Rueslatten H G等[17]提出,当盐水浓度较高时,原油中的酸性组分能与盐水中的阳离子形成有机金属配合物,配合物吸附于砂岩矿物表面,导致砂岩矿物表面油润湿性增强。
Suijkerbuijk B等[18]提出,地层水中的二价阳离子(Ca2+)为“活性离子”,对原油中的酸性组分在岩石表面的吸附起主要作用,即酸性组分主要通过二价离子而非一价离子架桥吸附于岩石表面。当低盐水注入地层时,盐度较低,酸性油组分与岩石之间阳离子减少,两者“双电层”发生扩散,架桥的Ca2+断裂,酸性油组分从岩石表面脱落,岩石润湿性发生改变。Lager A等[11]发现,当初始水中不含二价阳离子(Ca2+)时,降低注入水盐度,没有低盐水效应,且不含二价阳离子的岩心比初始水中含二价阳离子的岩心亲水性更强。由于初始水中的Ca2+具有较强的正电性,原油酸组分能通过Ca2+吸附于岩石表面,导致油润湿性增强,注入低盐水时,酸性组分脱附使岩石表面润湿性发生改变;由于Na+正电性小,原油极性组分不能通过Na+吸附于带负电的岩石表面而改变润湿性。
在不同盐水中,Feng X J等[19]研究腐植酸在矿物表面的吸附,探索盐水离子强度及离子种类对腐植酸吸附的影响。腐植酸在矿物表面的吸附基本随离子强度增加而增大,盐水中的二价阳离子Ca2+比一价阳离子Na+更能显著增加腐植酸的吸附,表明Ca2+桥对岩石表面和腐植酸之间作用贡献更大。Liu Q等[20]研究盐水离子/原油/砂岩体系的润湿性,在碱性条件下,盐水中的二价阳离子能与电离的酸性组分结合,大量吸附于砂岩界面,降低两个界面的负电性,从而增加油、砂岩表面相互作用的可能性。笔者将从宏观及微观上研究低盐水效应,为低盐水改变砂岩表面润湿性、提高砂岩油藏采收率的机理提供指导。
1 实验材料及方法
1.1 材料
岩心:选用同一批次Berea砂岩露头岩心,水测渗透率为(50~100)×10-3μm2,孔隙度约为20%,直径为3.8 cm,长度为14.0 cm,黏土总质量分数为10%。
原油:所用Bakken原油各类参数见表1。Bakken原油酸值为1.3 mg(KOH)/g,属于高酸值原油[21]。

表1 Bakken原油性质
石英砂:选用325目石英颗粒,用去离子水清洗石英颗粒3次;再将清洗后的石英颗粒放入800 ℃温度的马弗炉煅烧,除去石英表面的有机物,得到干燥、干净的石英颗粒。
模拟盐水:配制用于自渗吸实验的模拟盐水(NaCl或CaCl2盐水)(见表2)。
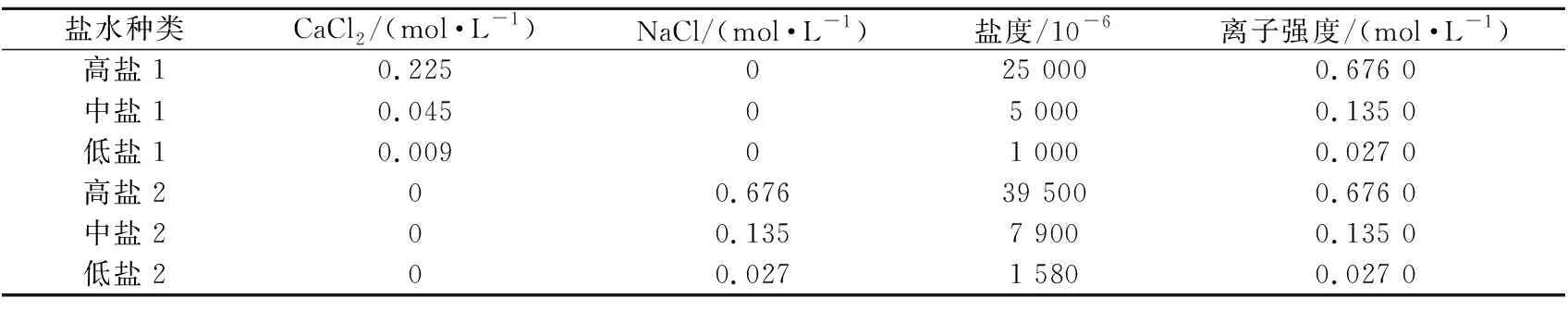
表2 盐水性质
苯甲酸溶液:配制质量浓度为0.1 g/L的苯甲酸溶液[22],用NaOH将苯甲酸溶液pH调到9.5,使苯甲酸完全电离。
1.2 方法
1.2.1 岩心自渗吸实验
将Berea砂岩岩心放入120 ℃温度烘箱并烘干24 h,将干燥的岩心抽真空4 h;然后饱和初始盐水,将岩心放入岩心夹持器,加10 MPa环压,放入60 ℃温度烘箱,开启平流泵,向岩心中注入约10 PV初始盐水,直至岩心末端盐水pH稳定(pH=7);向岩心中注入4 PV原油,饱和油后,将岩心夹持器两端封死,放入60 ℃温度烘箱并老化14 d。用自渗吸装置进行实验,检测不同时间段自渗吸采收率。
1.2.2 Zeta电位检测
实验采用DelsaTMNano型Zeta电位仪,测定石英/盐水界面及盐水/原油界面的Zeta电位。
(1)Zeta电位仪样品池的清洗:依次用石油醚、乙醇、去离子水超声清洗Zeta电位仪的样品池各10 min;再用去离子水冲洗样品池3次;最后用高纯氮气吹干样品池。
(2)样品的制备:将325目石英颗粒与不同离子组成的盐水按质量比(1∶100)混合,用高速搅拌器搅拌10 min,转速为4 000 r/min,配制石英颗粒/盐水悬浮液;将原油与盐水以体积比(1∶100)混合,用高速搅拌器搅拌10 min,转速为4 000 r/min,配制原油/盐水乳状液。
(3)测定:用干净的注射器将样品(悬浮液/乳状液)缓慢注入样品池,避免产生气泡,盖上样品池的盖子。设定各项实验参数,测定压力为标准大气压,测定温度为60 ℃,将仪器预热10 min后进行光散射测定。
1.2.3 石英颗粒吸/脱附苯甲酸
原油中的酸性组分通常为含苯环的酸[23-25],选用苯甲酸作为原油中的模拟酸性组分。
(1)溶液的配制:配制40 mL离子强度分别为0、0.054 0、0.135 2、0.405 6、0.676 0、1.352 0 mol/L的CaCl2、NaCl盐水;配制质量浓度为0.10 g/L的苯甲酸溶液。
(2)石英颗粒吸附苯甲酸:取4 g干净、干燥的石英颗粒放入聚四氟乙烯瓶,向瓶中加入40 mL盐水溶液;再将盛盐水及石英颗粒的聚四氟乙烯瓶放入摇床并摇动1 h,摇床转速为300 r/min,使盐水中的离子在石英颗粒表面的吸附达到平衡。取40 mL苯甲酸溶液倒入聚四氟乙烯瓶进行吸附实验,保持溶液pH为9.5,将装有石英颗粒、盐水、苯甲酸的聚四氟乙烯瓶放入摇床并摇动24 h,使吸附达到平衡状态[26],摇床转速为300 r/min,在吸附过程中,保持溶液pH为9.5,温度设定为60 ℃。吸附完成后,将悬浊液放入离心机离心20 min,转速为3 500 r/min,用总有机碳(TOC)仪测定上层清液中苯甲酸的浓度,作为吸附后溶液中苯甲酸的浓度。根据吸附前溶液中的苯甲酸的浓度与吸附后上层清液中的苯甲酸的浓度差,计算石英表面吸附的苯甲酸的量。
(3)石英颗粒脱附苯甲酸:当石英颗粒在离子强度为0.676 0 mol/L的CaCl2中吸附苯甲酸后,向其中加入去离子水进行稀释;将悬浊液放入摇床,摇动24 h进行脱附,摇床转速为300 r/min,在脱附过程中,保持pH为9.5。脱附完成后,将悬浊液放入离心机离心20 min,转速为3 500 r/min,用总有机碳(TOC)仪测定上层清液中的苯甲酸的浓度。根据脱附前、后苯甲酸浓度差,计算石英表面脱附的苯甲酸的量。
2 分子动力学模拟
采用Accelrys公司开发的Material Studio 软件包中的Discover及Forcite模块进行模拟,选择COMPASS力场。
COMPASS力场的势能函数[27]为
(1)
式中:Et为作用前后变化的总势能;Eb(b)为键伸缩势能;Eθ(θ)为键角弯曲势能;Eφ(φ)为二面角扭曲势能;Eχ(χ)为离平面振动势能;E(b,θ,φ)为能量交叉势能;Ec为静电相互作用能;Ev为范德华相互作用能。等号右边前5项为成键相互作用,后2项为非键相互作用。其中Ec和Ev分别为
(2)
(3)
式(2-3)中:i、j为不同的原子;q为原子电荷;r为不同原子的作用距离;ε为势阱深度。
2.1 模型建立
模拟过程采用周期性边界条件,有阳离子存在的分子力学模型主要分为三部分,包括石英表面层、阳离子层及苯甲酸根层,初始构型见图1。
首先,构建石英晶体,晶体盒子的堆积方式参考经典的六方堆积[28],晶格参数为a=0.491 3 nm,b=0.491 3 nm,c=0.540 5 nm,α=90°,β=90°,γ=120°,构建7×7×1的超胞,再进行体系能量最小化。其次,根据石英表面的晶体参数构建阳离子层,利用“build layer”命令将两层结构组合在一起,再对体系进行能量最小化。最后,根据石英表面和阳离子层的晶体参数构建苯甲酸根层,利用“build layer”命令将石英、阳离子层与苯甲酸根层组合在一起,进行能量最小化,得到分子动力学模拟的最终模型。
利用Forcite模块,分析最终模型中距离石英表面相关原子的浓度分布。在对体系采用COMPASS力场等条件进行能量最小化的过程中,需要固定固体的三维坐标,以防止晶体结构变形。
无阳离子存在的分子力学模型主要分为两部分,包括石英表面层、苯甲酸根层,初始构型见图2。
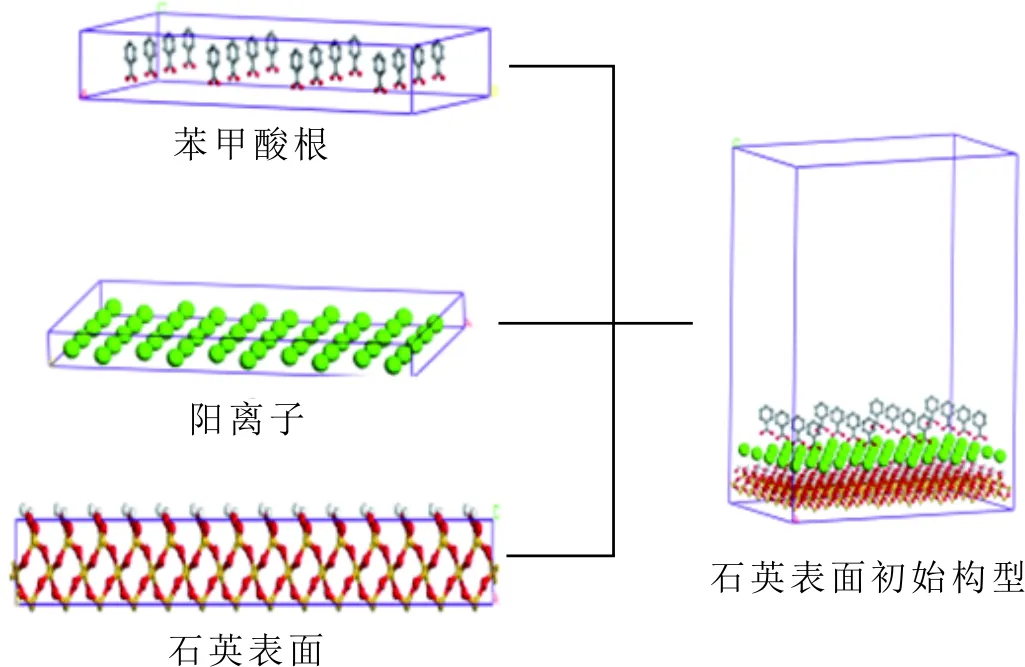
图1 苯甲酸层、阳离子层、石英表面层初始构型Fig.1 The initial configuration of benzoic acid layer, cation layer and quartz surface
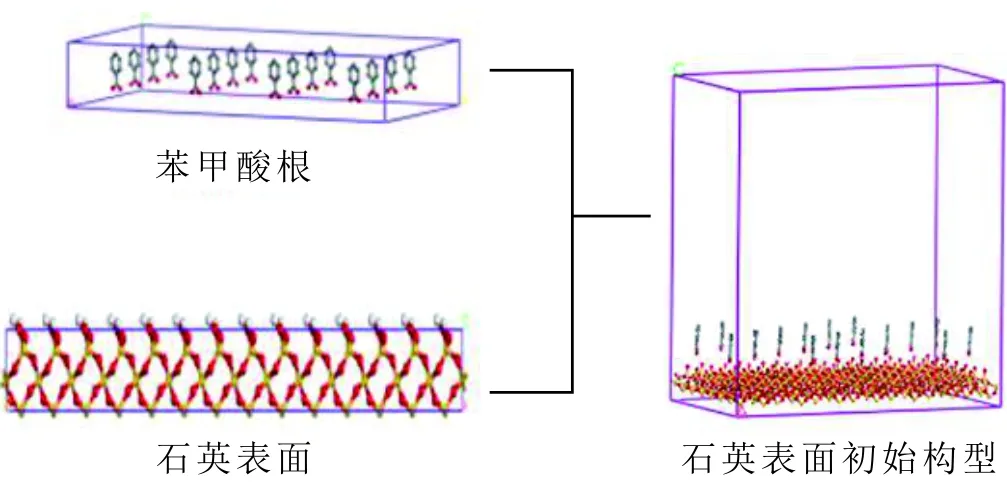
图2 苯甲酸层及石英表面层初始构型Fig.2 The initial configuration of benzoic acid layer and quartz surface
首先,构建石英晶体。其次,根据石英表面的晶体参数构建苯甲酸根层,利用“build layer”命令将两层结构组合在一起,对体系进行能量最小化,得到分子动力学模拟的最终模型。
2.2 结果分析
有阳离子存在的模型能量最小化后得到石英表面、阳离子、苯甲酸根之间的相互作用能[29],反映相互作用的强度,表达式为
ΔEi=Ez-(Ecl+Ea+Eq),
(4)
式中:ΔEi为整个过程中的相互作用能;Ez为作用后石英表面层、苯甲酸层、阳离子层的总能;Ea为相互作用前苯甲酸根的能量;Ecl为相互作用前阳离子层的能量;Eq为相互作用前石英表面的能量。
无阳离子存在的模型能量最小化后得到石英表面、苯甲酸根之间的相互作用能[29],表达式为
ΔEi=Ez-(Ea+Eq)。
(5)
3 结果与讨论
3.1 盐水阳离子种类及浓度对岩心润湿性的影响
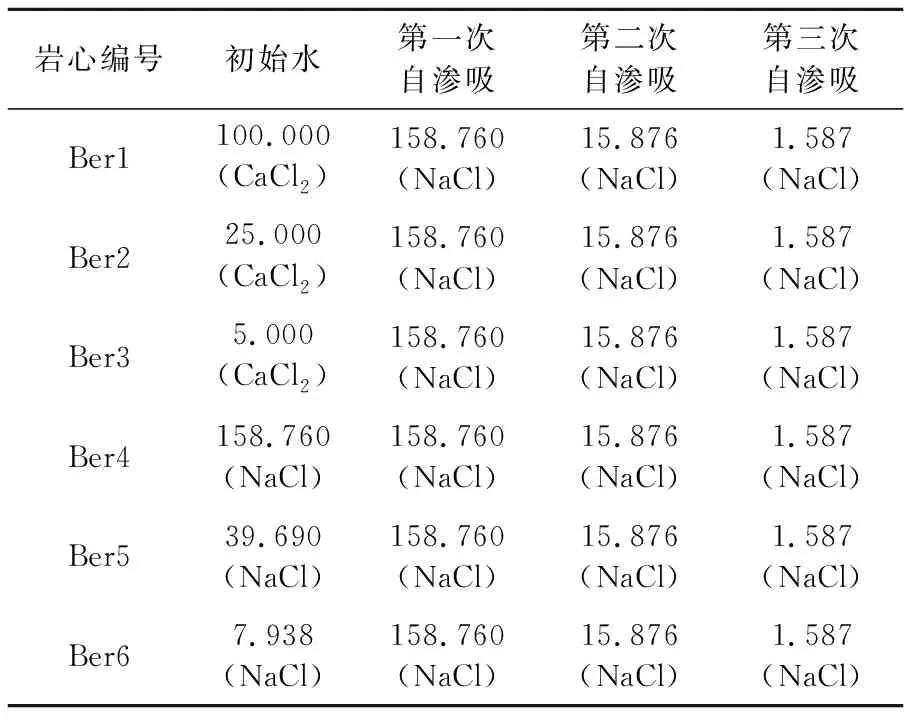
表3 自渗吸盐水组分
岩心自渗吸实验根据初始水中阳离子种类(Ca2+、Na+)及浓度,以及自渗吸盐水浓度,研究阳离子种类及浓度对岩心润湿性的影响。选用同一批次的6根Berea砂岩岩心(Ber1-6)进行岩心自渗吸实验。实验所用自渗吸盐水组分见表3。
由表3可知,在6组自渗吸实验过程中,只有初始盐水不同,其余实验盐水组分相同,岩心Ber1-3初始盐水的离子强度分别与岩心Ber4-6初始盐水的相同。实验结果见图3。由图3可知,自渗吸同一种高盐水(NaCl盐水,158.760 g/L)时,初始水为CaCl2盐水的Ber1-3岩心的采收率及采收速率明显小于初始水为NaCl盐水的Ber4-6岩心的,初始水中CaCl2质量浓度越高,自渗吸高矿化度水的采收率越低,自渗吸、采收速率越小。如岩心Ber1-3初始饱和盐水的矿化度分别为100.000、25.000、5.000 g/L,采收率分别为19.0%、24.0%、29.0%。当初始水中只含有NaCl时,初始水中NaCl质量浓度对自渗吸高矿化度水的采收率及采收速率影响不大,如岩心Ber4-6的采收率约为33.0%,表明初始盐水中的Ca2+影响Berea砂岩的初始润湿性,且初始盐水中的Ca2+质量浓度越高,Berea砂岩岩心亲水性越弱;初始水中的Na+对Berea砂岩的初始润湿性影响不大。
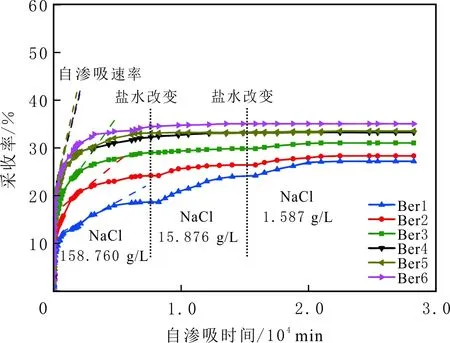
图3 不同初始水对自渗吸采收率影响Fig.3 Effect of initial brine chemistry on oil recovery by spontaneous imbibitions
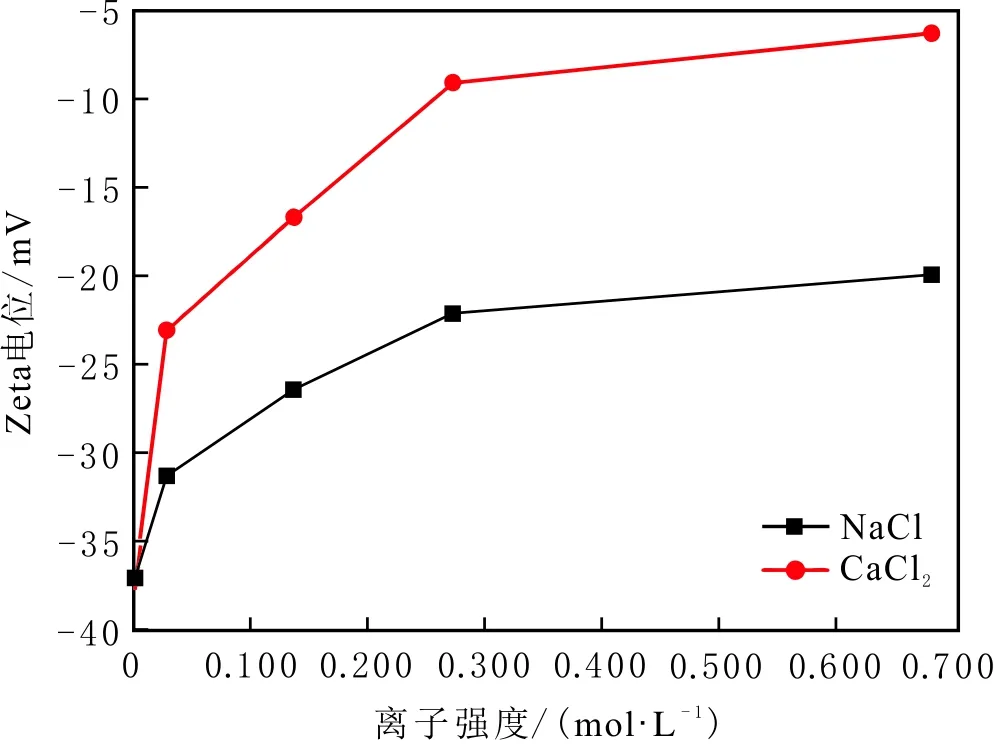
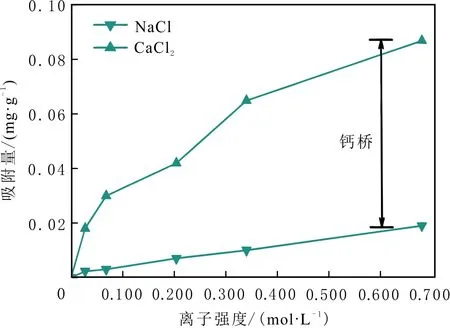
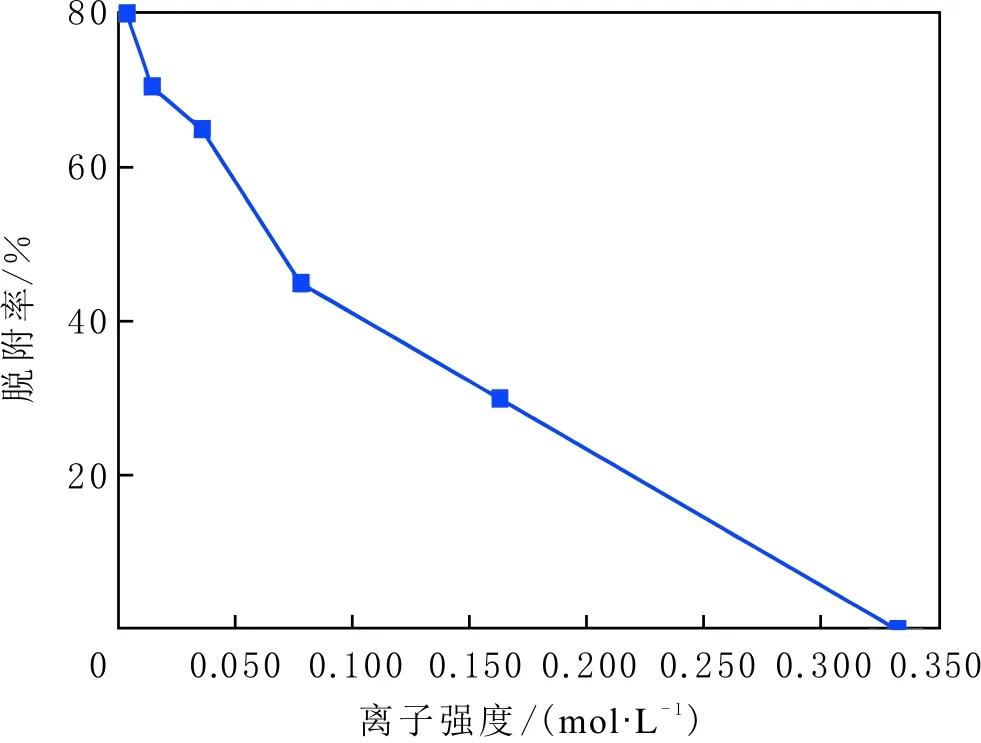
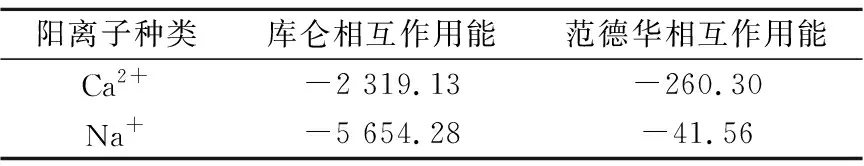
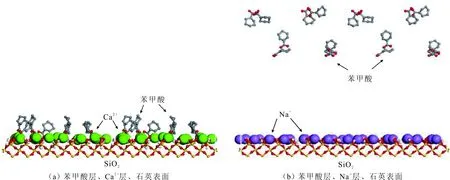
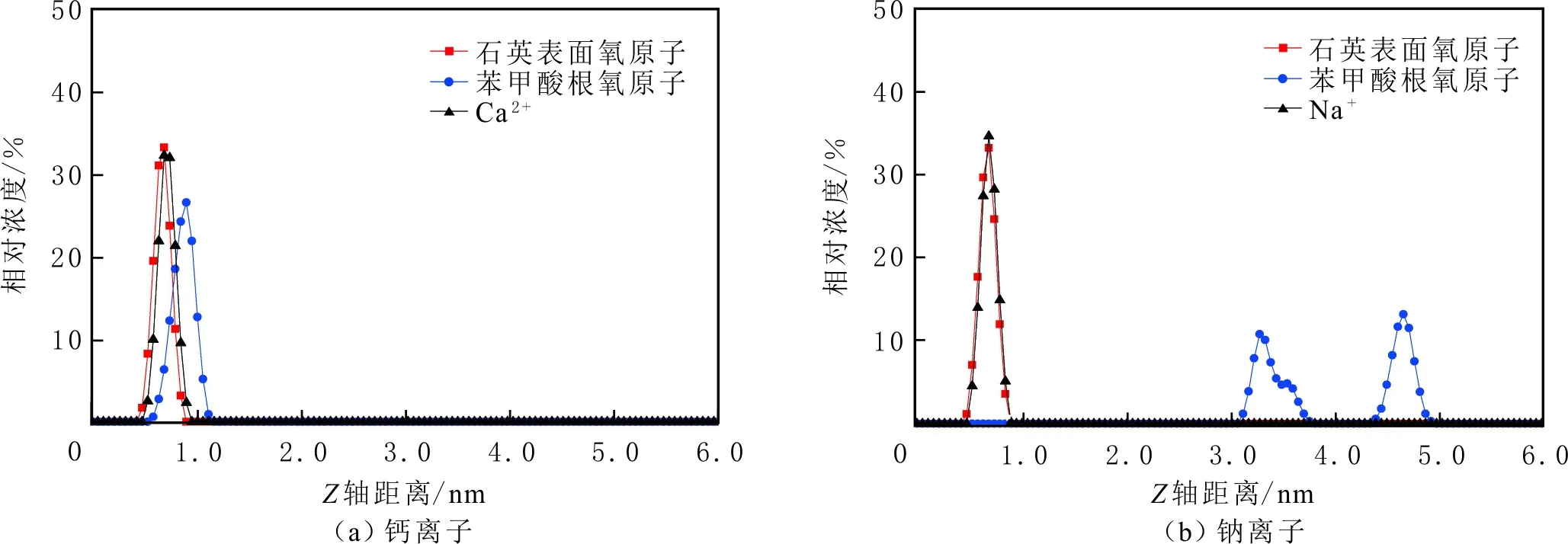
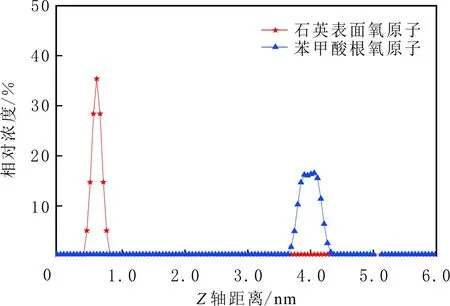
当初始盐水为中性时,Bakken原油中的酸性组分被电离成负电性羧酸根,盐水中的二价阳离子(Ca2+)正电性较强,将负电性羧基与带负电的砂岩表面连起来,使羧基架桥吸附于砂岩矿物表面。羧基另一头为亲油的烃,使砂岩矿物表面的亲水性减弱。当初始盐水中只存在一价阳离子(Na+)时,正电性较小,被电离的羧酸根不能通过一价阳离子(Na+)架桥吸附于砂岩表面,一价阳离子(Na+)不能明显改变砂岩表面的润湿性。因此,岩心Ber4-6的初始润湿性比Ber1-3的亲水性更强。初始水中的二价阳离子(Ca2+)浓度越高,通过二价阳离子(Ca2+)架桥吸附于砂岩矿物表面的羧酸根越多,砂岩矿物表面的亲水性越弱,亲水性Ber1 当自渗吸盐水(NaCl盐水,158.760 g/L)盐度减小至1.587 g/L时,岩心Ber1-3采收率明显提高,分别为9.0%、5.0%、3.0%,而岩心Ber4-6采收率没有明显变化,表明岩心Ber1-3的润湿性发生改变,岩心Ber4-6的润湿性没有明显变化。当自渗吸盐水浓度降低时,砂岩矿物表面吸附的阳离子数量减少,负电性砂岩矿物表面与负电性羧酸根之间静电斥力增大,羧酸根离子由矿物表面脱落,矿物表面的亲水性增强,脱附的羧酸根离子越多,矿物表面的亲水性越强,提高采收率越多(Ber3 低盐水改变砂岩表面润湿性与砂岩表面、极性原油组分的电性,分析原油/盐水、岩石/盐水界面的Zeta电位(见图4-5)。在中性(pH=7)条件下,盐水离子强度减小使石英表面的负电性增强,当CaCl2盐水离子强度为0.676 0 mol/L时,石英表面带弱正电性(+7 mV);随盐水离子强度减小,石英表面由显正电转为带负电,当盐水离子强度进一步减小至0 mol/L时,石英表面的Zeta电位约为-50 mV。对于NaCl盐水,当盐水离子强度为0.676 0 mol/L时,石英表面带负电(约为-10 mV),当盐水离子强度减小至0 mol/L时,石英表面的Zeta电位约为-50 mV。在同离子强度下,石英/NaCl盐水界面的负电性比石英/CaCl2盐水界面的负电性更强。石英表面主要有Si、O元素,在不同pH条件下,两种元素可能与氢元素结合并形成电中性硅醇基团(≡Si—OH)、负电性硅醇基团(≡Si—O—)[30],平衡反应方程式为 ≡Si—OH↔Si—O+H+。 (6) 当水为中性时,式(6)平衡右移,石英表面的电中性硅醇基团(≡Si—OH)中的H被电离,形成裸露的带负电的硅醇基团(≡Si—O—),石英表面显负电。当盐水离子强度较大时,盐水中较多的阳离子通过与砂岩中石英表面带负电的硅醇基团之间的静电引力吸附于砂岩表面,砂岩表面负电性较小(或带较弱的正电);随盐水离子强度减小,砂岩表面吸附的阳离子减少,负电性增强。由于Ca2+正电性强于Na+的,在同离子强度下,砂岩/CaCl2盐水界面的负电性明显弱于砂岩/NaCl盐水界面的。 在中性条件下,当盐水离子强度减小时,原油/盐水界面的负电性增强,当CaCl2盐水离子强度为0.676 0 mol/L时,原油/CaCl2盐水界面的负电性较弱,Zeta电位为-5 mV,随盐水离子强度减小,原油/CaCl2盐水界面的负电性增强,当离子强度减小至0 mol/L(去离子水)时,原油/去离子水界面的Zeta电位为-37 mV。当NaCl盐水离子强度为0.676 0 mol/L时,原油/NaCl盐水界面的Zeta电位约为-19 mV,随盐水离子强度减小,原油/NaCl盐水界面负电性增强,当离子强度减小至0 mol/L时,原油/去离子水界面的Zeta电位为-37 mV。在同离子强度下,原油/NaCl盐水界面的负电性明显强于原油/CaCl2盐水界面的负电性。 图4 盐水中阳离子种类及浓度对石英/盐水界面Zeta电位的影响Fig.4 The effect of cationic type and concentration of brine on Zeta potential of brine/quartz interface 图5 盐水中阳离子种类及浓度对原油/盐水界面Zeta电位的影响Fig.5 The effect of cationic type and concentration of on Zeta potential of crude oil/brine interface 因为原油中除含有不同烃外,还含有不同种类的非烃组分,如在不同pH条件下,石油酸组分中的极性基团发生去质子化,从而改变非烃组分的带电量。在不同pH条件下,将原油中的酸性组分用HA表示,油滴表面的电荷发生变化。酸性化合物(HA)的解离平衡反应式为 HAi+, (7) 式中:A-为酸性化合物解离后的产物;H+为酸性化合物解离后的氢离子。对于高酸值Bakken原油中的酸性组分,当盐水为中性时,式(7)平衡右移,石油酸被电离成带负电的羧酸根。带负电的羧酸根主要聚集于油/水界面,使油/水界面带负电。当盐水矿化度较高时,盐水中较多的阳离子通过与油/水界面的羧酸根之间的静电引力吸附于油/水界面,使油/水界面的负电性减小;随盐水盐度降低,油/水界面吸附的阳离子减少,油/水界面负电性增强。由于二价阳离子Ca2+正电性强于单价阳离子Na+的,在同离子强度下,原油/CaCl2盐水界面的负电性明显弱于原油/NaCl盐水界面的负电性。 图6 盐水中阳离子对苯甲酸在石英表面吸附的影响Fig.6 The effect of cation of brine on adsorption of benzoic acid on quartz 盐水中阳离子对苯甲酸在石英表面吸附的影响见图6。由图6可知,当盐水离子强度为0 mol/L时,苯甲酸几乎不吸附于石英颗粒表面,向盐水中加入二价阳离子(Ca2+)时,阳离子显著影响苯甲酸在石英表面的吸附,且二价阳离子质量浓度越高,苯甲酸在石英表面的吸附越多;当CaCl2盐水离子强度增大至0.676 0 mol/L时,苯甲酸在石英颗粒表面的吸附量达0.090 mg/g。一价阳离子(Na+)对苯甲酸在石英表面吸附的影响不大,当NaCl盐水离子强度高达0.676 0 mol/L时,苯甲酸在石英表面的吸附量不到0.020 mg/g。在同离子强度下,苯甲酸通过二价阳离子吸附于石英表面的量明显高于通过一价阳离子吸附于石英表面的量。 当苯甲酸pKa=4.62[22]时,在碱性条件下,苯甲酸被大量电离成负电性苯甲酸根,石英表面的电中性硅醇基团被电离成负电性硅醇基团(≡Si—O—),当盐水离子强度为0 mol/L时,负电性苯甲酸根与负电性硅醇基团之间存在静电斥力,苯甲酸根不能通过范德华力自行吸附于石英表面。当盐水中存在阳离子时,阳离子吸附在负电性硅醇基团上,减小石英表面与苯甲酸根之间的静电斥力。由于二价阳离子的正电性明显强于一价阳离子的正电性,二价阳离子显著减小苯甲酸层与石英表面之间的静电斥力,苯甲酸根主要通过二价阳离子(Ca2+)架桥吸附于石英表面。 图7 盐水离子强度降低对苯甲酸从石英表面脱附的影响Fig.7 The effect of lowering salinity of brine on desorption of benzoic acid from quartz 盐水离子强度降低对苯甲酸从石英表面脱附的影响见图7。由图7可知,随盐水离子强度减小,苯甲酸逐渐从石英表面脱附,且盐水离子强度越小,脱附的苯甲酸越多,当CaCl2盐水离子强度减小至0.020 0 mol/L时,苯甲酸脱附的量占总吸附量的80%,表明大部分通过二价阳离子吸附于石英表面的苯甲酸发生脱附。因为随盐水离子强度降低,带负电的石英表面与苯甲酸层之间的阳离子减少,两者负电性增强,静电斥力增大,从而导致架桥吸附的苯甲酸根从石英表面脱附。 苯甲酸根只能通过二价阳离子(Ca2+)架桥吸附于石英表面,而不能通过一价阳离子(Na+)架桥或范德华力吸附于石英表面。通过分子模拟计算石英表面、阳离子、苯甲酸体系,以及石英表面、苯甲酸体系作用前后的能量变化,明确吸附过程中的主要作用力;分析体系作用后石英表面的吸附构型,以及最终模型中距离石英表面相关原子的浓度分布,将石英表面的吸附行为在原子尺度上表达出来,从而在微观上为苯甲酸在石英表面的吸附机理提供佐证。 表4苯甲酸层、阳离子层、石英表面的库仑相互作用能及范德华相互作用能 Table4CoulombinteractionenergyandvanderWaalsinteractionbetweenbenzoicacidlayer,cationlayerandquartzsurfacekJ/mol 苯甲酸层、阳离子(Ca2+、Na+)层、石英表面体系的相互作用能计算结果见表4,作用后的构型见图8。由表4可知,作用前后的范德华相互作用能变化较小,库仑相互作用能较大,且远大于范德华相互作用能,说明库仑力对苯甲酸在石英表面的吸附起主要作用。 当石英表面吸附二价阳离子(Ca2+)时,苯甲酸根逐渐靠近石英表面,羧基基团上的氧负离子最终通过二价阳离子(Ca2+)架桥稳定地吸附于石英表面(见图8(a))。当石英表面吸附一价阳离子(Na+)时,苯甲酸根逐渐远离石英表面,最终悬浮于真空层(见图8(b))。 对于苯甲酸层、阳离子层、石英表面作用后的体系,距离石英表面的相关原子/离子的相对浓度分布见图9。由图9可知,Z轴起始点在石英表面下,方向为垂直于石英表面向上(指向苯甲酸层)。若两个原子的Z坐标越近,则两个原子的位置越近。苯甲酸根中氧负离子的峰与二价阳离子(Ca2+)及石英表面裸氧原子的峰基本重合,说明苯甲酸根氧原子与二价阳离子(Ca2+)及石英表面裸氧原子相近。 当石英表面吸附一价阳离子(Na+)时,Na+的峰与石英表面裸氧原子的峰基本重合,说明Na+与石英表面裸氧原子紧紧相连,而苯甲酸根的氧负离子的峰与一价阳离子(Na+)及石英表面裸氧原子的峰没有交集,且相隔很远,说明苯甲酸根的氧负离子与一价阳离子(Na+)及石英表面的裸氧原子相隔很远。 苯甲酸层、石英表面体系作用前后能量变化计算结果显示,两者库仑作用能变化为-17 780.21 kJ/mol,而范德华作用能变化为-159.46 kJ/mol,苯甲酸层、石英表面体系作用前后,范德华相互作用能变化较小,而库仑相互作用能变化较大,远大于范德华相互作用能的,说明库仑力在吸附过程中起主要作用。同时,苯甲酸根层、石英表面体系作用后的构型见图10。由图10可知,当石英表面为苯甲酸根时,苯甲酸根逐渐远离石英表面,最终悬浮在真空层里。 图8 苯甲酸层、阳离子层、石英表面作用后构型Fig.8 The finial configuration of benzoic acid layer, cation layer and quartz surface 图9 石英表面裸氧原子、苯甲酸根氧原子及阳离子沿Z轴方向的分布 苯甲酸层、石英表面体系作用后,距离石英表面的相关原子/离子的相对浓度分布见图11。由图11可知,当石英表面与苯甲酸根作用后,苯甲酸根的氧负离子的峰与石英表面裸氧原子的峰没有重合,并且相隔很远,说明苯甲酸根氧负离子与石英表面裸氧原子相隔较远。 图10 苯甲酸层、石英表面作用后构型Fig.10 The finial configuration of benzoic acid layer and quartz surface 图11 石英表面裸氧原子、苯甲酸根氧原子沿Z轴方向的分布Fig.11 Concentration profile of oxygen atom of quartz surface、oxygen atom of benzoic acid in a Z axis directions 分子模拟结果表明,苯甲酸根只能通过二价阳离子(Ca2+)架桥吸附于石英矿物表面,不能通过一价阳离子(Na+)架桥吸附或范德华力吸附于石英表面。 (1)在中性条件下,原油中的酸性组分和砂岩表面的硅醇基团被电离而带负电,负电性酸组分主要通过盐水中的二价阳离子(Ca2+)架桥吸附于负电性砂岩表面,不能通过一价阳离子(Na+)架桥吸附或范德华力吸附。由于架桥吸附的酸性组分另一端为烃,酸性组分的吸附将使砂岩表面亲水性减弱;当注入水盐度降低时,砂岩表面与酸性组分之间阳离子减少,两者静电斥力增大,酸性组分将发生脱附,砂岩表面亲水性增强。 (2)当阳离子、苯甲酸根、石英体系相互作用后,苯甲酸根、二价阳离子(Ca2+)与石英表面紧紧相连,苯甲酸根与一价阳离子(Na+)及石英表面距离较远。当苯甲酸根单独与石英表面作用后,苯甲酸根与石英表面距离较远,表明酸性组分只能通过二价阳离子架桥吸附于石英表面,不能通过一价阳离子架桥吸附或范德华力吸附。在吸附过程中,体系作用前后范德华相互作用能变化较小,库仑互相作用能变化较大,表明库仑力在吸附过程中起决定性作用。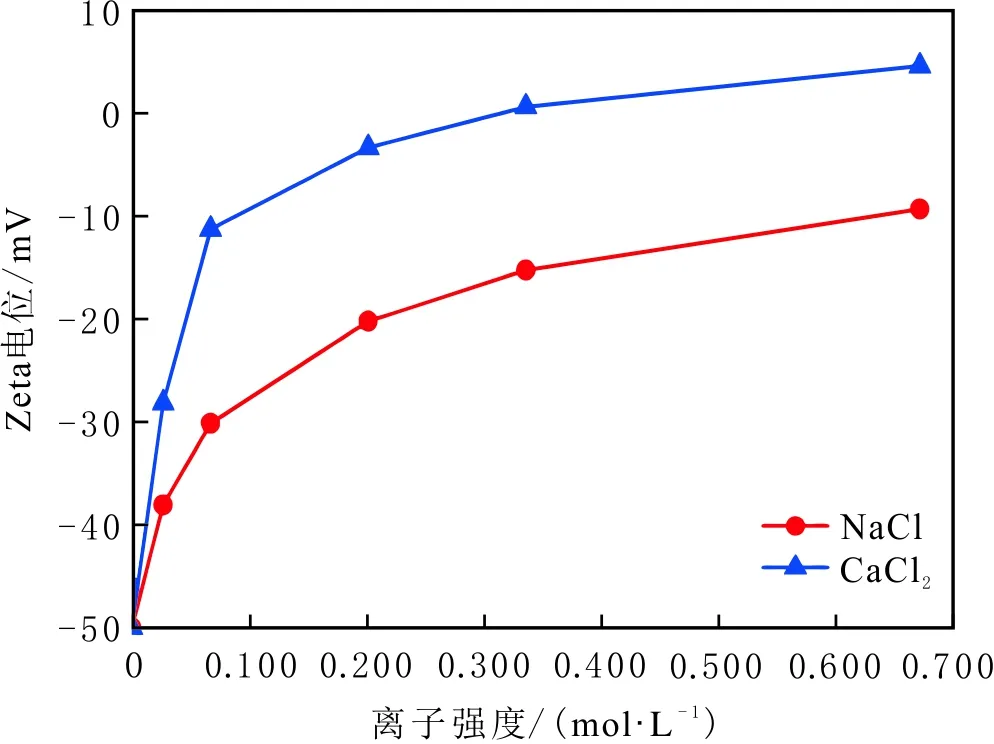
3.2 盐水阳离子种类及浓度对石英吸附极性组分的影响
3.3 阳离子影响酸性组分在石英表面的吸附机理
4 结论

