印加果5个油体蛋白基因的表达特征及序列分析
刘果,谢耀坚,吴志华,陈鸿鹏,彭彦
印加果5个油体蛋白基因的表达特征及序列分析
刘果,谢耀坚,吴志华,陈鸿鹏,彭彦
(国家林业和草原局桉树研究开发中心,广东 湛江 524022)
油体蛋白是植物油体结构组成和功能调节的最主要蛋白质,在种子发育和脂肪酸合成及其累积中发挥重要作用。本研究利用生物信息学手段详细解剖了印加果5个油体蛋白的序列特征,结果表明5个油体蛋白均为高度疏水的碱性小分子非分泌蛋白,存在2至3个跨膜结构与保守油体蛋白功能结构域。通过实时荧光定量PCR技术分析了5个油体蛋白在印加果种子不同发育阶段的表达变化,结果表明5个油体蛋白在印加果种子成熟阶段中特异高效表达,而在种子发育初期和中期阶段微弱表达。这些研究能够为深入研究印加果种子中油脂合成机理、解析油体蛋白功能提供理论基础。
印加果;油体蛋白;实时荧光定量PCR;序列分析
植物脂类物质是植物种子贮藏能量最重要、最有效的方式,在开花植物的种子、花粉和根等多种器官中广泛存在,在植物生长和发育过程中具有重要的作用[1-2],其中脂类物质一般以三酰甘油(Triacylglycerols, TAG)的形式存在。种子中的TAG分子之间彼此分散成许多稳定的小的亚细胞微滴,被称为油体(Oil Body, OB)[3]。根据TZEN等[4]提出的油体结构模型,油体内部为液态TAG,外部由单层磷脂分子(Phospholipids, PL)及油体蛋白(Oleosin)组成的半单元膜,这个半单元膜的基本单位是由13个PL分子和1个Oleosin分子组成。其中PL占油体表面的80%,Oleosin蛋白占20%。
Oleosin是一类特殊的镶嵌在植物油体表面的碱性小分子贮藏蛋白,分子量为15-26 kDa,主要在油料植物种子中特异表达[5]。在芥菜()中最先发现油体蛋白基因的存在,目前已报道了多种植物的油体蛋白基因序列及蛋白序列,如玉米()[6]、蓖麻()[7]、芝麻()[8]、向日葵()[9]、大豆()[10]、油桐()[11]、油茶()[12]、拟南芥()[13]和油菜()[14]等,油体蛋白是油体结构组成和功能调节最主要的蛋白[10],其主要在内质网上合成,由于内质网结合的核糖体负责合成[15]。油体蛋白被认为是酯酶与油体间的结合位点,在种子发芽时期到至关重要的作用,并且油体蛋白能够在空间上阻碍油体分子间相互聚合,对维持油体的稳定性和油体大小极为重要[16]。Oleosin蛋白在被子植物中常以基因家族的形式存在[17]。不同来源的油体蛋白均具有3个结构域,即N端两性(兼亲水性和亲脂性)区、中间高度疏水区和C端α-螺旋结构域[18]。中间疏水区存在一个由12个氨基酸组成的极为保守的脯氨酸结(Proknot,-PX5SPX3P-),可形成发卡结构使油体蛋白能够渗入到油体的磷脂单分子层中,并且油体蛋白之间可能通过该区域互相结合,在蛋白质折叠加工过程中起至关重要的作用[19]。
印加果(),印加语称Sacha Inchi,又称星油藤、南美油藤、印加花生,是大戟科(Euphorbiaceae)多年生木质藤本植物[20]。原生长在海拔200 ~ 1 700 m的南美洲安第斯(Andres)山脉地区热带雨林,被当地土著居民食用了3 000多年[21]。印加果种子油中含有大量不饱和脂肪酸,约占脂肪含量的81.18% ~ 92.46%[22],其中具有调节血脂、预防心血管疾病等作用的亚麻酸和用于治疗高血脂和动脉硬化等症的亚油酸二者含量高达80%以上[23-24],同时印加果油中还含有生育酚、甾醇、多酚等脂质活性物质[25],被认为是世界上最好的植物油之一。因此,为深入研究开发和利用印加果种子油的经济价值和市场潜力,本研究通过前期构建的印加果种子不同生长时期的cDNA文库获得印加果油体蛋白基因的5个转录本,对其蛋白序列进行特征解析,并对其在不同生长时期的种子中的表达情况进行了分析,为进一步揭示印加果种子油脂合成机理、油脂合成的关键酶基因的功能提供有效的参考。
1 材料与方法
1.1 试验材料
印加果种子采集于广东省湛江市遂溪县南方国家级林木种苗示范基地的印加果种子园(N21°30′,E111°38′),降雨量1 567 mm,年平均气温23.1℃,平均海拔约90 m。根据印加果种子油中各种脂肪酸含量的变化规律,对印加果种子的5个生长阶段(分别为种子形成阶段SI-1、种子发育初期阶段SI-2、种子发育中期阶段SI-3、种子发育中后期阶段SI-4和种子成熟阶段SI-5)进行样品采集。果实采摘后即刻剥去果皮,将种子置于液氮中速冻,保存于-80℃备用。
1.2 研究方法
1.2.1 印加果Oleosin基因cDNA序列
根据本研究前期构建的印加果种子5个不同生长阶段的cDNA文库,使用组装软件Trinity对所有短Reads进行重新组装,通过reads overlap关系得到不含N的44 797个转录本(Unigene)。通过Blastx将Unigene序列比对到蛋白数据库Nr、SwissProt、KEGG 和 KOG(evalue<10-5),得到跟给定 Unigene 具有最高序列相似性的蛋白,从而得到该 Unigene 的蛋白功能注释信息。根据注释结果得到5个Oleosin基因,分别为Unigene0002468、 Unigene0004438、Unigene0020334、Unigene0010027和Unigene0035658。
1.2.2 RNA提取及逆转录
将-80℃中保存的印加果种子迅速取出,去除种皮后将种仁置于液氮中快速研磨,利用TRNzol总RNA提取试剂盒进行总RNA提取,纯化后使用NanoDrop 2000核酸蛋白测定仪和RNase free凝胶电泳进行RNA质量进行检测。每个生长阶段的印加果种子设置3个生物学重复。取2μgRNA,使用FastQuant RT Kit(with gDNase)逆转录试剂盒获得高质量的cDNA。
1.2.3 实时荧光定量PCR法
本研究将5个Oleosin基因作为验证基因,其qRT-PCR引物序列、Tm值以及扩增产物片段大小如表1所示。选用在印加果种子整个生长发育过程中稳定表达的Actin基因(Unigene0026056)作为内参基因,对验证基因的表达水平进行qPCR扩增,每个反应重复3次。20 μl实时荧光定量PCR扩增体系中cDNA模板4 μl,qPCR Master Mix 10 μl,前后向特异引物(10μM)各0.4 μl。PCR扩增条件为95℃ 90 s预变性后,95℃变性5 s,60℃复性15 s,共40个循环,同时对实时荧光定量PCR产物进行SYBR溶解曲线分析,并采用△△Ct(comparative cycle threshold)的方法计算基因的相对表达量,其中△△Ct=(待测组目的基因的Ct值-待测组管家基因的Ct值)-(对照组目的基因的Ct值-对照组管家基因的Ct值)[26]。

表1 5个Oleosin基因及1个内参基因的引物信息表
1.2.4 生物信息学分析
利用NCBI BlastP程序对推导的氨基酸序列进行同源性搜索和比较;通过在线软件线ExPASyProtParam程序分析对各种氨基酸含量、蛋白质等电点、分子量及稳定性进行预测;根据NCBI Conserved Domain Search对蛋白功能域进行分析;使用在线软件Siganal V4.0、Proscale和TMHMM分别检测蛋白质信号肽、亲水/疏水特性和跨膜结构;利用SOPMA程序预测蛋白质二级结构;利用在线软件Swiss_model预测蛋白质三级结构;根据利用MEGA软件构建最大似然法(ML, Maximum Likelihood)系统发育树。
2 结果与分析
2.1 印加果5个Oleosin蛋白的序列分析
从印加果种子总cDNA文库中获得的Oleosin转录本数据可知,5个转录本(Unigene0002468、Unigene0004438、Unigene0020334、Unigene0010027和Unigene0035658)序列长度分别为725 bp、688 bp、1 270 bp、1 271 bp和766 bp,各片段长度均大于各基因预计扩增片段大小,这是由于cDNA序列覆盖了基因的非编码区和内含子序列。如Unigene0010027的cDNA全长1 270 bp,包括38 bp 5’末端非编码区(5’UTR)、432 bp完整开放阅读区、455 bp内含子区、222 bp完整开放阅读区和125 bp 3’末端非翻译区(3’UTR)。
通过NCBI网站Blastp工具对5个印加果Oleosin蛋白进行相似性搜索分析(图1),结果表明5个蛋白均包含一个的保守区域“Oleosin domin”,均属于油质蛋白Oleosin超家族蛋白之一。

图1 印加果5个Oleosin蛋白序列在NCBI中Blastp分析结果
根据5条Oleosin蛋白序列及其他物种Oleosin蛋白序列的BlastP比对结果(图2)分析发现,23条Oleosin蛋白序列的N端和C端氨基酸序列具有较大差异性,而中间氨基酸区域具有较高保守性,尤其是由3个脯氨酸和1个丝氨酸组成的脯氨酸结高度保守结构域(图中黑色框标出),即-PX5SPX3P-模体,为植物油体蛋白基因序列的标志性结构特征[19]。

图2 5个Oleosin蛋白序列与其他物种Oleosin蛋白序列的比对结果
注:1: Unigene0002468; 2: Unigene0004438; 3: Unigene0010027; 4: Unigene0020334; 5: Unigene0035658; 6: 麻疯树14.3kDa oleosin; 7: 橡胶树oleosin1; 8: 麻疯树oleosin1; 9: 川桑oleosin1; 10: 蓖麻oleosin1; 11: 番木瓜oleosin1-like; 12: 麻疯树oleosin1-like; 13: 麻疯树oleosin3; 14: 毛果杨16.4 kDa-like oleosin; 15: 橡胶树16.4 kDa-like oleosin; 16: 木薯16.4 kDa-like oleosin; 17: 麻疯树18.2kDa-like oleosin; 18: 木薯18.2kDa-like oleosin; 19: 油桐oleosin Ⅰ; 20: 印加果oleosin1; 21: 印加果oleosin2; 22: 印加果oleosin3; 23: 胡杨18.2kDa-like oleosin
通过在线软件线ExPASyProtParam(http://web.expasy.org/protparam/)程序分析对各种氨基酸含量、蛋白质等电点、分子量及稳定性进行预测的结果显示,印加果5个Oleosin蛋白的不稳定系数(Instability index)值分别为29.30, 36.96, 28.74, 25.11和31.43,说明5个蛋白均属于较稳定的蛋白质。5个Oleosin蛋白的等电点和相对分子质量表明,印加果5个Oleosin蛋白均为碱性小分子量蛋白。根据综合计算所得到的5个蛋白信号肽存在的可能性值可知,5个Oleosin蛋白不存在信号肽序列,均为非分泌性蛋白。

表2 5个Oleosin蛋白的理化性质参数
蛋白跨膜结构域预测结果表明,印加果5个Oleosin蛋白分别含有2至3个跨膜螺旋结构域。从图3可知,5个Oleosin蛋白两端均表现为亲水性,而中间则均为一个较大的疏水区,这与油桐等植物的oleosin蛋白的分析结果一致[18]。

图3 印加果Oleosin蛋白疏水性预测
注:Score为负值表示亲水,Score为正值表示疏水。
用软件SOPMA在线软件对5个印加果Oleosin蛋白质的二级结构进行预测,其结果见图4。由图4可知,5个Oleosin蛋白的二级结构均由α螺旋,延伸链,β转角和无规则卷曲4种状态构成,这与麻疯树油体蛋白14.3的二级结构的组成一致[27]。5个Oleosin蛋白的N末端主要以α螺旋、β转角为主,C端以无规则卷曲和α螺旋为主,中部则以延伸链为主。
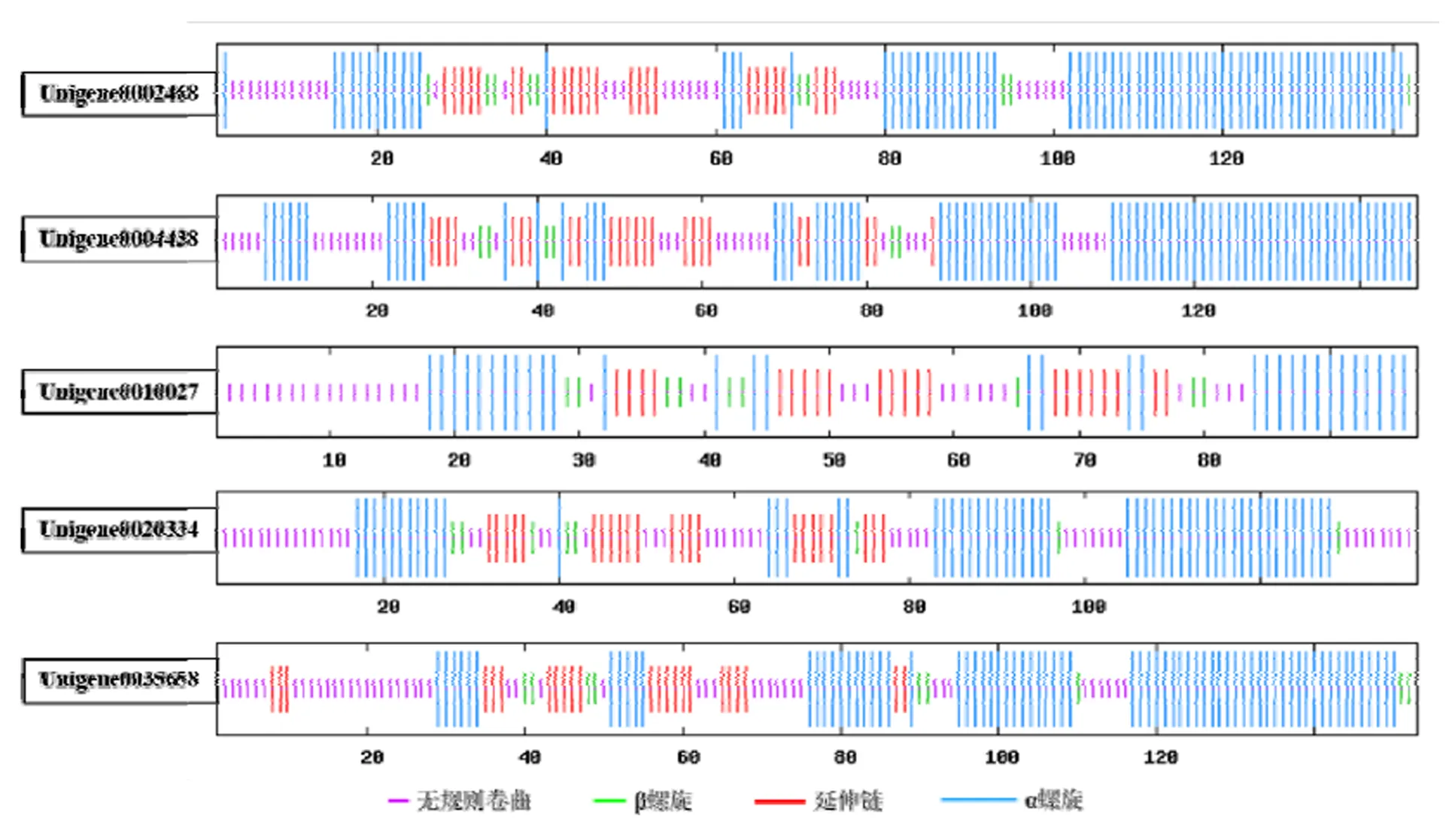
图4 印加果Oleosin蛋白的二级结构预测
2.2 5个Oleosin编码基因转录本在印加果种子不同生长时期的表达分析
实时荧光定量PCR选用在印加果种子不同生长阶段中稳定表达的Actin基因(Unigene0026056)作为内参基因。根据5个基因的序列及其开放阅读区(ORF)区域外侧分别设计特异性引物(表1),取质量较高的RNA为模板建立20 μL反应体系进行反转录得到cDNA,以cDNA进行荧光定量PCR,获得5个Oleosin基因在印加果种子不同生长阶段样品中的时空表达特性。
作为油体的主要结构和功能蛋白,油体蛋白基因在种子发育过程中高度表达[28]。对5个Oleosin基因进行实时荧光定量分析的结果表明(图5),5个Oleosin基因均在印加果整个生长过程中表现为基因上调,且SI-5阶段即种子成熟阶段表达量非常高,而种子处于快速生长阶段(SI-2和SI-3阶段)的表达量则偏低。表达差异倍数分析中,以SI-1阶段的表达量作为对照(表达倍数为1),其中Unigene0010027在SI-5阶段的表达倍数高达52 103.28,即该基因在SI-5阶段上调表达且表达量超高,而在SI-2和SI-3阶段的表达倍数低至0.03,即该基因在SI-2和SI-3阶段表达量偏低。

图5 印加果种子5个Oleosin基因在不同生长阶段的相对表达变化
2.3 印加果油体蛋白与其他物种的同源性分析
为探明印加果Oleosin基因与其他植物Oleosin基因间的遗传关系,本研究对麻疯树、橡胶树、川桑、蓖麻、番木瓜、毛果杨、木薯、油桐、印加果和胡杨等10种植物18条Oleosin蛋白序列进行最大似然法系统发育树构建。结果显示,23条Oleosin蛋白序列分为2个类群,GroupⅠ和GroupⅡ(图6)。GroupⅠ类群包括Oleosin1、Oleosin3等14个Oleosin蛋白,其中,Unigene002468和印加果Oleosin1蛋白序列最相近,Unigene0010027和印加果Oleosin3蛋白序列相似性最高,Unigene0020334和油桐OleosinⅠ蛋白序列相似度最高。GroupⅡ类群包括Oleosin 16.4kDa-like、Oleosin 18.2kDa-like和Oleosin2等9个Oleosin蛋白,其中,Unigene0004438和印加果Oleosin2蛋白序列相似度最高,Unigene0035658和木薯Oleosin 18.2kDa-like蛋白序列相似度最高。根据蛋白序列相似度推断,Unigene0002468为蛋白Oleosin1,Unigene0004438为蛋白Oleosin2,Unigene0010027为蛋白Oleosin3,Unigene0020334为蛋白OleosinⅠ,Unigene0035658为蛋白Oleosin 18.2kDa-like。

图6 印加果5个Oleosin蛋白与其他植物Oleosin的同源性分析
4 结论与讨论
Oleosin蛋白广泛存在于各种植物中。这类蛋白主要存在于油体表面,对油体形成及其稳定性具有非常重要的作用[1],并且Oleosin基因的表达对油脂积累及脂肪酸成分有显著的影响。本研究对印加果5个Oleosin蛋白的序列特征及在不同生长阶段的表达特征进行分析,为研究印加果种子中油脂合成机理和解析Oleosin蛋白功能提供理论基础。
Oleosin蛋白为一个超家族蛋白,其基因常以基因家族形式存在。本研究对印加果5个Oleosin蛋白的氨基酸序列进行了分析和比对,并对蛋白质的等电点、分子量、跨膜结构、信号肽位点、疏水性和二级结构等特征进行了分析和预测。结果表明,印加果5个Oleosin蛋白均为高度疏水的碱性小分子蛋白,且存在2至3个跨膜结构,不存在信号肽剪切位点,均为非分泌蛋白;且5个蛋白的N末端均以α螺旋和β转角为主,C端以无规则卷曲和α螺旋为主,中部则以延伸链为主。这与其他植物油质蛋白的结构特征基因一致[17-18,27]。
本研究进一步对5个Oleosin基因在印加果种子5个发育阶段中的表达表明,5个Oleosin基因均在种子成熟阶段(SI-5)超高量表达,且在种子发育初期和中期(SI-2,SI-3)的表达量偏低。根据本研究组对印加果种子发育过程中脂肪酸组分的变化分析可知,不饱和脂肪酸组分主要在种子成熟阶段急剧增加,由此推断,Oleosin基因在印加果种子成熟期的超高表达可能与不饱和脂肪酸的快速累积相关。
[1] 张菊,乔琳,胡利宗,等.麻疯树油质蛋白家族基因的鉴定与进化分析[J].分子植物育种,2016,14(5):1123-1132.
[2] WANG X M, Lipid signaling[J]. Current Opinion in Plant Biology, 2004, 7(3):329-336
[3] HUANG A H C. Oil bodies and oleosins in seeds[J]. Annual Review of Plant Biology,1992, 43:177-200.
[4] TZEN J T C, CAO Y Z, LAUREN P, et al.Lipids, proteins, and structure of seed oil bodies from diverse species [J].Plant Physiology, 1993,101(1): 267-276.
[5] 范乾程,谭玲玲,王亚,等.花粉管通道法验证花生Oleosin基因启动子的特异性表达[J].中国粮油学报,2013,28(12):52-56.
[6] ALEXADROV N N,BROVER V V,FREIDIN S,et al.Insights into corn genes derived from large-scale cDNA sequencing[J].Plant Molecular Biology,2009,69(1/2):179-194.
[7] EASTMOND P J.Cloning and characterization of the acid lipase from castor beans[J].Journal of Biology Chemistry,2004,279(44):45540-45544.
[8] TAI S S, CHEN M C M,PENG C C,et al.Gene family of oleosin isoforms and their structural stabilization in sesame seed oil bodies[J].Bioscience Biotechnology and Biochemistry,2002,66(10):2146-53.
[9] ALEXANDER L G, SESSIONS R B, CLARKE A R, et al. Characterization and modelling of the hydrophobic domain of a sunflower oleosin[J].Planta,2002,214(4):546-551.
[10] XU M Y, LIU D H, LI G Q. Cloning of soybean 24kD oleosin gene and its transient expression as a carrier for foreign protein[J].Agricultural Sciences in China, 2004, 3(5): 321-329.
[11] 吴庆珂,杨素素,汪阳东,等.油桐油质蛋白Oleosin编码基因5个VfOLE转录本的克隆与表达分析[J].林业科学研究, 2014,27(2):233-239.
[12] 曾艳玲,曾晓峰,谭晓风,等.利用油茶油体蛋白系统表达金属硫蛋白的载体构建[J].经济林研究,2014,32(4):33-37.
[13] MIQUEL M,TRIGUI G,D'ANDEA S, et al. Specialization of oleosins in oil body dynamics during seed development in Arabidopsis seeds[J]. Plant Physiology,2014, 164(4):1866-1878.
[14] KEDDIE J S, EDWARDS E W, GIBBONS T, et al. Sequence of an oleosin cDNA from Brassica napus[J]. Plant Molecular Biology, 1992,19(6):1079-1083.
[15] BEAUDOI N F, LACEY D J, NAPIER J A.The biogenesis of the plant seed oil body: oleosin protein is synthesised by ER-bound ribosomes[J].Plant Physiology and Biochemistry, 1999, 37(6): 481-490.
[16] JIANG P L, WANG C S, HSU C M, et alStable oil bodies sheltered by a unique oleosin in lily pollen[J]. Plant Cell Physiology, 2007,48(6):812–821.
[17] 李爱芹,赵传志,王兴军,等.花生油体蛋白家族基因的克隆和表达分析[J].农业生物技术学报,2011,19(6): 1003-1010.
[18] 龙红旭,谭晓风,陈洪,等.油桐油体蛋白基因的克隆及序列分析[J].中南林业科技大学学报,2010,30(4):31-38.
[19] 眭顺照,祝钦泷,郑丽,等.植物蛋白oleosin及其在植物基因工程中的应用[J].中国生物工程杂志,2003,23(6):17-21.
[20] 刘果,陈鸿鹏,彭彦,等.印加果种子生长发育过程中脂肪酸组成的变化分析[J].中国油脂,2018,43(8):57-62.
[21] 蔡志全.特种木本油料作物星油藤的研究进展[J].中国油脂,2011,36(10):1-6.
[22] CHANDRASEKARAN U,LIU A.Z.Stage-specific metabolization of triacylglycerols during seed germination of sacha inchi(L.) [J].Journal of the Science of Food and Agriculture, 2015, 95(8):1764-1766.
[23] MALCICKA M,VISSER B,ELLERS J.An Evolutionary perspective on linoleic acid synthesis in animals[J]. Evolutionary Biology, 2018, 45(1):15-26.
[24] FANALI C, DUGO L, CACCIOLA F, et al. Chemical composition of sacha inchi (L.) seeds and characteristics of their lipid fraction[J].Grasas Aceites, 2011, 621(1):76–83.
[25] CHIRINOS R, ZULOETA G, ROMINA P, et al.Sacha inchi (): A seed of polyunsaturated fatty acids, tocopherols, phytosterols,phenolic compounds and antioxidant capacity[J].Food Chemistry, 2013,141(3): 1732-1739.
[26] SCHMITTGEN T D, LIVAK K J.Analyzing real-time PCR data by the comparative CT method[J].Nature Protocals,2008,3(6): 1101-1108.
[27] 宋健,熊宏,余进德,等.麻疯树油质蛋白JcOle14.3基因克隆及序列分析[J].中南林业科技大学学报,2016,36(6):15-22.
[28] WU Q K, YANG S S, WANG Y D, et al. Isolation and expression analysis onoleosin gene of five VfOLE isoforms[J]. Forest Research, 2014, 27(2):233-239.
Expression and Sequences Analysis on Five Sacha Inchi () Oleosin Genes
LIU Guo, XIE Yaojian, WU Zhihua, CHEN Hongpeng, PENG Yan
()
Oleosin protein, as the main structural protein of oil body, is responsible for its functional modification. Oleosin plays an important role in the process of seeds growth and fatty acid synthesis and accumulation. Five oleosin proteins in sacha inchi seeds were analyzed, using a bioinformatics method, and sequence analyses indicated that these five proteins are all highly hydrophobic, small molecular weight and non-secretory proteins. Also, they all had the same conservative functional domain with two to three types of transmembrane structure. A real-time fluorescence quantitative PCR method was employed to identify the expression mode of the genes producing these five oleosins during the growth of sacha inchi seed. The results showed that the five oleosin genes were all super expressed exclusively at the mature stage but had much lower levels of expression at the middle and late stages of sacha inchi seed development. These results help to further understand the mechanisms of fatty acid synthesis and biological functions of oleosin proteins in sacha inchi seeds.
sacha inchi; oleosin; real-time fluorescence quantitative PCR; sequence analysis
Q946.1
A
中央级公益性科研院所基本科研业务费专项资金(CAFYBB2016QA018)。
刘果(1987— ),女,博士,助理研究员,主要从事林木分子遗传学研究,E-mail: liuguopz@163.com.

