肝细胞癌患者血清中SOX 1和VIM启动子的甲基化检测及其临床意义
张良,周进学,肖腾#,向宏市
1郑州颐和医院普外科,郑州450000
2河南省肿瘤医院普外科,郑州4500000
肝细胞癌(hepatocellular carcinoma,HCC)占原 发性肝癌的90%以上,是中国较常见的恶性肿瘤之一[1]。早期诊断是HCC治疗的先决条件[2]。临床上,HCC的检测主要基于血清甲胎蛋白(α-fetoprotein,AFP)、病变活检及各种成像技术。然而,这些HCC监测和诊断技术仍存在一些限制[3]。因此,新生物标志物的探究对于改善早期HCC的诊断具有十分重要的临床意义。肿瘤患者血液中循环肿瘤细胞游离DNA(circulating tumor DNA,ctDNA)作为生物标志物,已广泛用于预测风险、诊断疾病和预测预后。表观遗传学的改变在人类肿瘤的发生、进展中起着重要作用。肿瘤中最常见的表观遗传变化为基因启动子区域中的异常DNA甲基化,可导致肿瘤抑制基因的沉默。相关研究证实,DNA甲基化改变可作为肿瘤的生物标志物用于早期检测包括HCC在内的多种肿瘤。血清性别决定区域Y框蛋白1(sex-determining region Y-box protein 1,SOX1)和波形蛋白(vimentin,VⅠM)基因启动子甲基化可能是卵巢癌和结直肠癌的潜在预测生物标志物,且已在HCC组织中检测到SOX1基因和VIM基因的异常甲基化。然而,HCC患者血清中SOX1基因和VIM基因启动子甲基化作用尚不清楚。因此,本研究对HCC患者血清SOX1基因和VIM基因启动子甲基化状态进行评估,以探究其作为生物标志物用于诊断HCC的潜在价值,现报道如下。
1 对象与方法
1.1 研究对象
选取2015年1月至2016年6月于郑州颐和医院和河南省肿瘤医院确诊的HCC患者60例作为研究组(HCC组)。所有HCC患者术前均未进行抗肿瘤等其他治疗,且均经术后病理学检查确诊为HCC,血清乙型肝炎表面抗原(hepatitis B surface antigen,HbsAg)均呈阳性。其中男性36例,女性24例;年龄30~70岁,平均(49.29±13.71)岁;临床分期根据《原发性肝癌的临床诊断与分期标准》[4]:Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期36例;分化程度:高分化18例,中分化17例,低分化25例;无包膜侵犯32例,有包膜侵犯28例;伴转移(包括肝门淋巴结转移、肝外转移)25例,不伴转移35例;伴肝硬化41例,不伴肝硬化19例;术前检测AFP≥20 μg/L记为阳性:阳性42例,阴性18例。选取同期于郑州颐和医院和河南省肿瘤医院治疗的乙型肝炎后肝硬化(liver cirrhosis,LC)患者50例(LC组)、慢性乙型病毒性肝炎(chronic viral hepatitis type B,CHB)患者50例(CHB组)作为疾病对照组,诊断均符合2015年版《慢性乙型肝炎防治指南》[5],排除乙型肝炎病毒/丙型肝炎病毒重叠感染和人类免疫缺陷病毒混合感染者。另外,选取同期于郑州颐和医院和河南省肿瘤医院体检的健康体检者50例作为健康对照组(Control组),排除患其他肝脏疾病及其他重要躯体疾病的患者。4组研究对象的年龄、性别等基线资料比较,差异均无统计学意义(P>0.05),具有可比性(表1)。本研究经医院伦理委员会批准通过,所有对象均对本研究知情同意并签署知情同意书。

表1 4组对象的基线资料
1.2 方法
1.2.1 标本采集和DNA提取 采集所有患者治疗前及健康体检者的清晨空腹外周静脉血8 ml,置于EDTA抗凝管中,3000 r/min离心10 min后,分离血清。采用血清游离DNA提取试剂盒,根据试剂盒说明书进行相关操作提取DNA,将血清DNA洗脱并于-20℃保存。
1.2.2 DNA亚硫酸盐修饰 采用EpiTect Bisulfite Kit试剂盒,根据试剂盒说明书对DNA进行相关操作。取血清 DNA 2 μg 加入 4 mol/L NaOH,调整DNA终浓度为0.2 mol/L,于37℃变性10 min。加入30 mol/L NaHSO3,于50℃水浴16 h,经DNA纯化试剂盒修饰后,于室温下加入4 mol/L NaOH,调整DNA终浓度为0.3 mol/L,静置20 min脱硫。加入1/10体积乙酸钠和冰乙醇使DNA沉淀,干燥后加入TE(pH=8.0)溶解。将修饰的DNA作为甲基化特异性聚合酶链反应(methylmion specific polymerase chain reaction,MSP)模板,于-20℃储存。
1.2.3 MSPMSP引物序列由上海生工生物工程有限公司合成(表2)。采用25 μl聚合酶链反应(polymerase chain reaction,PCR)反应体系:Premix Taq 12.5 μl,ddH2O 10.5 μl,正向引物和反向引物各0.5 μl、亚硫酸盐修饰的DNA 1 μl。在ABⅠ7500型PCR仪上进行扩增,第一轮PCR反应条件:95℃预变性5 min;95℃变性30 s,58℃退火40 s,72℃引物延伸40 s,共进行40个循环;72℃延伸10 min。将第一轮PCR产物稀释50倍后,取1 μl进行第二轮PCR反应,PCR反应条件:95℃预变性5 min;95℃变性30 s,65℃退火40 s,72℃引物延伸40 s,共进行40个循环;72℃延伸10 min,产物4℃保存。以人HCC细胞系(HepG2细胞,中科院上海细胞库)DNA作为阳性对照(PC),以健康者外周血淋巴细胞DNA作为阴性对照(NC),以H2O代替DNA作为空白对照(Blank)。取7 μl PCR扩增产物于2%琼脂糖凝胶上进行电泳,采用JS-3000凝胶成像系统分析仪采集图像。

表2 甲基化特异性聚合酶链反应引物序列
1.3 判定标准
甲基化引物扩增出条带,或者甲基化与非甲基化引物均扩增出条带,则血清SOX1基因或VIM基因启动子甲基化阳性;甲基化引物未扩增出条带而非甲基化引物扩增出现条带,则血清SOX1基因或VIM基因启动子甲基化阴性。
1.4 统计学分析
采用SPSS 20.0-软件对数据进行分析。计量资料以均数±标准差(x±s)表示,组间比较采用F检验或t检验;计数资料以率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血清中SOX 1、VIM基因启动子甲基化检测结果
4组对象的SOX1、VIM基因启动子甲基化阳性率比较,差异均有统计学意义(P<0.01);其中HCC组患者的血清SOX1、VIM基因启动子甲基化阳性率均高于LC组、CHB组和Control组,差异均有统计学意义(P<0.05);LC组和CHB组患者的血清SOX1、VIM基因启动子甲基化阳性率均高于Control组,差异均有统计学意义(P<0.05);LC组患者的血清SOX1、VIM基因启动子甲基化阳性率均高于CHB组,但差异均无统计学意义(P>0.05)。(表3)

表3 不同组别血清SOX 1、VIM基因启动子甲基化阳性率的比较[ n(%)]
2.2 SOX 1、VIM基因启动子甲基化状态与HCC患者临床特征的关系
不同包膜侵犯程度、分化程度、TNM分期、远处转移情况HCC患者的血清SOX1基因启动子甲基化状态比较,差异均有统计学意义(χ2=7.641,P=0.006;χ2=8.871,P=0.012;χ2=7.797,P=0.005;χ2=7.636,P=0.006);但不同年龄、性别、肿瘤直径、AFP水平、肝硬化、门静脉癌栓HCC患者的血清SOX1基因启动子甲基化状态比较,差异均无统计学意义(P>0.05)。不同分化程度、TNM分期、远处转移情况HCC患者的血清VIM基因启动子甲基化状态比较,差异均有统计学意义(χ2=12.967,P=0.002;χ2=5.926,P=0.015;χ2=10.080,P=0.001);但不同年龄、性别、肿瘤直径、AFP水平、肝硬化、门静脉癌栓、包膜侵犯程度HCC患者的血清VIM基因启动子甲基化状态比较,差异均无统计学意义(P>0.05)。(表 4)
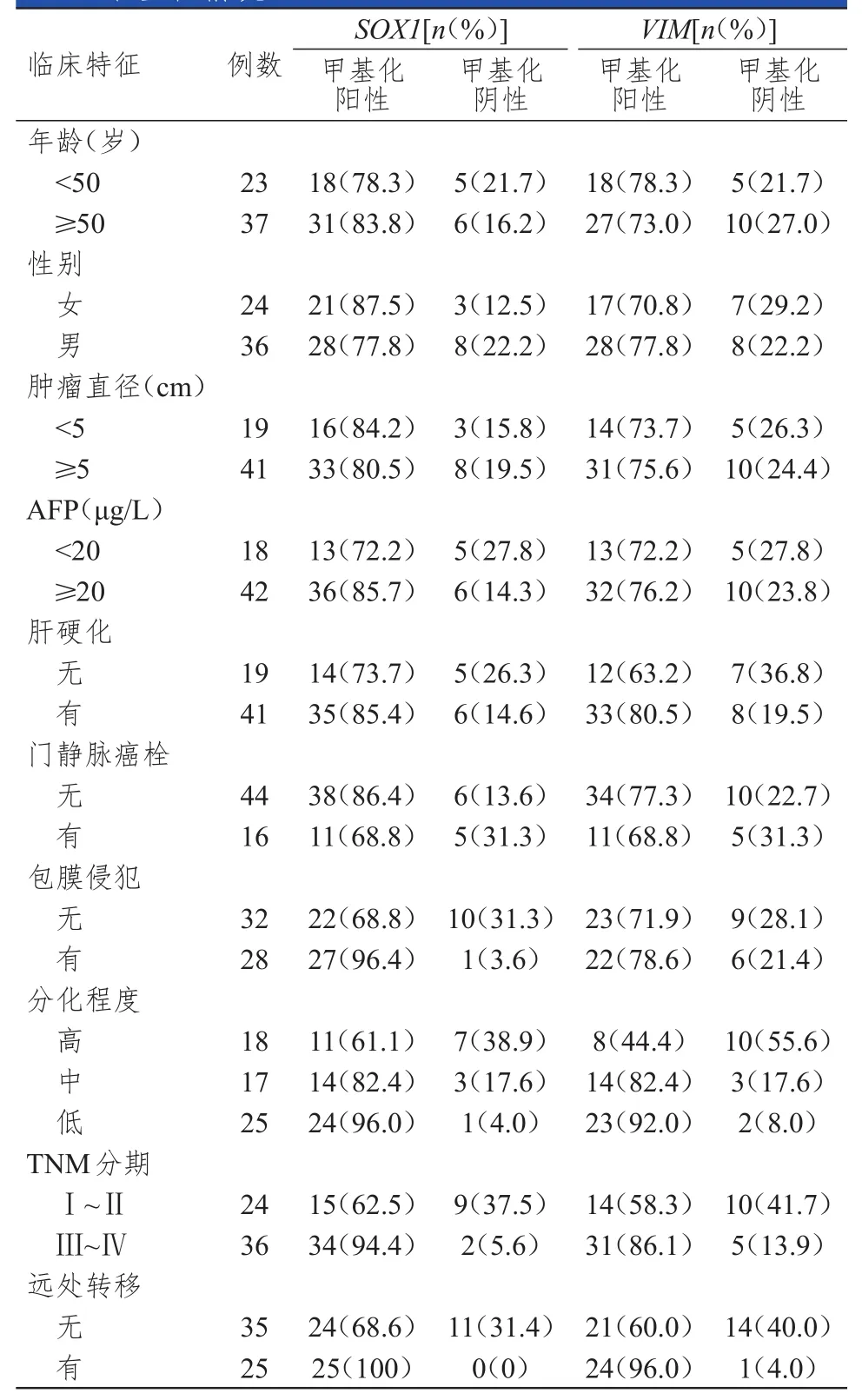
表4 不同临床特征HCC患者血清SOX 1、VIM基因启动子甲基化情况( n=60)
3 讨论
肿瘤发生不同阶段的CpG岛异常高甲基化是导致肿瘤抑制基因(tumor suppressor gene,TSG)功能障碍的重要原因。基因启动子的超甲基化可以是早期或晚期事件中HCC的标志物[6]。多种血清DNA的异常甲基化已被证实可作为评估HCC风险的生物标志物,如血清Ras相关区域家族1A(Ras association domain family 1A,RASSF1A)、谷胱甘肽S转移酶P1(glutathione S-transferase P1,GSTP1)、活化蛋白C(activator protein C,APC)等[7-8]。既往研究已在HCC组织中检测到SOX1和VⅠM的异常甲基化[9-10]。本研究证实,在HCC、LC、CHB患者血清中均可以检测到SOX1基因和VIM基因启动子甲基化。既往研究表明,慢性肝炎-肝硬化-HCC是一个持续发展的过程[11]。本研究中发现,HCC患者血清中SOX1基因和VIM基因启动子甲基化阳性率高于LC患者和CHB患者,且而LC、CHB患者的血清SOX1基因和VIM基因启动子甲基化阳性率高于Control组患者,这种趋势可能对疾病的进展具有一定预测价值。
SOX1是SRY盒(SOX)蛋白家族成员之一,是编码参与调控胚胎发育和细胞命运的决定性转录因子。研究发现,SOX1的组成型过表达可以抑制HCC细胞系的增殖、集落形成和侵袭能力,且SOX1敲减可以部分恢复这些功能,提示SOX1是HCC的重要肿瘤抑制因子[12]。另外,还有研究发现,SOX1的异位表达可以通过干扰Wnt/β-连环蛋白信号转导而抑制HCC生长。已有研究证实,SOX1的异常甲基化与子宫颈癌和非小细胞肺癌相关[13-14]。另外有研究报道,在HCC组织中,SOX1表达下调与启动子甲基化之间存在负相关[15]。VIM基因编码波形蛋白,其在维持细胞形态、稳定细胞骨架等多种过程中起重要作用。VⅠM也参与细胞迁移和信号转导。此外,既往研究表明,VⅠM参与上皮-间质转化过程(EMT),而EMT是恶性肿瘤细胞侵袭和转移的关键途径。另外,研究发现,VIM基因启动子异常甲基化与宫颈癌和胰腺癌密切相关[16-17]。
本研究评估血清SOX1基因和VIM基因启动子甲基化是否与HCC患者的临床特征有关。结果发现,SOX1基因和VIM基因启动子甲基化均与HCC患者的肿瘤分化程度、TNM分期、肿瘤远处转移有关,提示SOX1基因和VIM基因启动子甲基化功能与HCC进展密切相关,可能通过调控肿瘤细胞增殖、迁移和侵袭,从而参与HCC的临床进展过程。另外本研究还发现,SOX1基因启动子甲基化与HCC患者的包膜侵犯情况有关,推测SOX1基因启动子甲基化可能影响其他相关基因的表达,从而导致HCC的临床特征发生变化。以上结果表明,血清SOX1基因和VIM基因启动子甲基化状态可能是HCC进展的有效预测因子。
然而,由于本研究样本量较少,且没有量化HCC患者血清和组织中SOX1、VIMmRNA和蛋白表达水平,因此在后续研究中将进一步检测HCC患者SOX1和VIM表达与启动子甲基化之间的关系,以期为血清SOX1基因和VIM基因启动子甲基化的临床应用提供更充分的参考依据。
综上所述,HCC患者血清中存在SOX1基因和VIM基因启动子甲基化,SOX1基因启动子甲基化与包膜侵犯程度、分化程度、TNM分期、远处转移有关,VIM基因启动子甲基化与肿瘤分化程度、TNM分期、肿瘤远处转移等有关,可作为HCC分子诊断和病情进展的生物标志物。

