桑白皮提取物对糖尿病大鼠血糖血脂及抗氧化酶的影响
陈 舟 黄 和 陈其余
温州医科大学附属第一医院 浙江 温州 325000
桑白皮(Morus alba L.,MOR),为桑科桑属植物,为桑科植物的干燥根皮[1]。《本草纲目》记载本品具有泻肺,利大小肠,长于利水,降气散血功效。后续研究发现,桑白皮可泻肺平喘、利水消肿,主治肺热喘咳、水肿胀满尿少,面目肌肤浮肿等[2]。本实验观察桑白皮(Morus alba L.,MOR)醇提物对链脲佐菌素(Streptozocin,STZ)致糖尿病大鼠的血糖、血脂、胰岛素水平及抗氧化酶的影响并初步分析MOR的降糖作用机制。
1 材料与仪器
1.1 实验动物:雄性维通利华Sprague Dawley(SD)大鼠,体重质量(220±20)g,北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2016-006。大鼠分笼饲养,温度20~26℃,相对湿度30%~70%。光照明暗各12h。
1.2 药物与试剂:干燥桑白皮粗粉(购自华东医药股份有限公司),工业乙醇浸泡24h,蒸干,制成干粉,使用生理盐水配制成MOR40%生理盐水(生药浓度)溶液;链脲佐菌素(Streptozocin,Sigma,LOT NO:S0120);二甲双胍(Metformin,Met,中美上海施贵宝制药有限公司,批号:20160115);格列本脲(Glyburude,Gly,赛诺菲(北京)制药有限公司,批号:A160303);125I胰岛素放射免疫分析药盒(上海瑞齐生物科技有限公司,批号:20160626);甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDLC)试剂盒均购自浙江伊利康生物技术有限公司,产品批号分别为20160612、20160612、20160505;抗氧化酶(SOD)和考马斯亮兰蛋白测定试剂盒均购自南京建成生物工程研究所,产品批号分别为20160612和20160720。
1.3 主要仪器和设备:GC-1200γ-放射免疫计数器(安徽中科中佳科学仪器有限公司);UV5分光光度计(梅特勒-托利多国际贸易(上海)有限公司);罗氏血糖仪(罗氏诊断产品(上海)有限公司);BA-90半自动生化仪(深圳迈瑞生物医疗电子股份有限公司)等。
2 方法
2.1 高脂饲料的配制:在66.5%大鼠常规饲料中均匀加入10%猪油,1%胆酸盐,2.5%胆固醇,20%蔗糖搅拌混合均匀后配制成高脂饲料,备用。
2.2 糖尿病模型建立:健康雄性大鼠80只,适应性饲养3天,随机取出10只作为对照组,饲喂正常饲料,其余实验动物灌胃饲养高脂饲料,4周后,禁食不禁水,腹腔注射STZ 55mg/kg。常规饲养7天后,尾静脉取血,使用血糖检测试剂盒检测空腹血糖值,以血糖值大于11.1mmol/L作为糖尿病模型成功标准。
2.3 分组与给药:将成模大鼠随机分成5组,每组10只,分别为:生理盐水空白对照组(Control),糖尿病模型组(Model),二甲双胍Met(0.5mg/kg)组,MOR(1.0和3.0g/kg)组。对照组和模型组给予等体积的生理盐水,每天1次,连续灌胃给药28天。另取健康雄性大鼠40只,随机分为4组,每组10只,分别为空白对照组、Gly(0.3g/kg)组,MOR(1.0和3.0g/kg)组,给药方法同上。
2.4 组织匀浆制备:最后一次给药4小时后,通过颈静脉取药备用,用于血脂和胰岛素的指标的检测,之后颈椎脱臼处死实验动物,解剖并迅速收集肝脏,使
用预冷并写有编号的锡箔纸包裹肝脏,放入液氮中速冻,之后将样本转移到-80℃冰箱保存备用;在进行抗氧化指标检测时,将样本从冰箱中取出,使用预冷的冰生理盐水冲洗干净后,使用滤纸拭干多余液体,对样本称重,按照1:10(w/v)的比例加入生理盐水,使用组织研磨机进行组织匀浆;充分匀浆后,使用离心机,按照2~8℃,2500g,10min条件离心,取上清液,使用蛋白含量用考马斯亮兰法测定抗氧化指标。
2.5 测定方法:分别于给药前(0)、给药后的第7天、第14天、第21天和第28天称重大鼠,并分别在上午相同时间测定空腹血糖值;依照试剂盒步骤要求,采血,取血清,进行血清中甘油三酯(TG)、总胆固醇(TC)和低密度脂蛋白(HDLC)及胰岛素含量的测定以及肝脏组织中SOD含量的测定。并按照下列公式计算胰岛素敏感数指数(ISI):ISI=ln[1/(空腹血糖×空腹胰岛素)][3]。
2.6 统计学方法:实验所得数据以平均数±标准差(±s)表示;使用SPSS19.0统计软件进行单因素方差分析;如果两组数据有显著性差异则采用t检验;P<0.05为差异具有统计学意义。
3 实验结果
3.1 MOR对正常大鼠中体重和空腹血糖的影响:MOR(1.0和3.0g/kg)连续灌胃给药28天后,于第7、14、21、28天测定实验动物体重和空腹血糖值。实验结果显示:和生理盐水空白对照组比较,连续给药28天后,实验动物空腹血糖值和体重均无显著变化,因此结果表明各个剂量组的供试品对于实验动物空腹血糖值和体重均无显著性影响(P>0.05)。见图1、2。
3.2 MOR对STZ致糖尿病大鼠空腹血糖和胰岛素及ISI的影响:如表1。实验结果显示:连续灌胃MOR(1.0和3.0g/kg)28天后,与空白组实验动物比较,模型组实验动物中空腹血糖和血清中胰岛素水平均呈现明显增高趋势(P<0.01),同时胰岛素敏感指数(ISI)明显下降(P<0.01);与模型组实验动物比较,MOR组实验动物中空腹血糖及血清胰岛素水平均显著下降,同时伴有ISI显著增高趋势(P<0.05,P<0.01)。因此,实验结果显示:MOR能够显著降低STZ所致糖尿病大鼠空腹血糖水平,同时可以降低胰岛素水平以及提高机体对胰岛素的敏感性。
3.3 MOR对糖尿病大鼠血脂代谢的影响:如表2结果所示:与模型组实验动物相比:MOR(3.0g/kg)能降低STZ致糖尿病大鼠血清甘油三酯(TG)和高密度脂蛋白(HDLC)水平(P<0.05,P<0.01),对血清TC水平未见有显著影响。结果显示MOR对实验动物中血脂代谢中各指标的影响呈现不用表现,这可能与STZ所致糖尿病大鼠体重生长缓慢有关。
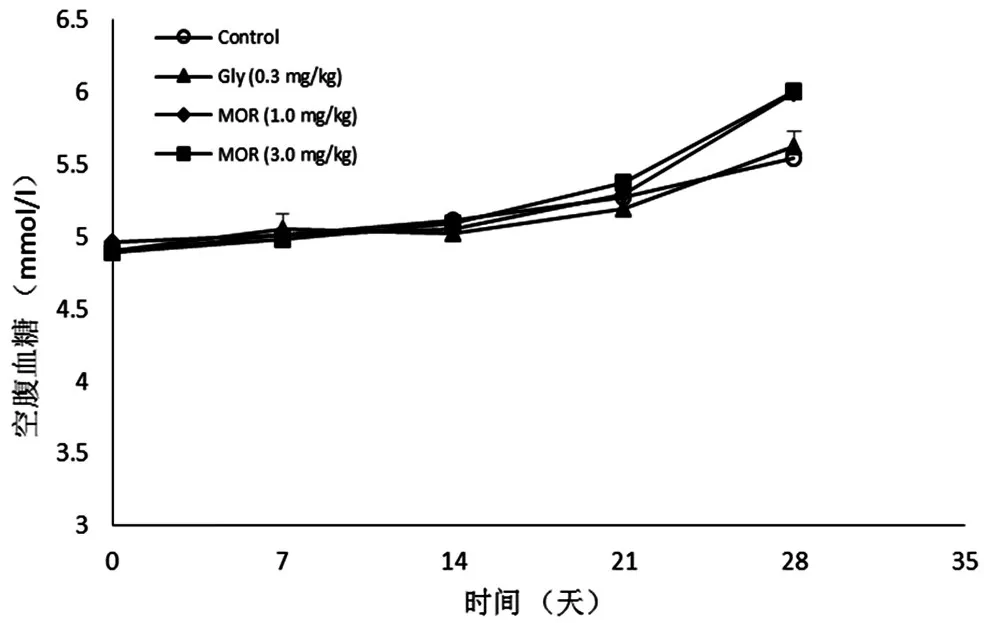
图1 MOR对正常大鼠血糖的影响(±s,n=10)
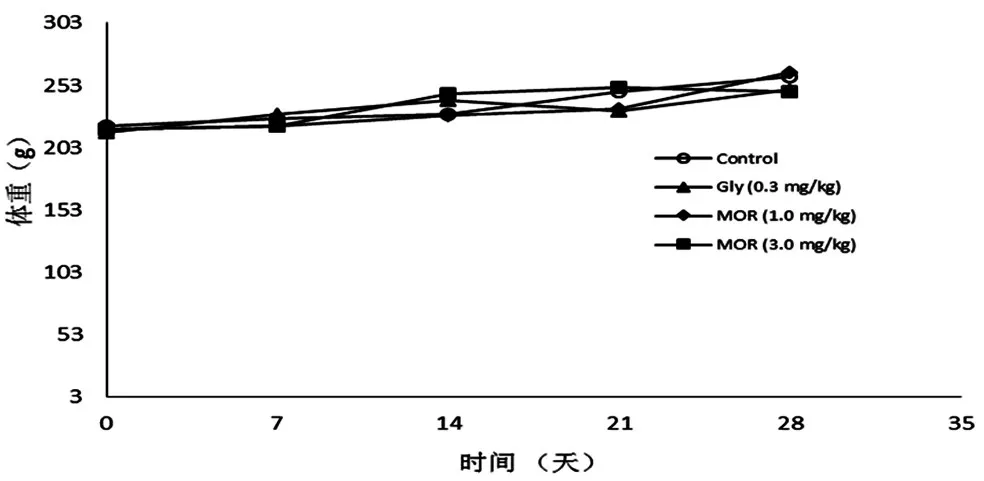
图2 MOR对正常大鼠体质量的影响(±s,n=10)
表1 MOR对糖尿病大鼠血糖、胰岛素及ISI的影响(±s,n=10)
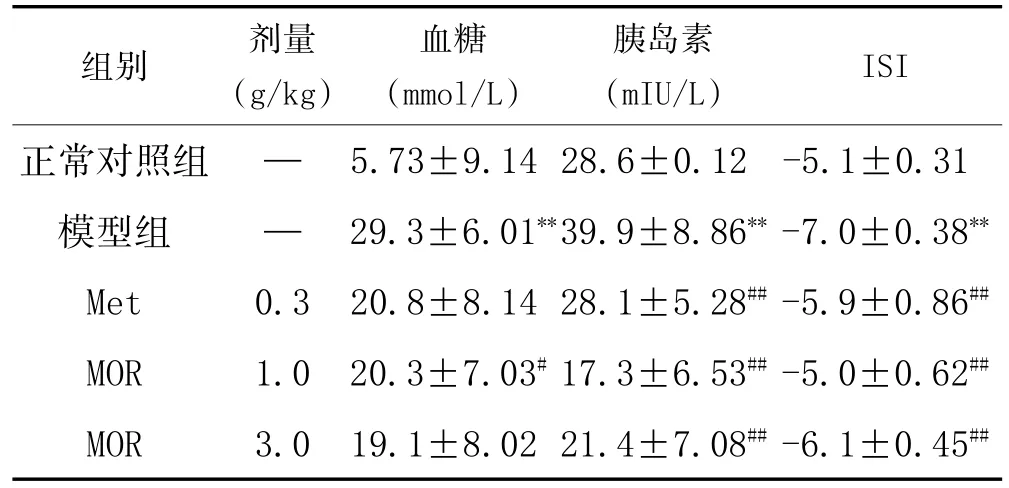
表1 MOR对糖尿病大鼠血糖、胰岛素及ISI的影响(±s,n=10)
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别正常对照组模型组Met MOR MOR剂量(g/kg)— —0.3 1.0 3.0血糖(mmol/L)5.73±9.14 29.3±6.01**20.8±8.14 20.3±7.03#19.1±8.02胰岛素(mIU/L)28.6±0.12 39.9±8.86**28.1±5.28##17.3±6.53##21.4±7.08##ISI-5.1±0.31-7.0±0.38**-5.9±0.86##-5.0±0.62##-6.1±0.45##
表2 MOR对糖尿病大鼠血脂的影响(±s,n=10)
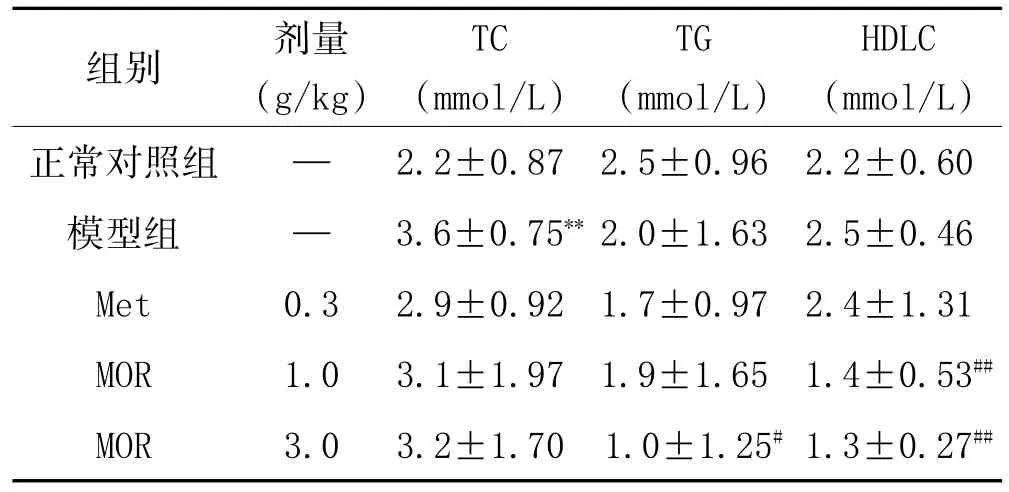
表2 MOR对糖尿病大鼠血脂的影响(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别正常对照组模型组Met MOR MOR剂量(g/kg)— —0.3 1.0 3.0 TC(mmol/L)2.2±0.87 3.6±0.75**2.9±0.92 3.1±1.97 3.2±1.70 TG(mmol/L)2.5±0.96 2.0±1.63 1.7±0.97 1.9±1.65 1.0±1.25#HDLC(mmol/L)2.2±0.60 2.5±0.46 2.4±1.31 1.4±0.53##1.3±0.27##
3.4 MOR对糖尿病大鼠抗氧化能力的影响:如表3结果显示:与模型组实验动物相比,MOR两个剂量水平均会明显提高实验动物肝脏中SOD活性(P<0.01),结果显示MOR的降糖机制可能与抗氧化机制有关。
表3 MOR对糖尿病大鼠肝脏SOD能力的影响(±s,n=10)
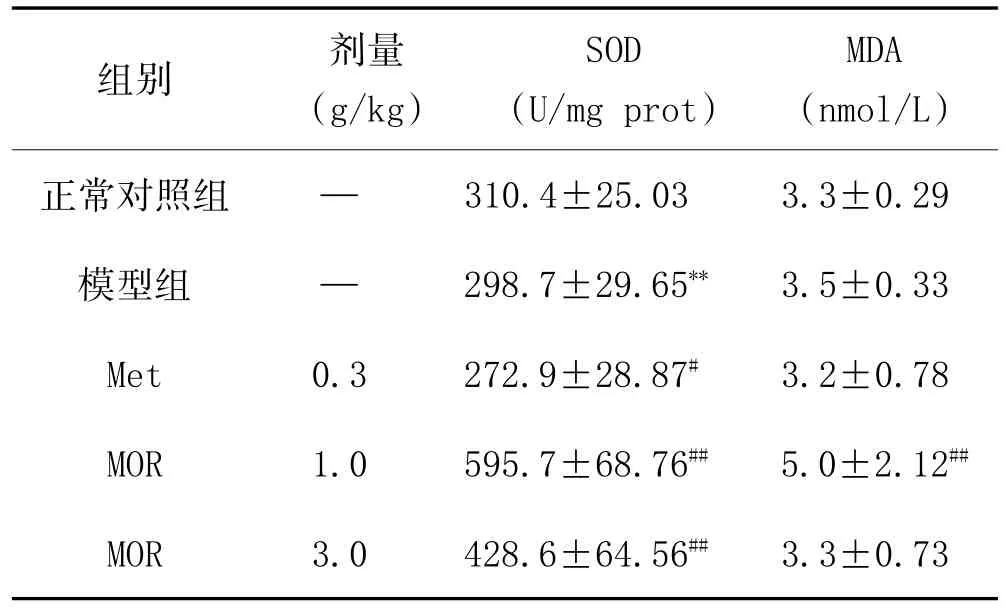
表3 MOR对糖尿病大鼠肝脏SOD能力的影响(±s,n=10)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别正常对照组模型组Met MOR MOR剂量(g/kg)— —0.3 1.0 3.0 310.4±25.03 298.7±29.65**272.9±28.87#595.7±68.76##428.6±64.56##SOD(U/mg prot)MDA(nmol/L)3.3±0.29 3.5±0.33 3.2±0.78 5.0±2.12##3.3±0.73
3.5 MOR对STZ致糖尿病大鼠体重的影响:如图3所示:和空白对照组比较,MOR各个剂量组和模型组实验动物中大鼠的体重均成缓慢的增长趋势;与模型组比较,Met组动物体重未见显著增长(P>0.05),MOR组体质量增长程度显著高于Met组和模型组。
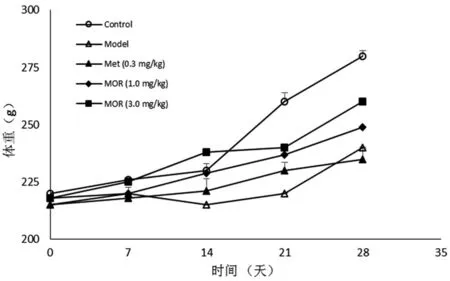
图3 MOR对糖尿病大鼠体质量的影响(±s,n=10)
4 讨论
目前治疗糖尿病主要是口服降糖药或注射胰岛素,需要长期用药,患者的依从性较差;且随着服药次数的增多,药物的毒副作用增大,对患者的生活质量造成严重影响。中药以其长效,低毒的特性,越来越受到人们的关注;目前从天然产物中筛选和发现的降血糖活性成分主要有萜类、皂苷、多糖和低聚糖类等[3]。
STZ在糖尿病模型中较为常用,STZ属于特异性胰岛β细胞毒剂,作用机制为通过破坏超氧自由基,进而破坏胰岛β细胞,从而减少胰岛β细胞中胰岛素的分泌,从而导致高血糖,造成2型糖尿病模型[4-5]。本实验结果显示MOR能够显著降低STZ诱导的糖尿病大鼠中空腹血糖和胰岛素水平;显著增高胰岛素敏感指数。因此MOR的降糖机制应该涉及到多个靶点,会通过增加患者对胰岛素的敏感性,加速机体对于葡萄糖的消耗,加速葡萄糖的代谢,从而起到降糖效果。
超氧化物歧化酶(SOD)可以清除患者体内氧自由基,是生物体内一种重要的酶,可以有效的保护生物体内蛋白质、DNA和细胞膜。糖尿病患者体内中,由于高血糖的总用,使SOD与赖氨酸更容易结合,产生糖化反应,影响SOD的活性效果。降低了其对机体内氧自由基的清除,从而造成糖尿病性白内障,血管疾病和肾病[6-7]。本实验结果显示:MOR可以显著加强肝脏SOD功能,增强其药效活性,加速对体内氧自由基的清除。
糖尿病的另一个重要危害是患者的“三多一少”症状,随着疾病的时间延长,患者体重迅速降低,严重影响患者的生活质量。本实验结果显示MOR组实验动物中动物的体重增长速度显著高于模型组和Met组,因此,MOR对于糖尿病患者的体重降低具有一定的改善效果,从另一方便也更有利于疾病的治疗。MOR对糖尿病的改善作用机制尚待一步研究。

