牛病毒性腹泻病毒E1蛋白的原核表达及多克隆抗体的制备
康 彪,高闪电,独军政,田占成,殷 宏,3*,胡永浩
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,甘肃兰州 730046;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
牛病毒性腹泻-黏膜病(Bovine viral diarrhea-mucosal disease,BVD-MD)是由牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)引起的一种家畜传染病[1]。临床上以发热、腹泻、呼吸道症状、出血综合征、黏膜糜烂、白细胞减少、怀孕母牛流产、产畸形胎为主要特征[2]。该病主要发生于牛,各年龄段牛均可感染,但犊牛易感性较高。该病毒还可以感染猪、羊、鹿、骆驼等家畜,以及感染非洲水牛、大羚羊、加拿大野牛、羊驼、骆马、普度鹿、麅羚、狍、鼷鹿、比利牛斯臆羚、叉角羚等多种偶蹄野生动物[3-6]。该病毒传播途径多样,怀孕母牛发生感染经胎盘垂直传播给胎牛,是 BVDV 的最常见的传染方式。此外,被污染的饲料、饮水和运输工具以及空气中传染性飞沫、人工授精等都可传播该病。若动物患病形成持续性感染并形成免疫耐受,不表现任何临床症状,但仍然带毒排毒,造成牛群的产能下降,还可能诱发其他病原感染,导致继发感染和混合感染[7],给养殖业造成很大经济损失,已成为危害畜牧业的主要疫病之一。
BVDV属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)。病毒粒子为含有囊膜的球型粒子,直径约40 nm~60 nm[8]。BVDV仅有1个血清型,但不同病毒株间存在抗原多样性,可分为3个基因型,即BVDV-1、BVDV-2和BVDV-3,其中BVDV-1和BVDV-2还可以进一步分为BVDV-1a~BVDV-1u[9-11]和BVDV-2a~BVDV-2d等基因亚型[12]。BVDV基因组为单股正链RNA,包含一个大的开放阅读框(ORF),编码一个近4000个氨基酸组成的多聚蛋白,并由细胞和病毒基因编码的蛋白酶在翻译时和翻译后进行加工,生成12种成熟的蛋白质,其中C、Erns、E1、E2等4种蛋白为病毒的结构蛋白,构成BVDV的病毒粒子,其余的N、p7、NS2、NS3、NS4A、NS4B、NS5A、NS5B等8种为病毒的非结构蛋白,在病毒的成熟和基因复制中起着关键作用。BVDV感染细胞必须依赖E1-E2形成二聚体,并且两个蛋白的跨膜区中带电氨基酸在异二聚体形成过程中起重要作用[13]。为了进一步研究E1蛋白在BVDV感染中的作用,本研究利用原核系统表达获得了重组E1蛋白,并制备了兔源多克隆抗体。
1 材料与方法
1.1 材料
1.1.1 病毒株、表达质粒、细胞、菌株及实验动物 试验所用病毒株BVDV-AV69 VEDEVAC购自中国兽医药品监察所,传代20次后保存于-80℃;原核表达载体pPROEX-Htb购自Invitrogen公司;E.coli感受态细胞BL21 (DE3)购自宝生物工程(大连)有限公司;含有BVDV-AV69 VEDEVAC毒株E1编码基因的重组克隆载体pGEMT-E1、牛肾细胞(MDBK)均由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室保存;8周龄雌性新西兰白兔购自中国农业科学院兰州兽医研究所实验动物中心。
1.1.2 主要试剂 MEM培养基,购自Hyclone公司;新生犊牛血清,购自Gibco公司;TaKaRa ExTaq、内切酶BamHⅠ和HindⅢ、胶回收试剂盒、质粒DNA提取试剂盒,购自宝生物工程(大连)有限公司;预染蛋白Marker,购自Thermo公司; 蛋白质纯化试剂盒ProBondTMPurification System,购自 Invitrogen公司;碱性磷酸酯酶(AP)标记的山羊抗兔Ig G、辣根过氧化物酶(HRP)标记的山羊抗兔Ig G、BCIP/NBT Liquid substrate system碱性磷酸酶显色试剂盒,均购自Sigma公司; 兔抗BVDV全病毒阳性参考血清和阴性血清,均由中国农业科学院兰州兽医研究所家畜疫病病原生物学国家重点实验室制备保存;FITC标记的山羊抗兔IgG,购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 细胞培养与病毒增殖 常规方法培养传代MDBK细胞,待细胞长满单层后接种100 TCID50的BVDV悬液,37℃培养箱作用2 h,加入维持液,培养到病变达到80%时,反复冻融3次后,收集病毒培养液,置-70℃保存。
1.2.2 扩增E1基因引物的设计与合成 根据BVDV-AV69 VEDEVAC毒株E1的编码基因序列(GenBank:KC695814,1852-2436 nt),设计1对扩增E1基因的引物,分别为:上游引物F:5′-CATGGATCCATGGCCTCTCCCTACTGTGAGGTAG-3′; 下游引物R:5′-GACAAGCTTCTACCCTTGTGCTCCTGTTATGAGT-3′,下划线部分分别为BamHⅠ和HindⅢ酶切位点,委托生工生物工程(上海)股份有限公司合成。
1.2.3 E1基因表达载体的构建 以pGEMT-E1为模板,利用F引物和R引物进行PCR扩增,反应条件为:95℃ 5 min; 95℃ 1 min,55℃ 1 min,72℃ 1 min,共30个循环; 72℃ 延伸10 min,4℃终止反应。将PCR产物用10 g/L的琼脂糖凝胶电泳鉴定,切胶纯化后用BamHⅠ和Hind Ⅲ进行双酶切,与同样酶切处理的pPROEX-HTb载体用T4 DNA Ligase 于16℃连接过夜,转化BL21(DE3)感受态细胞。挑取单菌落,接种于5 mL含60 μg/mL氨苄青霉素的LB液体培养基中,37℃、220 r/min过夜培养后,用引物进行菌液PCR检测,将初步鉴定为阳性的重组菌抽提质粒,选2个质粒委托南京金斯瑞生物科技有限公司进行测序。将测序正确的阳性重组质粒命名为pPRO-E1。
1.2.4 E1蛋白的表达与纯化 将鉴定正确的重组菌接种于500 mL含60 μg/mL氨苄青霉素的LB中,培养至OD600nm值在0.6~0.8之间时,加入IPTG至终浓度为1 mmol/L,继续培养6 h后,10 000 r/min离心10 min;收集菌体,以20 mL pH 7.4的PBS重悬沉淀,超声破碎菌体,10 000 r/min离心20 min;分别收集上清液和沉淀进行SDS-PAGE。对以包涵体形式表达的重组蛋白用含8 mol/L尿素进行溶解,利用ProBondTM Purification System 对重组蛋白进行纯化,用透析液(10 mmol/L Tris,pH 8.0,1 g/L Triton X-100)透析复性后SDS-PAGE鉴定。
1.2.5 重组E1蛋白的免疫印迹检测 重组 E1蛋白经SDS-PAGE后,转印至2块硝酸纤维素膜上,用50 g/L脱脂乳4℃过夜封闭,分别加入兔抗BVDV阳性参考血清(1∶500)和兔阴性血清(1∶500),37℃作用1 h,PBST洗剂3次,加入碱性磷酸酯酶(AP)标记的山羊抗兔Ig G( 1∶10 000) 37℃作用1 h,PBST洗剂3次,用BCIP/NBT碱性磷酸酶显色试剂盒进行显色。
1.2.6 重组 E1 蛋白兔源多克隆抗体的制备 取纯化的 E1 蛋白与弗氏完全佐剂等比例混合制成油乳剂,免疫2只新西兰雌性白兔。分别标记为①②,采集免疫前阴性血清,之后于背部皮下多点注射,进行第一次免疫,免疫的抗原量约100 μg。一免后20 d,采集一免后血清,以100 μg重组E1蛋白与弗氏不完全佐剂等比例制成的油乳剂,进行第2次免疫。20 d后采集二免后血清,以100 μg重组E1蛋白进行第3次免疫。末次免疫20 d后经心脏采血,分离血清,置-20℃保存,备用。
1.2.7 兔抗E1蛋白多克隆抗体效价的测定 以纯化的重组E1蛋白为包被抗原(包被浓度为0.5 μg/mL),以免疫前的兔血清1∶100稀释作为阴性对照血清,将①②兔抗E1蛋白多克隆血清进行1∶100~1∶12 800倍比稀释,以1∶10 000倍稀释的辣根过氧化物酶(HRP)标记的山羊抗兔Ig G为酶标二抗,以TMB为底物显色液,以免疫血清OD450 nm值/阴性对照血清OD450 nm值大于等于2为阳性判定标准,进行间接ELISA检测,判定兔抗E1蛋白多克隆抗体的效价。
1.2.8 间接免疫荧光法(IFA)检测抗体免疫反应性 将105个MDBK细胞分A、B两组铺于6孔细胞培养板上进行培养,每组设一个平行。24 h后,将500 TCID50的BVDV接种A组细胞,B组作为病毒阴性对照,48 h后用制备的多克隆抗体作为一抗(1∶200倍稀释),作用于A、B两组。用1∶500倍稀释的FITC标记山羊抗兔IgG为二抗,对两组细胞进行免疫荧光试验,检测制备的多克隆抗体的反应性。
2 结果
2.1 E1基因RT-PCR扩增结果
经PCR扩增得到的E1基因产物经10 g/L琼脂糖凝胶电泳分析,在约585 bp处有1个特异性条带,与预期产物大小相符(图1)。
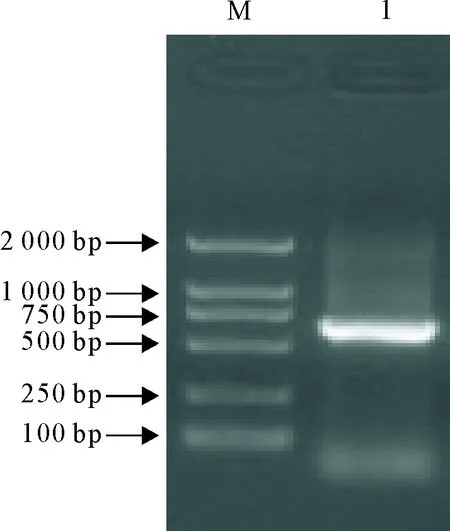
M.DNA标准DL 2 000;1.E1基因的PCR扩增产物
M.DNA Marker DL 2 000; 1.PCR products of E1 gene
图1 E1基因PCR扩增
Fig.1 PCR amplification of the E1 gene
2.2 E1基因表达载体的构建
将E1基因扩增产物与载体pPROEXHTb分别进行双酶切处理,连接后转化E.coliBL21 (DE3)感受态细胞,对挑取单菌落进行培养和菌液PCR鉴定,共获得7个阳性克隆(图2),测序结果表明,所选2个克隆序列完全一致,含有正确的E1基因序列,且读码框正确。
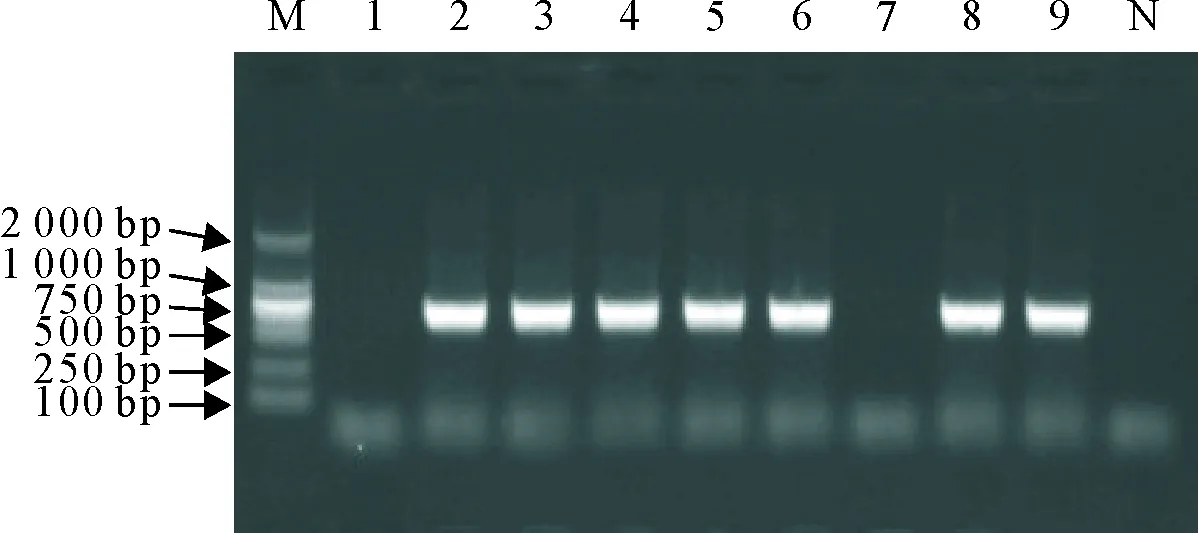
M.DNA标准DL 2 000;1~9.菌液PCR扩增产物;N.阴性对照
M.DNA Marker DL 2 000; 1-9.PCR products of bacterial liquids; N.Negative control
图2 E1重组菌的PCR鉴定
Fig.2 PCR identification of the recombinant E1 bacteria
2.3 E1蛋白的诱导表达与表达形式及纯化鉴定结果
选择测序正确的重组菌,经扩大培养及IPTG诱导后,超声破碎离心,对上清和沉淀进行SDS-PAGE检测。结果显示,重组蛋白以包涵体形式表达,包涵体经纯化、透析得到较纯的目的蛋白,其分子质量大小约为23 ku(图3)。
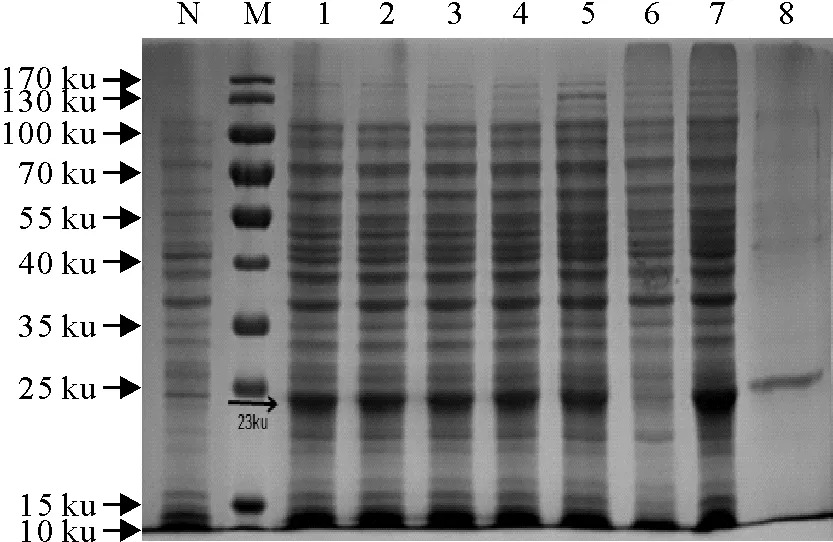
N.未诱导对照;M.蛋白分子质量标准;1~5.诱导后4 h~8 h收样;6.菌体超声裂解后上清;7.菌体超声裂解后沉淀;8.纯化的E1蛋白
N.Uninduced control; M.Protein molecular weight Marker; 1-5.Induced pPRO-E1 samples for 4 h-8 h; 6.Lysate supernatant of recombinant pPRO-E1 bacteria after ultrasonication;7.Lysate precipitate of recombinant pPRO-E1 bacteria after ultrasonication; 8.Purified recombinant E1 protein
图3 E1重组蛋白的诱导表达和纯化
Fig.3 Expression and purification of the recombinant E1 protein
2.4 E1重组蛋白的免疫印迹检测
Western blot结果表明,重组蛋白可与兔抗BVDV阳性血清发生特异性反应,而与阴性血清作用无特异条带出现 (图4) 。
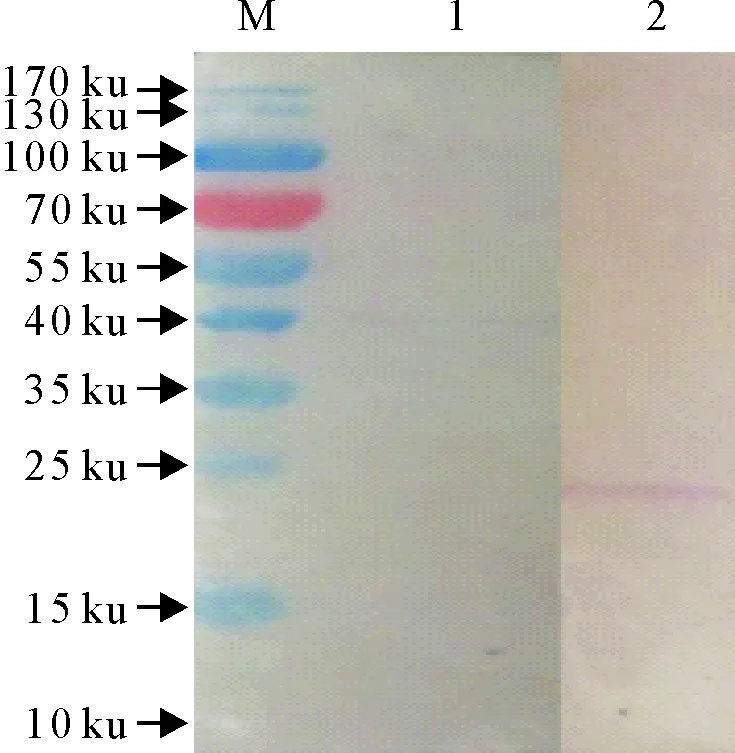
M.蛋白分子质量标准; 1.纯化的蛋白与阴性血清作用; 2.纯化的蛋白与阳性血清作用
M.Protein molecular weight Marker; 1.E1 protein interacts with negative serum; 2.E1 protein interacts with positive serum
图4重组表达蛋白的Western blot分析
Fig.4 Analysis of the recombinant expression protein
by Western blot
2.5 兔抗E1蛋白多克隆抗体效价的测定
ELISA试验结果显示 (图5),当血清达到1∶12 800稀释时,①②兔抗E1蛋白多克隆抗体的OD450 nm值分别为1.468和1.576,明显高于阴性血清的OD450 nm平均值0.399,说明多克隆抗体效价可以达到1∶12 800以上。

1.抗E1蛋白家兔血清;2.抗E1蛋白家兔血清;N.免疫前家兔血清
1.Rabbit anti-E1 sera;2.Rabbit anti-E1 sera;N.Rabbit pre-immune sera
图5间接ELISA测定兔抗E1蛋白多克隆血清抗体的效价
Fig.5 Determination the titer of rabbit polyclonal antibodies against
E1 protein by indirect ELISA
2.6 间接免疫荧光试验(IFA)
IFA结果显示,在接种BVDV的MDBK细胞中(A组)可以看到明显的荧光,未接种病毒的阴性对照MDBK细胞中(B组)未发现特异的荧光,表明制备的兔抗E1多克隆抗体与BVDV天然抗原具有良好的反应原性。
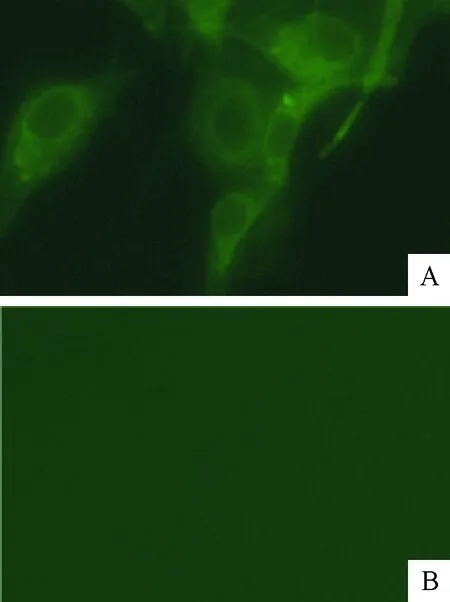
A.E1多克隆抗体试验组;B.阴性对照组A.Anti-E1 polyclonal antibody group; B.Negative control group
3 讨论
制备高效价的抗体,是研究基因表达及基因功能的基础。多克隆抗体具有与多个抗原簇结合的位点,并且制备简便,成本低廉,在免疫学上有着广泛的使用空间[14]。本研究表达了BVDV E1蛋白,重组E1蛋白以包涵体存在,大小为23 ku,具有生物学活性。制备的重组E1多克隆抗体单一针对E1蛋白,试验采用的兔子遗传背景清楚,相对于BVDV感染牛制备的抗体具有更好的特异性,应用于组织细胞培养及生物制品中BVDV污染的检测,结果也更为可靠。因BVDV不同毒株之间具有抗原多样性,可能造成不同毒株之间的抗原决定簇也有一定的差异[14]。研究表明,BVDV的E2蛋白和Erns蛋白可诱生中和抗体[15-16],而E1蛋白不能使动物产生中和抗体,所以我们无法用中和试验验证获得的多克隆抗体的中和效价,但免疫荧光试验证实了所获的多克隆抗体是比较敏感的。就特异性而言,BVDV重组蛋白E1多克隆抗体可能没有单克隆抗体好,但单克隆抗体多为针对单一的抗原决定簇,而多克隆抗体针对多个抗原决定簇,因此就实际使用来说,BVDV重组E1多克隆抗体可能与较多的毒株发生反应。本研究以原核表达的E1蛋白制备了多克隆抗体,为BVDV的检测和E1蛋白功能研究奠定了基础。

