松香人工抗原的合成及多克隆抗体的制备
卞 欢, 仇新媛,2, 李鹏鹏, 陈 琳, 耿志明,*,王道营, 徐为民,3
(1.江苏省农业科学院 农产品加工研究所, 江苏 南京 210014;2.南京工业大学 生物与制药工程学院, 江苏 南京 211816;3.江苏省肉类生产与加工质量安全控制协同创新中心, 江苏 南京 210095)
松香是松树含油树脂蒸去松节油后得到的透明固体物质,是用于制造肥皂、纸张、油漆涂料等的重要化工原料。松香主要由松香酸(abietic acid,AA)和脱氢松香酸(dehydroabietic acid,DHA)等组成,按照来源的不同,松香可分为脂松香、木松香和浮油松香[1-2]。AA和DHA可以导致皮肤过敏,而二者的氧化产物则被认为是主要的致敏物质[3-4]。毒理学研究表明,AA和DHA可引起人体肺泡上皮细胞溶解,有损伤DNA的风险[5-9]。
松香加热熔融后具有良好的黏附特性,曾广泛用于畜禽屠宰,尤其是鸭、鹅等水禽屠宰的二次脱毛加工。采用松香脱毛加工后,松香主要成分,如AA和DHA,会残留在畜禽表皮组织中,并且难以通过后续的加工(腌制、蒸煮、烘烤等)有效去除[10-11]。2009年,我国颁布《食品安全法》,禁止在畜禽屠宰加工过程中使用松香二次脱毛。但在实际生产中,中小畜禽屠宰企业受利益驱动,违禁使用松香加工畜禽的现象依然十分严重,畜禽屠宰加工中非法使用松香脱毛的现象屡有媒体曝光,松香残留导致的质量安全隐患已引起社会关注。因此,建立健全并推广实施畜禽肉制品中松香残留的检测方法,对于监测流通领域畜禽肉制品中松香残留水平、规范畜禽屠宰加工具有重要意义。
AA和DHA广泛存在于造纸厂的废水中[12],在日用消费品,如药剂[13]、化妆品[14]等中也常有检出,甚至可以通过包装材料迁移进入食品中[15]。AA和DHA的检测方法主要有气相色谱法(GC)[16-17]、高效液相色谱法(HPLC)[2,13,18-20]以及液相色谱-质谱法(LC-MS)[21-22]。相对而言,基于HPLC的分析方法应用更为普遍。针对畜禽肉制品中存在的松香残留,国内学者也已建立了基于HPLC的分析方法,并对流通领域内的白条鸭、猪头(爪)及其熟制品中的AA和DHA进行了调查,结果表明生熟畜禽肉制品,尤其是水禽肉制品中松香残留的检出阳性率以及含量确实值得关注[10-11,23-25]。
酶联免疫吸附分析(enzyme linked immunosorbent assay,ELISA)技术具有简便、快捷、通量高等优点,广泛应用于化学污染物的快速分析中。松香主要成分AA和DHA都是小分子化学物质,不具备免疫原性,目前国内外均未见松香残留的人工抗原合成、多克隆抗体制备以及相关ELISA的研究报道。本文以脱氢松香胺(dehydrobietylamine,DHAM)半抗原,通过琥珀酸酐(succinic anhydride,SUC)酰化后分别与牛血清蛋白(bull serum albumin, BSA)和钥孔血蓝蛋白(keyhole limpet haemocyanin, KLH)偶联,合成、表征了人工抗原(合成路线见图1)。在此基础上通过免疫新西兰大白兔制备了多克隆抗体,希望为进一步建立畜禽加工肉制品中松香残留的ELISA方法打下基础。
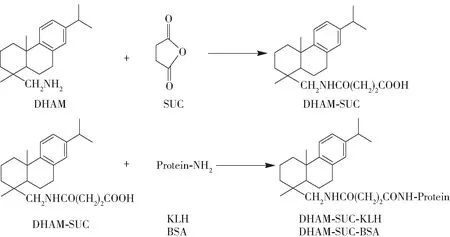
图1 以DHAM为原料合成抗原的示意图Fig.1 Scheme for synthesis of antigens from DHAM
1 材料与方法
1.1 材料与试剂
脱氢松香胺、脱氢松香酸、松香酸、琥珀酸酐、牛血清蛋白、钥孔血蓝蛋白购自北京百灵威科技有限公司;弗氏完全佐剂购自美国Sigma公司;HRP羊抗兔IgG购自南京巴傲得生物科技有限公司;其余化学试剂均为分析纯,实验用水由美国Millipore公司纯水仪制备。
新西兰大白兔由江苏省农科院动物免疫工程研究所提供。
1.2 仪器与设备
Nicolet iS50型傅立叶变换红外光谱仪,美国Thermofisher公司;Avance 400型核磁共振波谱仪,瑞士Bruck公司;1260/6420A型高效液相色谱法串联质谱分析仪,美国Agilent公司;LS55型荧光分光光度仪,美国PerkinElmer公司;Epoch型微孔板分光光度仪,美国Bioteck公司;UV1100型紫外可见分光光度计,上海美普达公司。
1.3 实验方法
1.3.1DHAM-SUC的合成
DHAM(285 mg,1.0 mmol)和SUC(120 mg,1.2 mmol)溶于10 mL无水吡啶,在室温下搅拌24 h。反应混合物中加入20 mL水,然后用50 mL乙酸乙酯萃取2次。有机相用水洗并用硫酸镁干燥,旋转蒸发除去溶剂,粗产物用硅胶柱净化,用乙酸乙酯-正己烷(V/V=3∶2,φ=0.1%的乙酸)洗脱,洗脱液旋转蒸发获得灰白色琥珀酰脱氢松香胺(DHAM-SUC),用红外光谱(IR),核磁共振(1H NMR)以及质谱(ESI-MS)进行表征。
1.3.2DHAM-SUC-BSA和DHAM-SUC-KLH的合成
DHAM-SUC(38.5 mg,0.10 mmol)溶于10 mL无水二恶烷,然后加入三丁胺(28.5 μL,0.12 mmol)和氯甲酸叔丁酯(16.4 μL,0.12 mmol),室温下搅拌1 h。反应混合物滴加入BSA(660 mg,0.01 mmol)的Tris缓冲溶液(20 mL,pH=8.8),4 ℃条件下搅拌过夜。将制得的半抗原-蛋白偶联物溶液转移至透析袋,在超纯水中透析24 h,期间更换4次超纯水(2 L)。透析的溶液冻干获得白色泡沫状DHAM-SUC-BSA(516 mg)。
同法合成DHAM-SUC-KLH,其中KLH用量为80 mg(2×10-5mmol)。
用荧光光谱表征DHAM-SUC-BSA和DHAM-SUC-KLH。
1.3.3DHAM-SUC-BSA和DHAM-SUC-KLH偶联比的测定
完全抗原偶联比的测定参考文献[26],并略做修改,简述如下:以L-缬氨酸作为活性氨基的标准物质,用ω=4%的Na2CO3水溶液配制系列L-缬氨酸标准溶液,然后与ω=0.1%的三硝基苯磺酸(TNBS)溶液混匀,40 ℃恒温水浴避光反应2 h,于420 nm处测定吸光值(OD420),建立标准曲线;分别称取适量的载体蛋白和完全抗原,操作同上。按式(1)计算完全抗原偶联比。
人工抗原偶联比=(CA/m1-CB/m2)×V×M×10-6,
(1)
其中,CA、CB分别为载体蛋白和完全抗原溶液的活性氨基,μmol/L;m1、m2分别为载体蛋白和完全抗原的称样质量,mg;V为溶解载体蛋白和人工抗原的溶液体积,mL;M为载体蛋白的分子量,KLH为4.0×105Da,BSA为6.6×104Da。
1.3.4免疫实验
新西兰大白兔5只,其中4只皮下注射2.0 mL的DHAM-SUC-KLH(1.75 mg溶于1.0 mL含有0.25 mL DMSO的PBS,然后用1.25 mL弗氏完全佐剂乳化),另一只用KLH代替DHAM-SUC-KLH进行免疫,作为阴性对照。在第21、38和50天,每只新西兰大白兔采血10 mL观察抗体产生情况。每次采血同时,肌肉注射1.0 mL的DHAM-SUC-KLH(1.0 mg溶于0.5 mL含有0.25 mL DMSO的PBS,然后用0.75 mL弗氏完全佐剂乳化)。抗血清滴度采用间接ELISA测定,其中DHAM-SUC-BSA用作包被抗原。最后一次注射后7 d,每只新西兰大白兔心脏采血,离心去除细胞后收集抗血清,-80 ℃保存。
1.3.5间接ELISA测定抗血清效价
新西兰大白兔最后一次免疫7 d后采血测定其抗血清效价,方法如下。以2 μg/mL的抗原(DHAM-SUC-BSA)包被96孔酶标板(包被液为pH值9.6的0.05 mol/L碳酸盐缓冲液),每孔100 μL,4 ℃过夜,用磷酸盐吐温缓冲液(PBST,pH值7.4)洗板3次;以w=5%脱脂乳(溶于PBST)进行封闭,每孔100 μL,37 ℃放置1 h,PBST洗板3次;加入倍比稀释的待检血清(采用w=2%脱脂乳稀释),每孔100 μL,37 ℃放置 1 h,洗板3次;加入一定稀释度的HRP羊抗兔IgG(采用w=2%脱脂乳稀释),每孔100 μL,37 ℃ 放置1 h,PBST洗板3次;加入四甲基联苯胺(TMB)底物溶液,每孔100 μL,37 ℃显色5 min;每孔加入2 mol/L H2SO450 μL,终止反应;用酶标仪测定OD450值。
以S/N≥2.1所对应的最大稀释倍数为阳性血清的抗体效价,其中S为阳性血清的OD450,N为阴性血清的OD450。
1.3.6抗血清与DHA和AA反应灵敏度的初步评价
采用间接竞争ELISA评价抗血清与DHA和AA反应灵敏度,方法如下。根据1.3.5节的结果,将OD450在1.0左右的抗体稀释倍数作为抗血清的稀释倍数,添加系列DHA或AA标准溶液(1~500 μg/L),参照1.3.5节测定OD450,按式(2)计算抑制率。
抑制率=[(A0-A)/A0]×100%,
(2)
其中A为DHA或AA标准溶液(1~500 μg/L)的吸光值,A0为未添加标准溶液的吸光值。以标准溶液浓度对数值为横坐标,抑制率为纵坐标,建立回归方程,分别计算DHA和AA的50%抑制浓度(IC50)和20%抑制浓度(IC20)。
2 结果与讨论
2.1 DHAM-SUC的鉴定结果

图2 半抗原DHAM-SUC的红外光谱Fig.2 IR spectrum of DHAM-SUC

以上结果证明DHAM和SUC的酰化反应获得成功。

图3 半抗原DHAM-SUC的1H NMR图Fig.3 1H NMR spectrum of DHAM-SUC
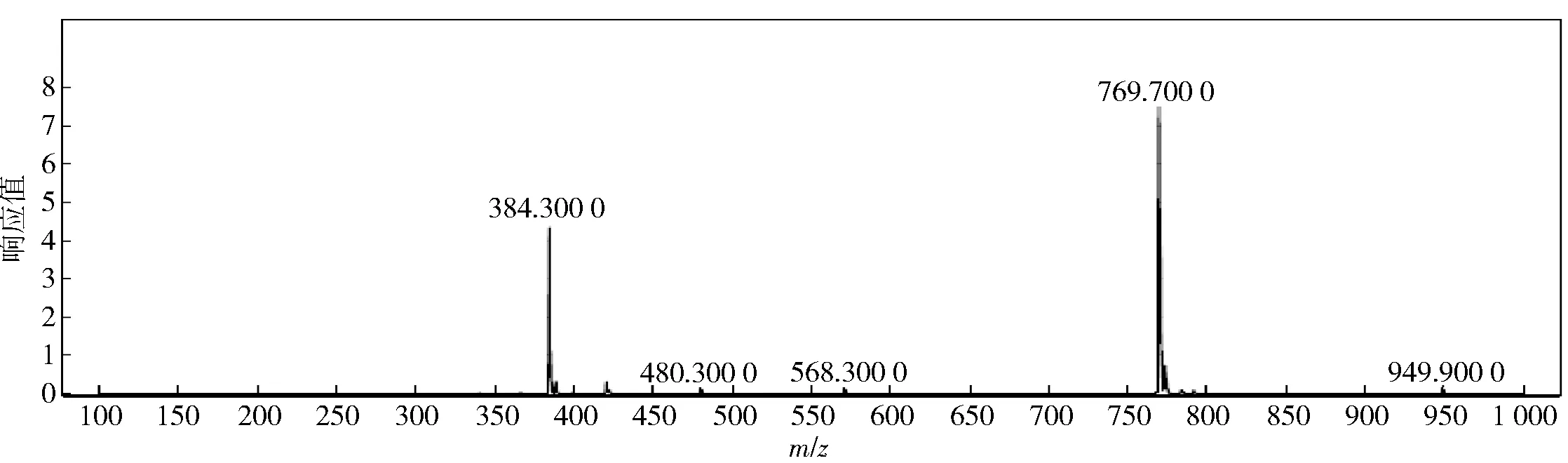
图4 半抗原DHAM-SUC的质谱Fig.4 ESI mass spectrum of DHAM-SUC
2.2 完全抗原的鉴定结果
为了观察DHAM-SUC和BSA、KLH的偶联,本文比较了偶联前后BSA、KLH的荧光光谱(图5和图6)。完全抗原DHAM-SUC-BSA和DHAM-SUC-KLH的荧光强度均显著低于相同蛋白浓度的BSA和KLH。半抗原DHAM-SUC通过羧基与BSA和KLH上的游离伯氨基发生反应,导致蛋白上的游离胺基数减少,导致偶联蛋白的荧光强度下降,但几乎不改变其最大发射波长[27]。蛋白偶联前后的荧光光谱表明,半抗原已与BSA和KLH成功偶联。

蛋白质的质量浓度:BSA及完全抗原浓度均为20 μg/mL;激发波长225 nm;扫描250~450 nm。图5 BSA和DHAM-SUC-BSA的荧光光谱Fig.5 Fluorescence spectra of BSA and DHAM-SUC-BSA
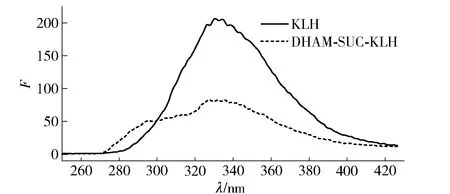
蛋白质的质量浓度:KLH及完全抗原浓度均为0.2 mg/mL;激发波长225 nm;扫描250~450 nm。图6 KLH和DHAM-SUC-KLH的荧光光谱Fig.6 Fluorescence spectra of KLH and DHAM-SUC-KLH
运用三硝基苯磺酸法测定偶联前后蛋白的游离氨基数,计算偶联比,结果显示DHAM-SUC-BSA和DHAM-SUC-KLH的偶联比分别为12和35。
2.3 抗体的效价分析
最后一次免疫7 d后,4号新西兰大白兔抗血清的效价达到了1.28×105,其余也达到了6.4×104。表明本文制备的完全抗原具有良好的免疫原性。
2.4 抗体与脱氢松香酸和松香酸反应的灵敏度分析
为了初步了解抗血清对松香主要成分DHA和AA的灵敏度,本文在固定包被抗原浓度(2 μg/mL)和抗血清稀释倍数(3.2×104)的条件下,利用4号新西兰大白兔的抗血清分别观察了DHA和AA的抑制率和浓度对数的关系(见图7)。其中DHA的回归方程为y=32.23x+4.85(R2=0.993 9),IC50为25.1 μg/L,IC20为3.0 μg/L;AA的回归方程为y=3.49x+2.45(R2=0.994 9),IC50为36.4 μg/L,IC20为5.4 μg/L。以IC20作为检测限和常见的仪器分析方法比较,4号新西兰大白兔的抗血清对DAH和AA的灵敏度已显著优于基于GC[16-17]和HPLC[18-20]的方法,与LC-MS分析方法[21-22]相当。

图7 间接竞争ELISA 测得的DHA和AA的抑制曲线Fig.7 Inhibition curves for DHA and AA using indirect competitive ELISA
松香的主要成分AA和DHA,不具备免疫原性。本文曾利用亚硫酰氯法将DHA直接与BSA和KLH偶联,成功合成并表征了DHA-BSA以及DHA-KLH(数据未列出),并将DHA-KLH作为免疫抗原对兔子进行了免疫,但是未能成功获得高效价的抗血清。我们认为DHA-KLH可能在兔子体内发生了分解,失去了免疫原性。
DHAM虽然不是松香的成分,但与松香的主要成分DHA和AA的化学结构高度相似。本文利用DHAM上的伯氨基可以在温和条件下与羧基形成酰胺的特点,将DHAM经过琥珀酸与载体蛋白偶联。运用DHAM-SUC-KLH作为免疫原、免疫新西兰大白兔产生了具有理想效价的抗血清。免疫获得的抗血清对松香主要成分DHA和AA均具有理想的灵敏度,为下一步建立畜禽肉制品中松香残留ELISA方法的建立打下了坚实的基础。
3 结 论
本文利用DHAM为半抗原、经过琥珀酰化与BSA和KLH偶联,成功合成了松香的完全抗原DHAM-SUC-BSA和DHAM-SUC-KLH,并以DHAM-SUC-KLH为免疫原对家兔进行了免疫,获得了抗血清,效价达1.28×105。运用间接竞争ELISA,对DHA、AA的抑制率进行了初步研究,IC50分别为25.1 μg/L和36.4 μg/L。
本文的创新点是以DHAM半抗原合成松香人工抗原,并制备多克隆抗体,为进一步建立畜禽肉制品中松香残留的ELISA分析方法打下了基础。

