Ti3+自掺杂TiO2光催化剂的制备及光催化性能研究
陈明淦 曾令可 王 慧
(华南理工大学材料科学与工程学院 广州 510640)
前言
二氧化钛(TiO2)是一种资源储量充足、廉价、无毒的白色粉末,作为一种n型半导体,因其良好的化学稳定性和光电性能,被广泛研究并运用在传感器、太阳能电池、紫外光吸收、制氢、自清洁、抑菌除菌、废水处理和空气净化等[1]方面。1972年,藤岛和本多[2]发现了TiO2能够利用太阳光将水裂解为氢气和氧气,这种现象被称作光催化效应。目前TiO2存在两个主要的缺点:较宽的带隙(锐钛矿相≈3.2 eV,金红石相≈3.0 eV),只能吸收紫外区的光(太阳光中紫外线仅占约4%);光生电子-空穴对复合率高。由于这些缺点的存在,极大的限制了TiO2在实际中的应用。离子掺杂因其稳定和简便等优点,成为TiO2改性研究的热点;掺杂可能会在TiO2中引入缺陷或者改变结晶度,也可以抑制晶型转变、抑制光生载流子复合等[3]。因此,研究离子掺杂是提高TiO2光催化性质的关键。
学者对TiO2的掺杂改性的研究范围十分广泛,常用掺杂元素有N、S、C、V、Fe、Co等[4]。近期,有人发展了对TiO2粉体引入Ti3+缺陷和氧空位,而不引入其他元素的方法,这种方法被称为Ti3+自掺杂。
Ti3+自掺杂TiO2光催化剂的主要特点是利用某些手段对TiO2引入Ti3+缺陷和氧空位缺陷。作为一种不引入其他元素的掺杂手段,Ti3+自掺杂TiO2具有以下优势:
1)生成Ti3+缺陷和氧空位,改变TiO2光催化剂的吸收区域,提高TiO2对太阳光的利用率;
2)有效抑制光生空穴-电子对的复合,提高TiO2的光催化速率;
3)提高TiO2对有机物的光降解程度。
Ti3+自掺杂TiO2的光催化原理是与TiO2一致。Ti3+自掺杂TiO2可以形成局部的能级,帮助改变吸收带的范围[5];亦可引入氧空位,捕获空穴[6]。
2011年,Chen等[7]用氢化法制备了黑色的自掺杂TiO2,发现自掺杂TiO2纳米晶体具有良好的太阳能光催化活性,能够使有机分子在水中被光有效降解。研究发现,Ti3+自掺杂TiO2不引入其他元素,降低了形成缺陷和复合中心的可能性,Ti3+和氧空位亦可增加对可见光的吸收[5]。2014年,Liu等[8]成功使用局部氧化法制备Ti3+自掺杂TiO2,为Ti3+自掺杂提供了新的思路。在应用方面,Ti3+自掺杂TiO2在离子电池、超级电容器、微波吸收尤其是光催化方面都体现了优秀的性能。据报道,Ti3+自掺杂TiO2可有效分解污染水源中的有机物[8]、还原有害的重金属离子(如Cr6+[9~10])。因此,自掺杂TiO2的研究有助于TiO2光催化性能的改进,进而对环境(如水源)污染的治理产生实际意义,并具有广泛的应用前景。目前的自掺杂手法大多都有危险、能耗大、过程复杂、不易操作、不易控制等[11]缺点。所以,开发一种简便、易操作且安全的自掺杂方法十分重要。
本文介绍了使用溶胶凝胶法制备TiO2粉体,利用其与硼氢化钠(NaBH4)的固相高温局部还原反应,制备出黑色的Ti3+自掺杂TiO2粉体,对制得的样品进行XRD、XPS、PL等表征分析,确定Ti3+自掺杂TiO2的晶型、元素组成和光生空穴-电子的复合情况等;以及测试光催化还原Cr6+性能。
1 实验
1.1 实验试剂与仪器
本实验所使用的药品试剂的名称、含量、厂家或品牌见下列表格见表1。

表1 实验试剂Tab.1 Raw materials and reagents
本实验所使用的仪器的名称、型号、厂家见下列表格见表2。
表2实验仪器
Tab.2 Experimenting and testing & characterization equipment

仪器型号厂家电子天平AR224CN奥豪斯恒温磁力搅拌器HJ-6A亚特pH计PHS-3E雷磁管式炉OTF-1200X科晶箱式炉KSL-1700X科晶低速离心机SC-3614中佳光化学反应仪BL-GHX比朗
1.2 Ti3+自掺杂TiO2光催化剂的制备
溶胶凝胶法制备TiO2。制备TiO2粉体,本实验采用溶胶凝胶水相法。取一定量的自制抑制剂至适量水中,60 ℃水浴条件下,加入一定量的钛酸四丁酯,再用硝酸将其pH调至2左右,持续搅拌直至成为澄清的溶胶。陈化一晚后,将溶胶置于60 ℃水浴蒸发一定时间成为凝胶。将凝胶进行转移到坩埚内,在一定的温度下热处理一定时间,经过冷却、研磨等步骤制得TiO2粉体。
使用固相法制备Ti3+自掺杂TiO2。称取适量的纯TiO2粉体与适量NaBH4充分混合,放置在管式炉中,在惰性气氛(氩气)下高温反应一定时间,再冷却、洗涤、过滤、真空干燥获得Ti3+自掺杂TiO2粉体。
2 Ti3+自掺杂TiO2的光催化性能研究与表征
2.1 Ti3+自掺杂TiO2的光催化性能测试
2.1.1 分光光度法测量溶液Cr6+浓度的原理
测定溶液中Cr6+的含量可使用分光光度法(GB 7467-87)。这种方法常使用二苯碳酰二肼(DPCI)作为显色剂。DPCI在一定的H+浓度下,可与Cr6+发生络合反应,生成紫红色的络合物。该络合物溶液的最大吸收波长为540 nm左右,其摩尔吸光系数为2.6×104~4.2×104L·mol-1·cm-1[12]。DPCI与Cr6+在溶液中反应产生显色络合物的反应方程式[13]为:

(1)
2.1.2 分光光度法标准曲线的测定
由于分光光度法直接测量溶液的吸光度,以此间接反映溶液中Cr6+浓度,因此需要首先绘制一条不同Cr6+浓度对应吸光度的标准曲线。本实验测量吸光度的仪器为现科公司的紫外可见分光光度计,型号为722。
分光光度法Cr6+标准曲线的绘制过程:①配置显色剂,取0.2 g DPCI溶于50 mL丙酮形成溶液A,将溶液A稀释至100 mL即为显色剂。显色剂须置于棕色瓶中,避光,2~8 ℃冷藏备用;②配置Cr6+浓度分别为0 mg/L(水)、0.03 mg/L、0.06 mg/L、0.12 mg/L、0.24 mg/L、0.36 mg/L、0.48 mg/L、0.60 mg/L、0.72 mg/L、0.84 mg/L、0.96 mg/L的溶液;③各取10 mL上述不同浓度的溶液,加入0.1 mL摩尔比为1∶1的硫酸和磷酸溶液;再加入0.4 mL显色剂,充分震荡5~10 min后,移取适量紫红色溶液到比色皿中测量其吸光度;④根据已有数据,以配制的Cr6+浓度为横坐标,测量的吸光度为纵坐标,拟合出标准曲线。图1是按照此方法绘制的标准曲线。由图1可知,决定系数(Coefficient of determination):
R2=0.999 9
(2)
说明浓度和吸光度值之间存在良好的线性关系。由图1中的线性关系,即可在一定的吸光度值范围内,通过换算得到相对应Cr6+浓度。

图1 Cr6+浓度和吸光度值的标准曲线
Fig.1 Standard curve of Cr6+concentration and absorbance value
2.1.3 Ti3+自掺杂TiO2光催化还原Cr6+性能测试过程
Ti3+自掺杂TiO2光催化还原Cr6+性能测试,主要在光催化反应器内进行(内置500 W氙灯、紫外线滤波片)。准备工作步骤如下:首先,配制30 mg/L的重铬酸钾溶液,取50 mL倒入石英试管。然后,在溶液中添加50 mg柠檬酸,并滴加盐酸调整重铬酸钾溶液的pH为2.00。再添加50 mg待测光催化剂即可。
将石英试管置于光催化反应器内,安装紫外光滤波片,开启温控装置、风扇和反应器,待反应0.5 h后,取出适量石英试管内混合物并离心备测。后开启500 W氙灯,在光反应0.5 h,1 h,1.5 h,2 h,2.5 h,3 h时各取出适量石英试管内混合物并离心备测。
随后使用分光光度法测量Cr6+浓度。分光光度法步骤:首先,取已离心待测溶液0.1 mL,稀释至10 mL;然后加入0.1 ml摩尔比为1∶1的硫酸和磷酸溶液;再加入0.4 mL显色剂,充分震荡,5~10 min后,将紫红色溶液转移到比色皿中测量吸光度;最后使用标准曲线方程换算出Cr6+浓度,进而计算出反应速率、反应百分比等数据并分析。
2.2 XRD分析

(1)400 ℃热处理的Ti3+自掺杂TiO2和 (2)溶胶凝胶法制备TiO2的XRD谱图
(1) XRD spectra of Ti3+self-doped TiO2(2) Sol-gel prepared by heat treatment at 400 ℃
图2上下方垂直线分别表示锐钛矿TiO2和金红石TiO2的PDF标准数据
Fig. 2 upper and lower vertical lines indicate PDF standard data of anatase TiO2and rutile TiO2, respectively
图2的下方谱线是溶胶凝胶法(热处理温度为400 ℃)制备TiO2的XRD谱图,上方谱线是由上述TiO2再经350 ℃热还原的Ti3+自掺杂TiO2的XRD谱图,图中标有各个衍射峰所对应的相,A指锐钛矿相(Anatase),R指金红石相(Rutile)。经过对比PDF卡片(锐钛矿编号21-1272,金红石编号21-1276),在衍射角为25.32°、37.96°、48.02°、53.94°、62.82°处,分别对应锐钛矿相的(101)(004)(200)(105)(204)晶面;在衍射角为27.34°、35.96°、54.28°、68.96°处,分别对应金红石相的(110)(101)(211)(301)晶面。由图2可知,无论是400℃热还原的Ti3+自掺杂TiO2、还是溶胶凝胶法(热处理温度为400 ℃)制备TiO2都是以锐钛矿相为主,锐钛矿和金红石共同存在的混合相,说明Ti3+的掺杂并没有造成明显的TiO2晶型结构的改变。对比25.4°衍射峰,TiO2的衍射峰比Ti3+自掺杂TiO2的衍射峰强度、峰宽发生了变化,说明Ti3+自掺杂TiO2的晶粒大小和结晶度发生了变化,Ti3+自掺杂TiO2的结晶度更低。这是由于Ti3+自掺杂TiO2中氧空位和Ti3+的存在,导致了晶体的无序性增加,出现了一定量的混乱态[14]。除去锐钛矿相和金红石相,自掺杂样品出现了若干衍射峰,没有特定的PDF卡片与其匹配(图2中以“°”标记处),Tan等[6]认为这种现象是Ti9O17、Ti8O15、Ti3O5等几种钛氧化物的混合物造成的,说明自掺杂TiO2产生了氧空位。
2.3 XPS分析
图3是还原温度为400 ℃制备的Ti3+自掺杂TiO2的XPS全谱图。在图3中可见,样品中含有Ti、O、C三种元素。可推测,C元素的可能存在有三个因素:①制备过程中的C元素不完全消耗;②在溶胶凝胶法制备原料过程中,对凝胶进行热处理后,样品受到C元素污染;③XPS仪器本身受到污染。图中未出现硼(B)元素的峰,说明NaBH4在洗涤过程已清除。

图3 Ti3+自掺杂TiO2(还原温度400 ℃)的XPS全谱图
Fig.3 XPS full spectrum of Ti3+self-doped TiO2(reduction temperature 400 ℃)
图4是Ti3+自掺杂TiO2样品的结合能为526 eV到536 eV的XPS谱图。530.18 eV处峰是TiO2的O1s特征峰,同时在TiO2的O1s特征峰旁,出现了Ti2O3的O1s特征峰。
根据图5的Ti3+自掺杂TiO2的XPS在450 eV到475 eV的XPS谱图,清晰可见Ti3+自掺杂TiO2的Ti 2p 1/2和Ti 2p 3/2峰分别对应的结合能位于464.58 eV和458.88 eV,这与纯TiO2的Ti 2p 1/2和Ti 2p 3/2峰(Ti 2p 1/2峰对应的结合能位于460.0 eV、Ti 2p 1/2峰对应的结合能位于453.9 eV)所对应的标准结合能相比,Ti3+自掺杂TiO2的峰位均向高结合能方向偏移,这是由于在Ti3+自掺杂的作用下,Ti周围的电子产生了变化。此外,在结合能为457 eV左右时,出现了Ti2O3的2p峰,说明了样品含有Ti3+。

图4 Ti3+自掺杂TiO2(还原温度400 ℃)样品O1s的XPS谱图
Fig.4 XPS spectrum of Ti3+self-doped TiO2(reduction temperature 400 ℃) sample O1s

图5 Ti3+自掺杂TiO2(还原温度400 ℃)样品的Ti2p的XPS谱图
Fig.5 XPS spectrum of Ti2p in Ti3+self-doped TiO2(reduction temperature 400 ℃) sample
2.4 PL分析
图6是运用溶胶凝胶法制备,P25和热处理温度分别为400 ℃、450 ℃、500 ℃、550 ℃的TiO2的荧光光谱谱图。图7是热还原温度为350 ℃、400 ℃的Ti3+自掺杂TiO2以及热处理温度为450 ℃的荧光光谱谱图。由图6可知,不同温度热处理制备的TiO2,其PL谱图的峰型是基本一致。取450 nm的发射光,其发射强度按从大到小所对应的样品依次排列为TiO2-P25、TiO2-400、TiO2-550、TiO2-500、TiO2-450。在激发光波长为450 nm以下时,TiO2-550、TiO2-500、TiO2-450的发射强度很接近,在激发光波长为450 nm以上时,TiO2-450保持为最小发射强度。上述说明纯TiO2的荧光发射机制基本一致,在光生空穴-电子对的复合的角度来说,TiO2-450样品的光生空穴-电子对的复合率更低一些,造成在激发光下,其发射光强度更低。为了更好地显示自掺杂TiO2的荧光光谱谱图,图7取了TiO2-450样品与热还原温度为350 ℃、400 ℃的Ti3+自掺杂TiO2进行对比。由图7可见,热还原温度为350 ℃(记为B-TiO2350,B指代“黑色自掺杂样品”,下同)400 ℃(记为B-TiO2400)的Ti3+自掺杂TiO2的PL谱线形状基本一致,与纯TiO2的谱线差别很大;纯TiO2的荧光发射强度在大部分波长大于自掺杂样品,说明自掺杂手段改变了内部缺陷的构成,抑制了光生空穴-电子对的复合;B-TiO2400的发射强度明显低于B-TiO2350,说明样品B-TiO2400的光生空穴-电子对的复合率更低,即光子转换效率更高。

图6不同温度热处理的纯TiO2以及P25的PL谱图
Fig.6 PL spectra of pure TiO2and P25 heat treated at different temperatures

图7 不同类型的TiO2的PL谱图Fig.7 PL spectrum of different types of TiO2
2.5 表面积和孔结构分析
样品的表面积分析使用BET模型。图8是P25 TiO2和Ti3+自掺杂TiO2(编号为B-TiO2)样品的氮气吸脱附等温线。由图8可知,两条氮气吸脱附等温线均属于Ⅳ型,因为吸脱附曲线不重合且脱附在吸附的上方;说明样品均属于介孔结构。表3是各样品的BET比表面积和孔径数据,可见P25 TiO2的比表面积达到60 m2·g-1左右,高于自掺杂TiO2,Ti3+自掺杂TiO2样品的较低比表面积的成因可能是:热处理时间长,晶粒在高温作用下长大。
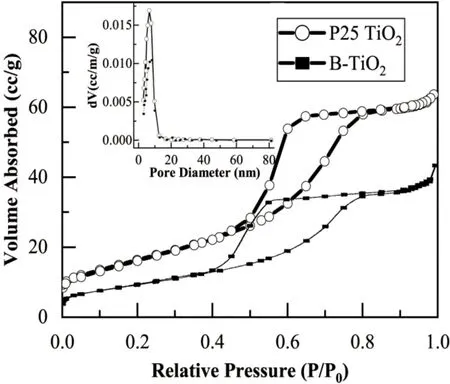
图8 P25 TiO2和自掺杂样品的氮气吸脱附等温线与孔径分布图
Fig.8 Nitrogen adsorption and desorption isotherms and pore size distribution of P25 TiO2and self-doped samples

表3 各样品的BET比表面积和孔径Tab.3 BET specific surface area and pore size of each sample
2.6 光催化还原Cr6+性能测试
本实验使用不同的还原温度所制备的Ti3+自掺杂TiO2,分别编号为B-TiO2X(X=350、400、500,以表示还原温度),并与P25进行对比测试样品对Cr6+的光催化还原性能。光反应过程中使用滤波片滤去紫外线波段光。图9是不同样品的Cr6+光催化还原曲线,横坐标是时间,纵坐标是归一化的Cr6+浓度。可见,自掺杂TiO2对可见光有良好的响应。180 min时,B-TiO2X(X为热还原温度,X=350、400、500;B指“黑色自掺杂样品”,下同)以及P25对Cr6+的光催化还原率分别为32.8%、96.8%、94.3%、100%。在自掺杂样品中,B-TiO2350的光催化还原效率最差,3 h的还原效率未超过1/3;而B-TiO2400、B-TiO2500的光催化还原效率轨迹基本一致,但明显可见三个自掺杂样品的光催化还原效果均低于P25。

图9 不同样品的Cr6+光催化还原曲线
Fig.9 Cr6+photocatalytic reduction curves of different samples
根据一级反应动力学方程:
(3)
即可通过对图2.9的数据进行处理后拟合由斜率得出反应速率常数k,反应速率常数k可以直观反映反应速度的快慢。根据计算,图9中的不同的样品的Cr6+光催化还原反应速率从大到小排列依次是:P25、B-TiO2400、B-TiO2500、B-TiO2350。这说明B-TiO2400与B-TiO2500样品相比,B-TiO2400光催化还原Cr6+的能力略高于B-TiO2500,而样品TiO2350的光催化还原速率仅为B-TiO2400、B-TiO2500的1/3左右,推断这是由于自掺杂时的还原温度较低,没能生成较高密度的Ti3+和氧空位,无法捕获空穴,导致光生电子-空穴对易复合,这一点在PL谱图(图7)上也能体现。对于P25的高光催化还原性能,可能是以下原因造成的:P25经过表面改性,其比表面积(约60 m2/g)远大于自掺杂TiO2(约30 m2/g),且不易团聚,造成P25与反应物的接触面积大于其他样品,故其反应速率较大。
3 结论
本文主要使用了固相高温局部还原的方法制备Ti3+自掺杂TiO2。选用溶胶凝胶法自制的纯TiO2与一定量的NaBH4在惰性气氛下一定温度一定时间下充分反应,利用NaBH4的还原性质,制备得Ti3+自掺杂TiO2样品。并针对不同条件下制备而得的样品进行表征分析与性能检测,讨论Ti3+自掺杂TiO2的光催化性能以及造成如此光催化性能的原因。并得出以下结论:
1)在固相高温局部还原过程中,NaBH4作为还原剂,高温下发生还原反应,形成Ti3+缺陷和氧空位。由XRD分析可知,固相高温局部还原后,产物与原料的晶型保持一致,衍射峰未发生偏移,但是在晶粒大小和结晶度上发生了变化。这是由于自掺杂生成了Ti3+和氧空位导致了晶体的无序性增加,形成无序态。Ti3+自掺杂TiO2中Ti的XPS峰位向高结合能方向偏移,这是由于在Ti3+自掺杂的作用下,Ti的周围的电子发生了变化,因此造成了偏移。
2)实验制备的Ti3+自掺杂TiO2对可见光均有良好响应,实验发现,在其他条件相同的情况下,以400 ℃为自掺杂还原温度的样品在荧光光谱和光催化还原Cr6+的表现突出,荧光光谱中的发射强度比其他样品更低,说明该样品的光生空穴-电子复合率低,光催化还原Cr6+的速率相较其他自掺杂样品更大,可以认定400 ℃是自掺杂还原的最适温度。
3)实验制备的Ti3+自掺杂TiO2表现出了良好的对Cr6+光催化还原的性能。在3 h时,B-TiO2X(X=350、400、500)对Cr6+的光催化还原率分别为32.8%、96.8%、94.3%,说明自掺杂TiO2可以在短时间内利用太阳光对Cr6+进行高效率还原,在此充当光催化剂的角色。因此,Ti3+自掺杂TiO2可以用于污染的水源,具有高效净水的性能,对环境保护和环境再生具有实际意义。但是,自掺杂TiO2的光催化还原Cr6+的性能对比P25较弱,原因是P25的比表面积较大,且在水中易分散。因此Ti3+自掺杂TiO2须在这一方面进行改进,提高粉体的比表面积,减少团聚,增大在水中的分散程度,从而达到更高的光催化性能。

