土壤线虫群落对森林凋落物分解主场效应的作用
王 阳,王雪峰,张伟东,*
1 辽宁师范大学生命科学学院,大连 116081 2 吉林农业大学中药材学院,长春 130118
森林凋落物主要有木本树种凋落的残枝败叶、皮、根等,是森林生态系统中养分送还土壤的重要组分。凋落物分解一般经历淋洗、粉碎、微生物降解等过程[1],是森林生态系统中养分循环的重要环节,是目前生态学研究中的热点之一[2-3]。凋落物作为养分的主要来源,其分解的快慢决定着养分循环的规模程度,对维持森林生态系统的平衡和良性循环有重要意义。经研究发现,不同生境的森林凋落物在养分含量上有显著不同,且森林凋落物在其生长的栖息地(主场)比在其它生境(客场)分解更快,这种现象被称为凋落物分解的主场效应[4- 6]。凋落物分解的主场效应由Bocock等[7]学者于1960年通过研究主场橡树(Quercuspalustris)叶片分解较快提出的。而后Ayres[8]于2009年提出关于叶凋落物分解的主场效应。Ayres等[8]学者的研究表明,77%的凋落物分解试验表现为主场的分解速率高于在客场的分解速率,其中34%的凋落物在主场的分解速率比在客场的分解速率高10%以上。此后凋落物分解的主场效应开始引起了各国学者的高度关注,因为它可以更好的解释凋落物的分解过程及其影响因素。国外主要进行了主场效应控制凋落物的分解,主场效应强度及其调控因素的研究[8-9]。目前,国内对森林凋落物分解主场效应的研究很多,但对凋落物分解过程中主场效应的生物驱动机制的研究很少见刊。
土壤线虫是无脊椎后生动物,为土壤动物中优势类群,普遍存在于各类生境的土壤中[10-11]。土壤线虫营养类群和数量繁多,对不同生境反应敏感,可作为生态系统变化研究的指示生物[12]。土壤线虫在有机质分解和养分矿化过程中占有极其重要的地位[13- 15]。土壤线虫在碎屑食物网中占据多个营养级,作为其它土壤动物的代表,在物质和能量循环中发挥着关键作用[16],其通过摄食和破碎凋落物直接调控凋落物分解。Bohan等[17]2001年研究发现,土壤动物(如线虫)可直接摄食凋落物,将凋落物碎片降解为简单无机物质,促进凋落物的分解。此外,土壤线虫通过取食微生物和排泄作用来改变微生物活性和群落结构,进而间接调控凋落物分解。例如Niwa等[18]2011年研究发现,土壤食微线虫通过取食真菌和细菌来刺激微生物的活性进而改变地上部分养分循环和分配,加快凋落物分解。由此可见,土壤线虫对凋落物分解具有一定的作用,对研究森林凋落物分解的驱动因素具有重要意义。
本研究采用凋落物袋法,探究土壤线虫对凋落物分解速率和养分释放的影响,土壤线虫对主场效应的驱动及主场效应强度差异。旨在进一步完善对凋落物分解过程中土壤线虫群落作用及其变化的研究,为研究凋落物现存量、凋落物分解速率及营养循环提供借鉴,同时为温带地区针叶和阔叶凋落物分解主场效应的研究提供有益参考。
1 研究样区概况
本研究样区设置在辽宁省大连市甘井子区的西郊国家森林公园内,地处辽东半岛西南方向,该样区属于北半球的暖温带亚湿润季风气候,四季分明,有明显的海洋性气候特征。全年日照总时数为2500—2800h,年平均气温10℃左右,年降雨量550—950mm。该区土壤水分条件良好,以典型的棕色土为主。所有山地均被乔木、灌木和草本覆盖,覆盖率可达83.2%。其主要植被林有阔叶林、针叶林及针叶阔叶混交林3种类型。其中,针叶林主要树种有黑松、油松、槐树、卫矛和桑树等,阔叶林主要树种有辽东栎、麻栎、蒙古栎、栓皮栎、榆树、刺槐等,针阔混交林主要树种是各种栎树(辽东栎、麻栎、蒙古栎、栓皮栎)和松树(黑松、赤松、油松)。研究地的位置、气候、土壤等条件均符合实验需求,所以本研究选取该地黑松林和辽东栎林两个典型植被林为样地,以黑松叶凋落物和辽东栎叶凋落物为分解物。
2 研究方法
2.1 样区设置
2014年11月,在辽东栎林和黑松林建立10m×20m的样地,分别在两个样地内设置4个3m×3m的样方,样方间留3m宽的保护带。于2014年11月收集样地内辽东栎、黑松叶凋落物,带回室内烘干并剪成小段备用,分别称其干重30.00g,装入两种不同的凋落物袋(大小10cm×30cm,孔径0.1mm和0.02mm)内并封口。依据样线法在8个3m×3m样方(2个重复)内分别布设1条样带,每条样带布设7个点,每个样点布设两种网袋各1袋,共112袋,形成了黑松叶凋落物-黑松林(主场,Ph)、黑松叶凋落物-辽东栎林(客场,Pa)、辽东栎叶凋落物-辽东栎林(主场,Qh)、辽东栎叶凋落物-黑松林(客场,Qa)4个处理水平,用金属钉将布置好的网袋固定在样地土壤表层,并在其上覆盖一层凋落物。
2.2 样品采集与土壤线虫的分离鉴定
2015年3月、2015年6月、2015年9月、2016年3月、2016年6月、2016年9月、2017年3月,在各样方的1条样带的每个样点上取回两种网袋各1袋,每次取样16袋,共7次,将其带回实验室,进行土壤线虫的分离鉴定。每袋凋落物经历淘洗-过筛-浅盘过程分离土壤线虫[19],然后参考尹文英的《中国土壤动物检索图鉴》[20],在双目体视显微镜(Olympus C011)下鉴定,分类鉴定到属。依据土壤线虫头、食道、尾等部位特征、摄食习性以及在分解过程中的作用,将其分为食细菌类、食真菌类、植物寄生类和捕食-杂食类[21]四大功能类群。鉴定完毕,将与土壤线虫分离后的凋落物恒温烘干、称量、研磨粉碎、过筛、装瓶备用。
2.3 凋落物理化指标的测定
于2014年11月、2015年3月、2015年6月、2015年9月、2016年3月、2016年6月、2016年9月、2017年3月测定凋落物碳、氮、磷和钾元素含量。全碳含量采用重铬钾硫酸氧化法测定;全氮含量采用过氧化氢-硫酸消化法测定;全磷含量采用钼锑抗比色法测定;全钾含量采用四苯硼酸钠重量法测定。不同处理凋落物初始理化指标见表1。

表1 凋落物初始化学性质
Ph: 黑松叶凋落物—黑松林(主场)PinusthunbergiiParl leaf litter—PinusthunbergiiParl forest(home),Pa: 黑松叶凋落物—辽东栎林(客场)PinusthunbergiiParl leaf litter—QuercusliaotungensisKoidz forest(away),Qh: 辽东栎叶凋落物—辽东栎林(主场)QuercusliaotungensisKoidz leaf litter—QuercusliaotungensisKoidz forest(home),Qa: 辽东栎叶凋落物—黑松林(客场)QuercusliaotungensisKoidz leaf litter—PinusthunbergiiParl forest(away);不同小写字母表示主、客场间差异性显著(P<0.05)
2.4 数据处理
(1) 土壤线虫多样性指数计算
Shannon-Wiener多样性指数[22](H′)
H′=-∑Pi×lnPi
式中,Pi=ni/N,ni为第i个类群的个体数,N为群落中所有类群的个体总数。
Pielou均匀度指数[22](J)
J=H′/lnS
式中,S为类群数。
Simpson优势度指数[22](D)
3.3 ATG9和小泡膜蛋白1 在酵母细胞中,ATG9来源于高尔基体膜的单层囊泡,这些ATG9囊泡在胞质快速运动,并整合到自噬囊泡外膜上[14]。形成成熟自噬体后,哺乳动物细胞ATG9并未整合到自噬体囊泡上,而是又游离进入胞质,其对于酵母和哺乳动物自噬体膜的扩展起重要作用[15]。
D=1-∑Pi2
式中,Pi同上。
Margalef丰富度指数[22](SR)
SR=(S-1)/lnN
式中,S和N同上。
线虫营养多样性指数(TD)
TD=1/∑Pi2
式中,Pi同上。
(2) 凋落物理化指标计算
凋落物残留率[23-24](R)
R(%)=Wt/W0×100
式中,W0为凋落物初始干重,Wt为获样时间t时凋落物干重,R为凋落物残留率。
凋落物累积损失率(Lc)
Lc(%)=(W0-Wt)×100
式中,Lc为凋落物累积损失率,W0和Wt同上。
凋落物元素残留率(E)
E(%)=(Wt×et)/(W0×e0) ×100
式中,E为元素残留率,e0为元素初始含量,et为获样t时元素含量,W0和Wt同上。
(3) 数据统计、方差分析及表制作采用Microsoft Excel 2010软件进行,图制作采用Origin 7.5软件进行,LSD显著性分析和Pearson相关性分析采用SPSS Statistics 17.0软件进行。
3 结果与分析
3.1 凋落物袋内的土壤线虫群落组成及多样性特征
研究期间,于凋落物袋内共鉴定4570条土壤线虫(表2),隶属于线虫动物门35属。0.02mm网袋中鉴定出163条线虫,而0.1mm网袋中鉴定出4407条线虫,其线虫总量显著高于0.02mm网袋内的线虫总量,这是由于0.02mm网袋只允许少数极小型的原生动物和土壤线虫进出[18],控制了土壤线虫的进入。其中Ph处理(0.1mm网袋)食细菌类线虫占45.59%,植物寄生类线虫占28.00%,Pa处理(0.1mm网袋)食细菌类线虫占40.29%,植物寄生类线虫占20.88%,且Ph处理(0.1mm网袋)与Pa处理(0.1mm网袋)食细菌类线虫数量存在显著性差异(P<0.05),Ph处理(0.1mm网袋)与Pa处理(0.1mm网袋)植物寄生类线虫数量呈显著性差异(P<0.05)。Qh处理(0.1mm网袋)食细菌类线虫占46.51%,植物寄生类线虫占30.90%,Qa处理(0.1mm网袋)食细菌类线虫占41.62%,植物寄生类线虫占26.03%,且Qh处理(0.1mm网袋)与Qa处理(0.1mm网袋)食细菌类线虫数量存在显著性差异(P<0.05),Qh处理(0.1mm网袋)与Qa处理(0.1mm网袋)植物寄生类线虫数量呈显著性差异(P<0.05)。可见食细菌类线虫和植物寄生类线虫为主要功能类群。
黑松凋落物袋(0.1mm网袋)共捕获土壤线虫1729条,32属。其中,Ph处理(0.1mm网袋)捕获线虫1144条,其优势属为针属、滑刃属、明杆属和头叶属,占56.80%。Pa处理(0.1mm网袋)捕获线虫585条,其优势属有真滑刃属、滑刃属和明杆属,占49.59%。辽东栎凋落物袋(0.1mm网袋)共捕获线虫2679条,34属。其中,Qh处理(0.1mm网袋)捕获线虫1853条,其优势属为针属、滑刃属、明杆属和头叶属,占56.31%。Qa处理(0.1mm网袋)捕获线虫826条,其优势属有滑刃属、明杆属和头叶属,占49.32%。由独立样本t检验可知,Ph处理与Pa处理、Qh处理与Qa处理的优势属数量存在显著性差异(P<0.05),可见优势属对凋落物分解主场效应具有重要作用。
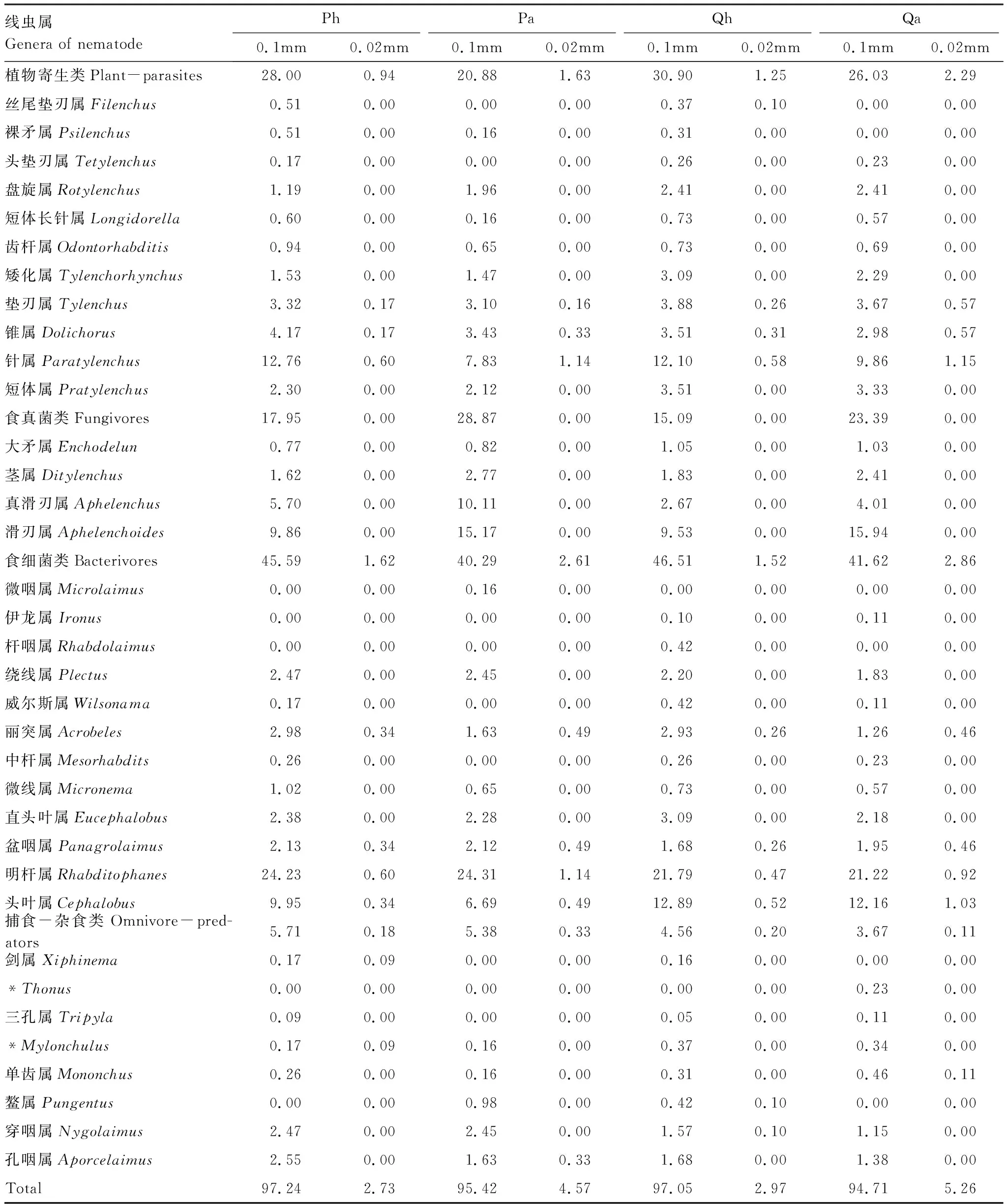
表2 0.1 mm和0.02 mm凋落物袋内土壤线虫群落组成/%
*:至今未查到其中文名
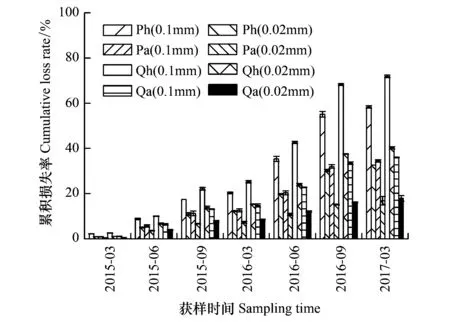
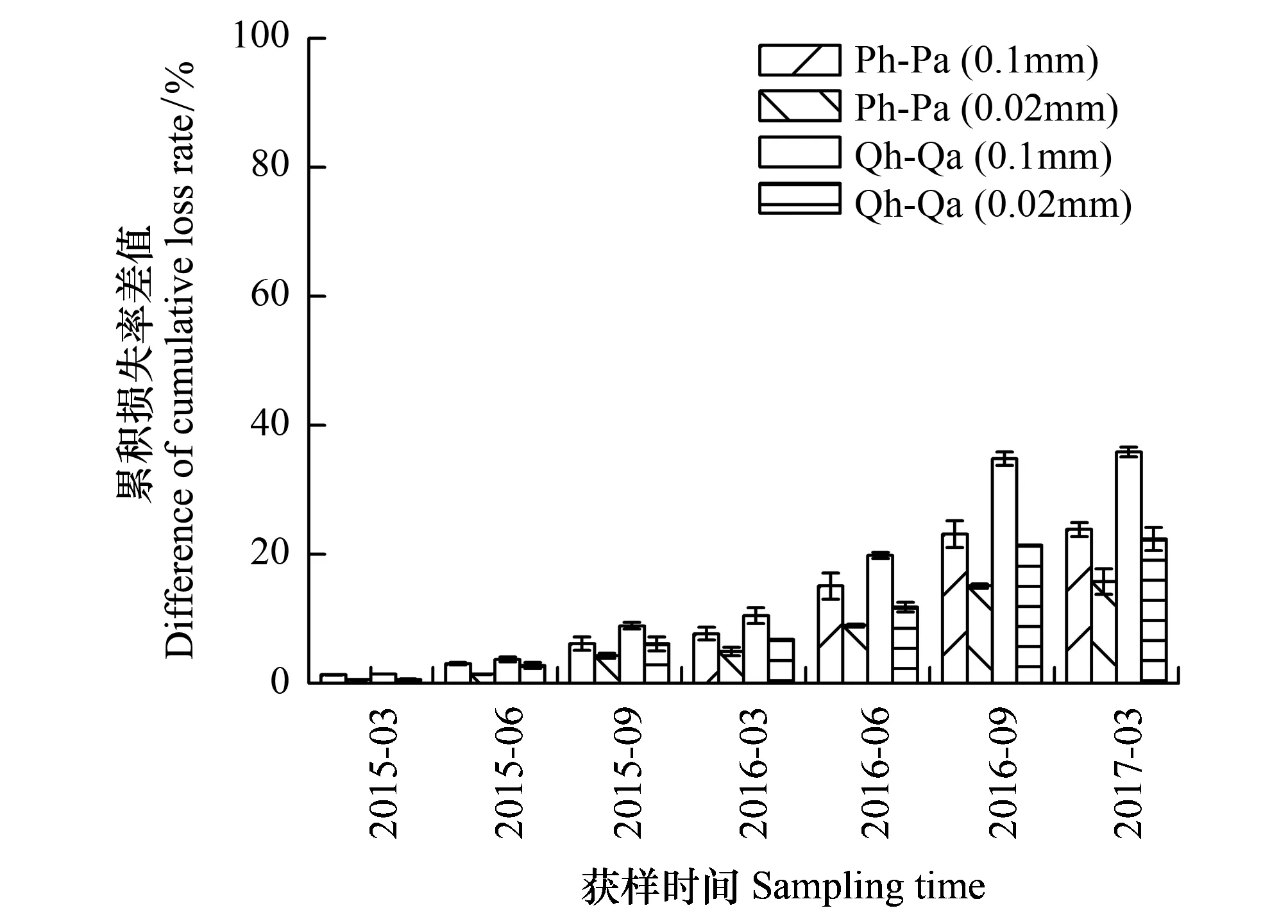
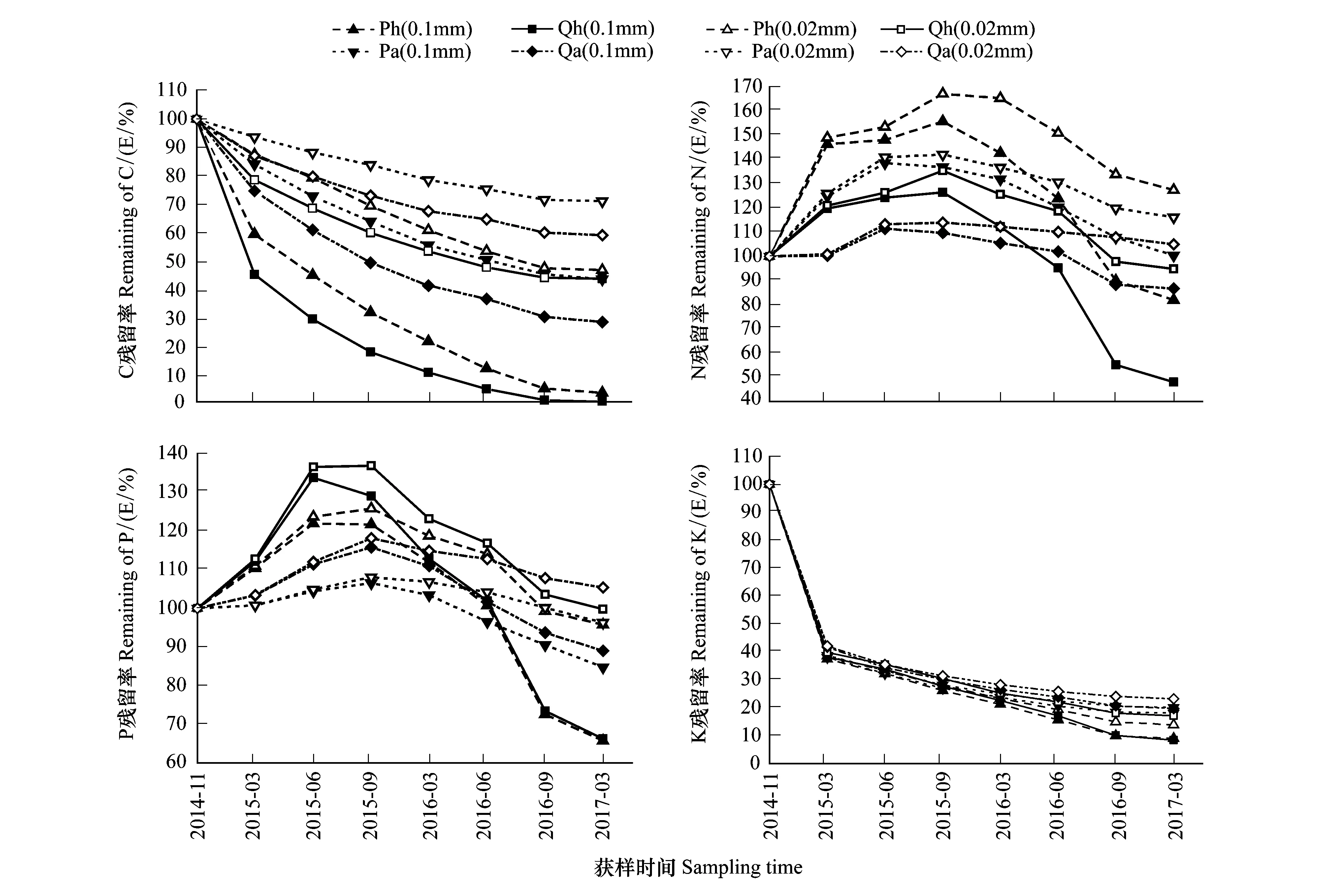
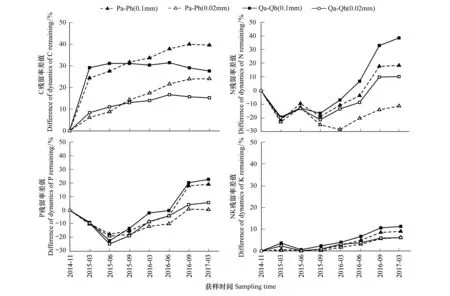
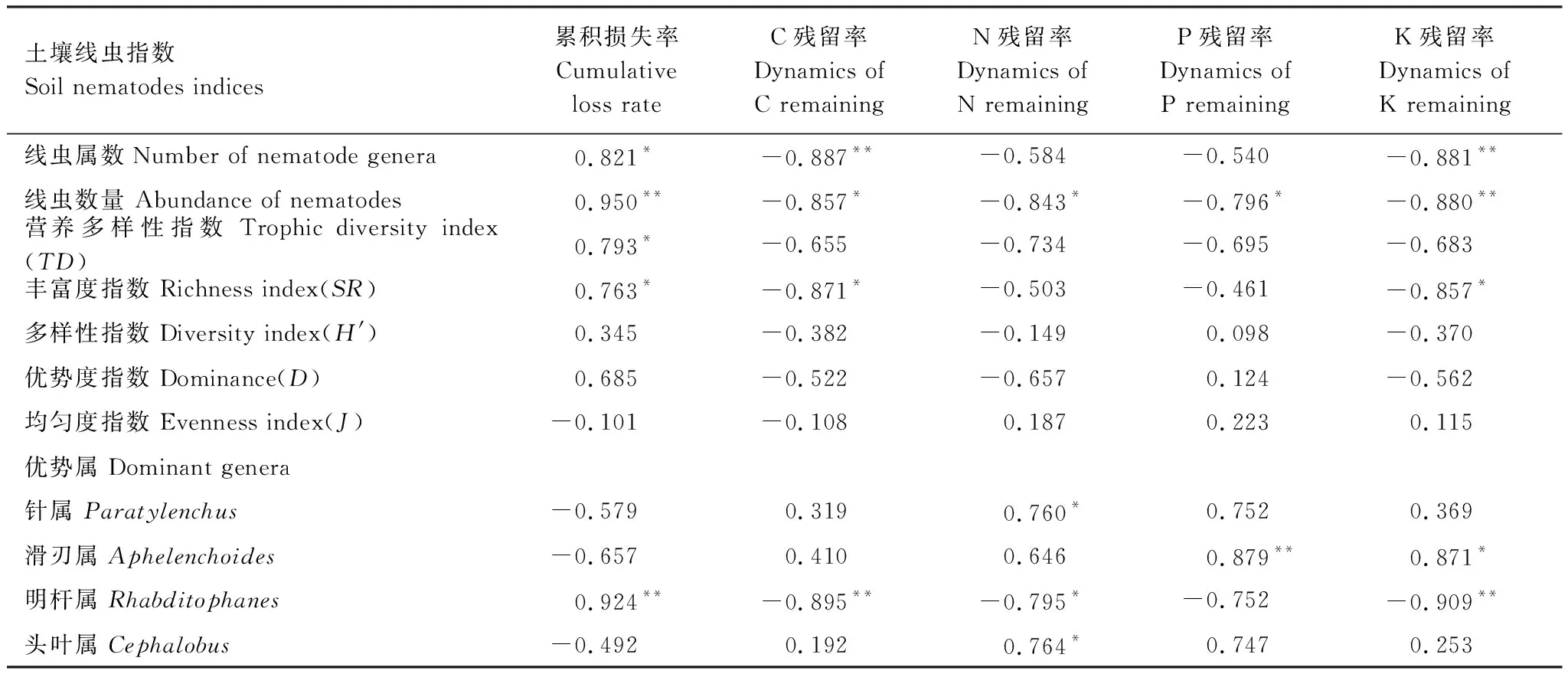
由表3可知,SR指数、H′指数、J指数空间分布:Qh处理>Qa处理,Ph处理>Pa处理,而TD指数、D指数为Ph处理 表3 各样地土壤线虫群落多样性 不同小写字母表示主、客场间差异性显著(P<0.05) 图1 各样地凋落物分解速率Fig.1 Litter decomposition rate in every plot Ph: 黑松叶凋落物—黑松林(主场) Pinus thunbergii Parl leaf litter—Pinus thunbergii Parl forest(home),Pa: 黑松叶凋落物—辽东栎林(客场) Pinus thunbergii Parl leaf litter—Quercus liaotungensis Koidz forest(away),Qh: 辽东栎叶凋落物—辽东栎林(主场) Quercus liaotungensis Koidz leaf litter—Quercus liaotungensis Koidz forest(home),Qa: 辽东栎叶凋落物—黑松林(客场) Quercus liaotungensis Koidz leaf litter—Pinus thunbergii Parl forest(away); 不同小写字母表示主、客场间差异性显著(P<0.05) 图2 各样地凋落物分解速率差值Fig.2 Difference of litter decomposition rate in every plot 由图1可知,各处理凋落物的分解损失率呈现出相同的变化趋势,且同种凋落物累积损失率表现为0.1mm网袋>0.02mm网袋,Qh处理>Qa处理,Ph处理>Pa处理,可见主场凋落物分解损失率较高,分解速度较客场快。除2015年6月和9月外,其余各月Pa(0.1mm)与Ph(0.1mm)处理累积损失率差异极显著(P<0.01),各分解阶段Qa(0.1mm)与Qh(0.1mm)处理累积损失率存在极显著性差异(P<0.01)。 由图2可知,Ph处理与Pa处理、Qh处理与Qa处理凋落物分解损失率差值均呈正值,且凋落物损失率差值表现为0.1mm网袋>0.02mm网袋。分解过程中,除2015年3月、2015年9月外,其余各月Ph-Pa(0.1mm)与Ph-Pa(0.02mm)存在显著差异(P<0.05)。除2015年3月、2015年6月外,其余各月Qh-Qa(0.1mm)与Qh-Qa(0.02mm)差异显著(P<0.05)。 由图3可知,土壤生物的特化作用显著影响了凋落物分解过程中C、N、P元素养分释放,而对K元素释放影响不大。凋落物分解过程中C、K元素为直接释放,而N、P元素为先富集后释放[25]。同种凋落物C、N、P、K元素释放量均表现为0.1mm网袋>0.02mm网袋,主场>客场。由独立样本t检验可知,在分解过程中,Pa(0.1mm)与Pa(0.02mm)处理、Ph(0.1mm)与Ph(0.02mm)处理、Qa(0.1mm)与Qa(0.02mm)处理、Qh(0.1mm)与Qh(0.02mm)处理、Pa(0.1mm)与Ph(0.1mm)处理、Qa(0.1mm)与Qh(0.1mm)处理C元素释放量均存在极显著性差异(P<0.01)。Pa(0.1mm)与Ph(0.1mm)处理、Qa(0.1mm)与Qh(0.1mm)处理N元素释放量均存在极显著性差异(P<0.01)。Pa(0.1mm)与Ph(0.1mm)处理P元素释放量均存在极显著性差异(P<0.01),而Qa(0.1mm)与Qh(0.1mm)处理P元素释放量呈显著性差异(P<0.05)。由此可见土壤线虫不同程度驱动了主场效应,加速了凋落物养分释放。 由图4可知,Ph处理与Pa处理、Qh处理与Qa处理凋落物元素残留率差值随分解时间总体呈增大趋势,且C、N、P、K元素残留率差值(Pa-Ph、Qa-Qh)均表现为0.1mm网袋>0.02mm网袋。在分解过程中,C、N、P元素残留率差值(Pa-Ph、Qa-Qh)增加较快,而K元素残留率差值(Pa-Ph、Qa-Qh)波动较小,可见土壤线虫对主场C、N、P元素释放作用较为显著,而对K元素释放影响不大。各分解期间,C、K元素残留率差值(Pa-Ph、Qa-Qh)均为正值,表现出正效应。分解前期,N、P元素残留率差值(Pa-Ph、Qa-Qh)为负值,表现出负效应,分解中后期,N、P元素残留率差值(Pa-Ph、Qa-Qh)为正值,表现出正效应。 由表4可知,不同分解时期的线虫个体总数、属数、营养多样性指数(TD)、丰富度指数(SR)、明杆属数量均与凋落物累积损失率显著正相关(P<0.05);线虫个体总数、线虫属数、明杆属线虫数量、丰富度指数(SR)分别与C残留率、K残留率显著负相关(P<0.05);线虫个体总数与N残留率、P残留率显著负相关(P<0.05);针属、头叶属线虫数量均与N残留率显著正相关(P<0.05);明杆属线虫数量与N残留率显著负相关(P<0.05);滑刃属线虫数量与P残留率、K残留率显著正相关(P<0.05)。上述结果反映了研究过程中土壤线虫群落对凋落物分解损失率以及理化性质动态的响应。 图3 各样地凋落物元素残留率Fig.3 Dynamics of element remaining in every plot 图4 各样地凋落物元素残留率差值Fig.4 Difference of dynamics of element remaining in every plot 土壤线虫指数Soil nematodes indices累积损失率Cumulative loss rateC残留率Dynamics of C remainingN残留率Dynamics of N remainingP残留率Dynamics of P remainingK残留率Dynamics of K remaining线虫属数Number of nematode genera0.821*-0.887**-0.584-0.540-0.881**线虫数量 Abundance of nematodes0.950**-0.857*-0.843*-0.796*-0.880**营养多样性指数 Trophic diversity index(TD)0.793*-0.655-0.734-0.695-0.683丰富度指数 Richness index(SR)0.763*-0.871*-0.503-0.461-0.857*多样性指数 Diversity index(H')0.345-0.382-0.1490.098-0.370优势度指数 Dominance(D)0.685-0.522-0.6570.124-0.562均匀度指数 Evenness index(J)-0.101-0.1080.1870.2230.115优势属 Dominant genera针属 Paratylenchus-0.5790.3190.760*0.7520.369滑刃属 Aphelenchoides-0.6570.4100.6460.879**0.871*明杆属 Rhabditophanes0.924**-0.895**-0.795*-0.752-0.909**头叶属 Cephalobus-0.4920.1920.764*0.7470.253 *P< 0.05, **P< 0.01 本研究结果表明,凋落物中线虫种类、数量、多样性指数与凋落物累积损失率、C、N、P和K的残留率有显著相关性,反映了土壤线虫对凋落物分解作用同时又受到凋落物的调节。主场与客场线虫的种类和数量在不同分解时期存在显著差异,表明了土壤线虫对主场效应的驱动。Ayres等[26]认为,除叶凋落物质量和环境等因素外,主场效应也是影响凋落物分解的重要因素,这一结论与本研究结果一致。森林凋落物分解的主场、客场效应差异可能是由于凋落物质量、土壤微生物多样性、林分的物种多样性、林下植被覆盖度等关键因素所致[27- 29]。而主场效应又影响着凋落物的分解速率和养分元素释放。 凋落物分解过程中土壤线虫主要实现粉碎作用,使凋落物变小,利于微生物进行物质转化[30]。本研究0.02mm网袋内线虫数量极少,凋落物分解过程中,真菌和细菌为主要土壤生物,线虫作用受到很大限制,但C、N、P元素也有释放。而0.1mm网袋中线虫数量较多,其中食细菌类线虫和植食寄生类线虫占优势,与微生物共同驱动主、客场凋落物的分解。线虫通过摄食细菌和真菌来调控微生物的结构与分布,其消化后的排泄物N加速了养分流动,而排泄物粪粒为微生物提供更多生存空间,使微生物快速调整[31],表明土壤生物在凋落物分解中发挥重要作用,促进了N元素释放。本研究发现,0.1mm网袋中,主、客场的线虫优势属存在差异性,其中客场有3类优势属,主场有4类优势属,这主要与主、客场凋落物类型和土壤食物网结构有关,且主场优势属数量较多,说明其分布较广,对主场效应的作用明显。凋落物分解主场效应的驱动机制是土壤生物的特化作用[6]。Gholz等[32]研究发现,客场凋落物种类有异于生境,土壤生物群落多样性较低,而主场土壤生物与生境凋落物相互适应,土壤生物丰富度较高,使主场不同土壤生物因吸收同一凋落物养分而发生竞争,造成土壤生物选择性对同生境叶凋落物分解特别有效,即土壤生物的特化作用,进而使凋落物在其生长的栖息地(主场)比在其它生境(客场)分解更快,发生主场效应。在不同样地的不同分解阶段,线虫的组成和活动变化体现了能量流动和物质循环的变化。本研究中主、客场之间凋落物C、N、P、K元素初始含量差异不显著,凋落物交互移置后,0.1mm网袋中同种凋落物在主场的损失率和C、N、P元素养分释放量均显著高于客场,且主场与客场之间呈一定程度的差异性(P<0.05),而K元素养分释放量表现为主场略高于客场,由于主场线虫种类、数量、SR指数、H′指数、J指数较客场高,表明主场线虫活动较频繁,调控了土壤微生物的分布及活性,使凋落物养分释放加快;而客场线虫多样性较低,导致凋落物养分释放较慢。由此说明土壤线虫对主场凋落物分解作用较强,其特化作用显著影响了凋落物的分解速率和养分循环。本研究同种凋落物的分解损失率差值(Ph-Pa、Qh-Qa)、元素残留率差值(Pa-Ph、Qa-Qh)总体上均有增加,说明土壤线虫对凋落物分解主场效应驱动作用不断增大。凋落物分解前期,主场凋落物N、P元素富集较客场多,从而表现出负效应。 土壤生物组成差异越明显,表明凋落物质量差越大,主场效应强度差异越大[8]。本研究发现,C、N、P、K元素残留率差值(Pa-Ph、Qa-Qh)均表现为0.1mm网袋>0.02mm网袋,可见不同规格网袋内同种凋落物分解主场效应强度存在差异。0.02mm网袋内可快速粉碎凋落物的线虫很少,凋落物分解主场效应主要是由微生物的特化作用引起的,微生物很容易降解凋落物中碳水有机化合物等易分解物质,但随着凋落物分解难度加大,微生物作用开始淡化,导致土壤微生物特化程度很低[1,33]。而0.1mm网袋中凋落物分解主场效应是由微生物和线虫共同驱动,凋落物质量较低是主场效应强度差异的主要条件之一,低质量凋落物中木质素、纤维素等不易被分解的物质含量较高,其分解时,微生物会破碎其表皮,使线虫进入内部并摄食,导致凋落物碎片化,进而促进微生物进一步分解,使凋落物内复杂的有机物转化为简单的无机小分子[31],土壤生物特化程度会增大。因此,0.1mm网袋内凋落物具有更强的主场效应。此外,土壤生物的组成和分布通常与土壤温度、湿度、构成及外界环境变化密切联系[34-35]。土壤生物的特化作用和快速调整均需要适宜的光照、温度和水含量。研究发现,6月和9月水热条件优于3月,适于土壤生物生存,而主场线虫与土壤结构、环境相宜,导致主场线虫群落多样性高,更利于其驱动凋落物分解的主场效应。3月寒冷、缺水和荫蔽的环境在一定程度上都减弱土壤生物对凋落物的矿化速率,进而弱化主场效应,甚至使主场效应强度产生负值。
3.2 凋落物分解速率特征分析
3.3 凋落物养分释放特征分析
3.4 土壤线虫群落特征与凋落物分解的相关性分析
4 讨论

