几种盐溶液中质子守恒的推导及其应用
黄绍椿
(江西省高安中学,江西 高安)
电解质溶液普遍存在着电荷守恒、物料守恒及质子守恒三大守恒关系,它们是进行电解质溶液中粒子浓度比较的重要依据。电荷守恒和物料守恒相对容易推导,而质子守恒推导则较难。什么是质子守恒?是指在电离或水解过程中,会发生质子(H+)转移,但在质子转移过程中其数量保持不变。本文主要介绍了几种盐溶液中的质子守恒的推导及其应用。
一、几种盐溶液中质子守恒的推导
1.强碱弱酸盐溶液
以Na2CO3溶液为例,可用画图法推导质子守恒:
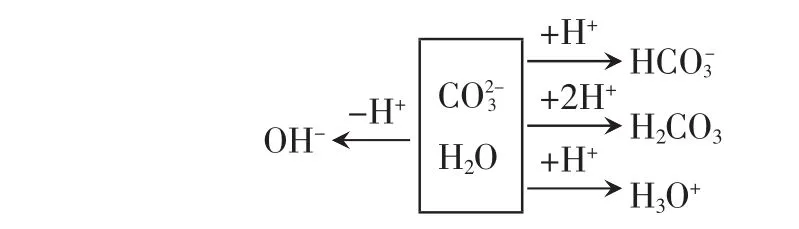
所以 c(OH-)=c(HCO-3)+2c(H2CO3)+c(H3O+)
即 c(OH-)=c(HCO-3)+2c(H2CO3)+c(H+)
2.强酸弱碱盐溶液
以NH4Cl溶液为例,可用画图法推导质子守恒:
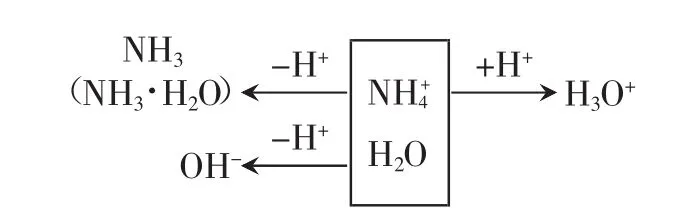
所以 c(OH-)+c(NH3·H2O)=c(H3O+)
即 c(OH-)+c(NH3·H2O)=c(H+)
3.弱酸弱碱盐溶液
以CH3COONH4溶液为例,可用画图法推导质子守恒:
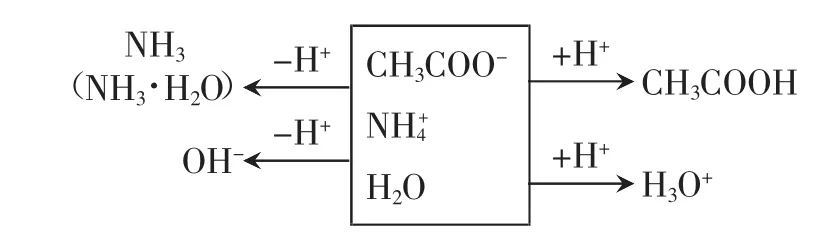
所以 c(NH3·H2O)+c(OH-)=c(CH3COOH)+c(H3O+)
即 c(NH3·H2O)+c(OH-)=c(CH3COOH)+c(H+)
4.混合盐溶液
混合溶液,质子守恒式一般由电荷守恒式和物料守恒式推导出来。
以物质的量1∶1的Na2CO3、NaHCO3混合溶液为例。
将 c(Na+)消去得质子守恒式:2c(OH-)=c(HCO-3)+3c(H2CO3)
二、质子守恒在电解质溶液中的一些应用。
举例:(2016·天津理综,6)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为 0.1 mol·L-1的三种酸(HA、HB 和 HD)溶液,滴定曲线如图所示。下列判断错误的是 ( )
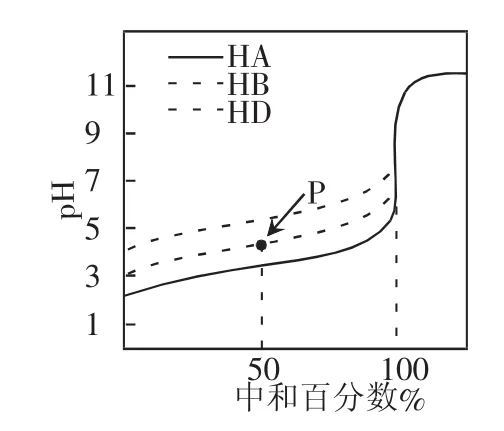
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至 P 点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7 时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
【答案】C
【解析】A 项,在未滴加 NaOH 溶液时,0.1 mol·L-1的三种酸(HA、HB和HD)溶液的pH均大于1,说明三种酸均为弱酸,且HA的pH最小、酸性最强,HD的pH最大、酸性最弱,因酸性越强,电离常数越大,故 KHA>KHB>KHD,正确;B 项,滴定至 P 点时,溶液中未反应的HB与生成的NaB的浓度相等,且溶液呈酸性,说明 HB 的电离程度大于 B-水解程度,故 c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),正确;C 项,pH=7 时,三种离子的浓度分别等于 c(Na+),然而三种溶液中阴离子水解程度不同,加入NaOH溶液的体积不同,故三种阴离子的浓度也不同,错误;D项,当中和百分数达100%时,正好生成NaA、NaBH和NaD,三种溶液混合后溶液的质子守恒要由电荷守恒和物料守恒推导,过程如下:
电荷守恒:c(Na+)+c(H+)=c(A-)+c(B-)+c(D-)+c(OH-),物料守恒:c(Na+)=c(A-)+c(B-)+c(D-)+c(HA)+c(HB)+c(HD),将 c(Na+)消去得:质子守恒式:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),正确。故选 C。
小结:质子守恒在电解质溶液中的一些应用,要注意分析溶质是单一溶液还是混合溶液,如果是单一溶液,则质子守恒式既可由画图法推导也可由电荷守恒式和物料守恒式推导出来。如果是混合溶液,则质子守恒式一般由电荷守恒式和物料守恒式推导出来。

