低分子肝素钙对小鼠胚胎着床的干预作用及机制研究
杨 文,杨 艳,吴晓燕,王 芳,孙 倩,高 原,张欢欢,冯 文*,马 宁
(1. 江苏省连云港第一人民医院,江苏 连云港 222000; 2.海南省妇幼保健院生殖医学中心,海口 570206)
胚胎着床是胎生哺乳动物生殖过程中决定妊娠是否成功的关键所在。胚胎着床主要包括定位、黏着、侵入3个步骤,囊胚在一定位置靠近内膜,并被安置在子宫角腔中某个适当的位置,接着囊胚滋养层细胞黏着能力增强,使囊胚进一步贴紧子宫内膜,最后囊胚滋养层细胞通过分泌某种物质使之侵入内膜基质。该过程是由细胞因子、黏着分子、性激素等多种分子通路所介导[1-2]。临床上,低分子肝素钙(low molecular weight heparin calcium, LMWHC)常用于复发性流产以及反复着床失败患者的治疗,并认为与LMWHC抗血栓抗凝作用有关[3-4]。本研究通过构建妊娠小鼠模型,探讨LMWHC对小鼠胚胎着床的影响,并从细胞分子水平上分析LMWHC的可能作用机制,现报道如下。
1 材料和方法
1.1 实验动物
24只8~10周龄成熟未育的清洁级雌性昆明小鼠购于苏州新药研究中心有限公司[SCXK(苏)2013-0003],体重30-35 g,实验动物饲养于苏州市立医院动物中心实验室[SYXK(苏)2017-0043],室温环境恒定温度为25℃,每12 h 黑暗光照条件循环交替,动物摄食和饮水自由,福利伦理审查证号201711A。动物实验过程中遵循3R原则。
1.2 主要试剂与仪器
DMEM/F12 液体培养基购自Hyclone公司(美国);胎牛血清、青链霉素混合液购自于Life Technologies公司(美国);胰蛋白酶购自于Sigma公司(美国);鼠抗人细胞角蛋白(cytokeratin,CK7)、波形蛋白(Vimentin,V9)单克隆抗体以及免疫组织化学试剂盒购自于北京中杉生物试剂公司;基质金属蛋白酶-2 (matrix metalloproteinases-2, MMP-2)和金属蛋白酶抑制因子-2(Tissue Inhibitor of Metalloproteinase-2,TIMP-2)ELISA试剂盒购自于ADL公司(美国);Transwell小室购自于Corning公司(美国);Matrigel购自于BD公司(美国);二氧化碳培养箱购自于FORMA公司(美国);OLYMPUS BX50 生物显微镜购自于OLYMPUS 公司(日本)。
1.3 实验方法
1.3.1 动物模型的建立与材料收集
按2∶1的比例与成年雄性小鼠合笼交配,次日对雌性小鼠阴道进行检查,将检出阴栓的小鼠视作妊娠D1。将妊娠小鼠随机分为对照组和LMWHC组,每组各12只,LMWHC组小鼠按1000 U/kg腹腔注射LMWHC,对照组腹腔注射等量生理盐水。妊娠D6时(6只孕鼠),尾静脉注射1%台盼蓝 100 μL,5 min 后处死孕鼠(颈椎脱臼法),取出子宫,观察子宫形态,记录小鼠子宫蓝色着床位点数。妊娠D9时(6只孕鼠),着床点肉眼可见,直接处死,记录小鼠子宫着床位点数。统计着床位点数,计算每组小鼠着床位点平均数。
1.3.2 滋养层细胞的原代培养及鉴定
另外选取妊娠D14的小鼠,颈椎脱臼法处死后分离胎盘组织,无菌盐水清洗后将其剪碎,采用Zhou WH改良法[5]分离纯化滋养层细胞。将滋养层细胞悬液浓度调整至每孔3×108个接种于放置有载玻片的6孔板内培养,培养基为含10%胎牛血清和双抗(链霉素、青霉素)的DMEM/F12。待细胞生长至80%时,取出载玻片,PBS清洗3次后固定10 min,再次清洗3次,然后用3% H2O2去离子水孵育10 min,清洗后室温封闭30 min。加入一抗(CK-7抗体、V9抗体以及PBS代替一抗作为阴性对照)低温孵育过夜,PBS清洗3次后,加入二抗,室温孵育60 min,PBS清洗3次后,经显色、复染、脱水、透明等步骤后封片,并观察拍照,计算阳性细胞率和阴性细胞率。
1.3.3 Transwell实验
预先将Matrigel包被在Transwell板滤膜表面,上室中加入浓度为每孔2×105个的滋养层细胞,分别采用1×102IU/L、1×103IU/L和1×104IU/L 浓度的LMWHC干预,不加LMWHC的细胞作为对照,下室中加入含10%胎牛血清的DMEM/F12培养基800 μL,在37℃、5%CO2培养箱中静置24 h,然后取出,将上室滤膜内表面的细胞擦拭干净,将滤膜下表面的细胞固定,经瑞士染色后,在高倍镜(×200)下观察,每孔随机选择5个视野进行计数,每次不同LMWHC干预浓度以及对照设置3个复孔,实验重复3次。
1.3.4 上清液中MMP-2和TIMP-2浓度检测
将浓度为每孔3×108个的滋养层细胞接种于6孔板内,培养箱内静置30 min后,分别采用1×102IU/L、1×103IU/L和1×104IU/L 浓度的LMWHC干预,不加LMWHC的细胞作为对照,37℃、5%CO2培养箱中静置24 h后收集上清,采用ELISA法检测上清中MMP-2和TIMP-2水平。

注:A:子宫形态图;B:胚胎着床点数统计。与对照组比较,*P<0.05。图1 小鼠胚胎着床点数Note. A:Uterine morphogram; B:Embryo implantation count. Compared with the control group, *P<0.05.Figure 1 Number of mouse embryo implantation sites
1.3.5 Western blot实验
细胞蛋白提取后按配方配制SDS-PAGE胶进行电泳,待溴酚蓝接近电泳槽底部时停止电泳,在电压15 V,时间1.5 h,将蛋白转移至PVDF膜上,孵育一抗、孵育二抗,0.1% TBST漂洗PVDF膜,按1∶1等比例去ECL发光液A液和B液混合,在Alpha FluorChem Q 凝胶成像系统下曝光并成像,保留图片后用于统计分析。蛋白条带灰度值半定量分析:用Image J软件对拍照下的蛋白条带进行灰度值测定。以目的蛋白条带灰度值/β-actin条带灰度值来校正上样量的偏差,用二者灰度比值的高低表示各样本目的蛋白表达量的多少。
1.3.6 逆转录PCR(RT-PCR)实验
采用Trizol法并利用TIANGEN® RNA simple Total RNA Kit总RNA提取试剂盒,提取总RNA,按照StarScript II First-strand cDNA Synthesis Mix 试剂盒操作说明进行反转录。采用GenStar 2×Taq PCR Mix with Loading Dye 试剂盒加入引物进行扩增,反应结束用2.1% 凝胶电泳。MMP-2引物序列,Forward primer:5’-CGCTCAGATCCGTGGTGAGAT-3’;Reverse primer:5’-CGGGAGCTCAGGCCAG AATG-3’,扩增片段310 bp;TIMP-2引物序列,Forward primer:5’-CTCGCTGGACGTTGGAGGAAAG AA-3’,Reverse primer:5’-AGCCCATCTGGTACC TGTGTTCA-3’,扩增片段150 bp;内参β-actin引物序列:Forward primer:5’-ATATCGCTGCCGCTGGTC GTC-3’;Reverse primer:5’-AGGATGGCGTGAG GGAGACC-3’,扩增片段517 bp。PCR反应条件:94℃ 2 min,94℃ 30 s,60℃ 30 s,72℃ 1 min,72℃ 5 min,4℃ 延伸,共计35个循环。反应结束后用2.1% 琼脂糖凝胶电泳检测PCR结果。
1.4 数据分析
2 结果
2.1 LMWHC对小鼠胚胎着床的影响
取妊娠D6和D9的小鼠子宫,记录各小鼠胚胎着床位点数,结果显示,LMWHC组妊娠D6和D9的着床位点数均多于对照组,差异有显著性(P<0.05),见表1和图1。

表1 两组胚胎着床位点数比较Table 1 Comparison of embryo implantation sites in two groups
2.2 小鼠滋养层细胞鉴定
经免疫细胞化学DAB实验,结果发现大多数贴壁生长的细胞为CK7阳性,细胞CK7阳性率为(94.83±3.15)%,大多数细胞为V9阴性,细胞V9阴性率为(91.18±2.87)%,见图2。
2.3 LMWHC对小鼠滋养层细胞侵袭力的影响
用1×102IU/L、1×103IU/L和1×104IU/L 浓度的LMWHC干预滋养层细胞24 h后,Transwell实验结果显示,各组细胞侵袭细胞数分别为(84.83±14.15)个、(162.48±25.49)个、(98.73±12.77)个,与未用LMWHC干预细胞的(65.27±13.92)个比较,差异有显著性(P<0.05),见图3。
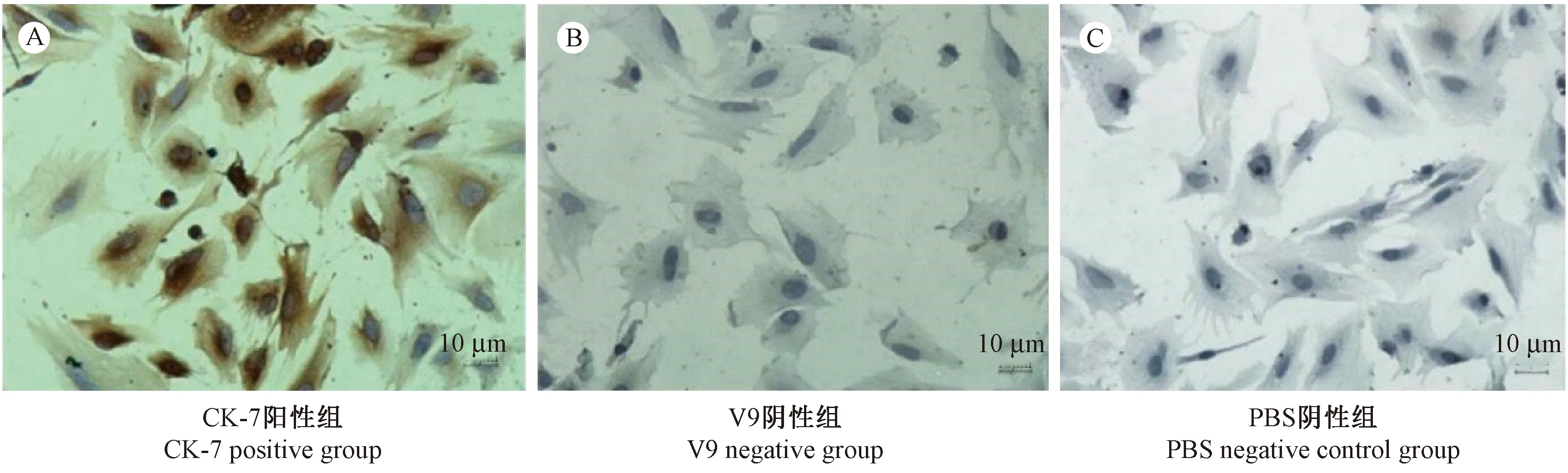
图2 小鼠滋养层细胞免疫细胞化学结果(×200)Figure 2 Morphology of the mouse trophoblast cells.Immunohgistochemical staining.

注:A:不同浓度LMWHC干预滋养层细胞24 h后Transwell实验(×200)。B:不同浓度LMWHC干预滋养层细胞24 h后侵袭细胞数统计。与对照组比较,*P<0.05。图3 LMWHC对小鼠滋养层细胞侵袭力的影响Note. A: Transwell assay after 24 h of different concentrations of LMWHC on trophoblast cells(×200). B: Statistics of invading cells in trophoblast cells after 24 h of different concentrations of LMWHC. Compared with the control group, *P<0.05.Figure 3 Effects of LMWHC on the invasiveness of mouse trophoblast cells
2.4 LMWHC对小鼠滋养层细胞中细胞因子的影响
用1×102IU/L、1×103IU/L和1×104IU/L 浓度的LMWHC干预滋养层细胞24 h后,滋养层细胞上清液中MMP-2表达水平较未用LMWHC干预的细胞均升高,差异有显著性(P<0.05),当LMWHC干预浓度为1×103IU/L时,MMP-2表达水平最高。滋养层细胞上清液中TIMP-2表达水平随着LMWHC干预浓度的升高而降低,LMWHC干预浓度为1×103IU/L和1×104IU/L时,与未用LMWHC干预的细胞比较,差异有显著性(P<0.05),见图4。

注:A:不同浓度LMWHC干预小鼠滋养层细胞后,培养基上清中MMP-2的表达水平。B:不同浓度LMWHC干预小鼠滋养层细胞后,培养基上清中TIMP的表达水平。与对照组比较,*P<0.05。图4 LMWHC对小鼠滋养层细胞培养基上清中MMP-2和TIMP的影响Note. A: Expression level of MMP-2 in the supernatant of culture medium after different concentrations of LMWHC on mouse trophoblastic cells. B: Expression level of TIMP in supernatant of culture medium after different concentrations of LMWHC on mouse trophoblastic cells. Compared with control group, *P<0.05.Figure 4 Effects of LMWHC on MMP-2 and TIMP in the supernatant of culture medium of mouse trophoblast cells
2.5 LMWHC对小鼠滋养层细胞MMP-2和TIMP-2蛋白水平表达的影响
LMWHC不同浓度干预滋养层细胞24 h后,滋养层细胞上清液中MMP-2表达水平较未用LMWHC干预的细胞均升高(P<0.05),当LMWHC干预浓度为1×103IU/L时,MMP-2表达水平最高。滋养层细胞上清液中TIMP-2表达水平随着LMWHC干预浓度的升高而降低,LMWHC干预浓度为1×103IU/L和1×104IU/L时,与未用LMWHC干预的细胞比较,差异有显著性(P<0.05),见图5。

注:A:不同浓度LMWHC干预小鼠滋养层细胞后,培养基上清中MMP-2的表达水平。B:不同浓度LMWHC干预小鼠滋养层细胞后,培养基上清中TIMP的表达水平。与对照组比较,*P<0.05。图5 LMWHC对小鼠滋养层细胞培养基上清中MMP-2和TIMP的影响Note. A: Expression level of MMP-2 in the supernatant of culture medium after different concentrations of LMWHC on mouse trophoblastic cells.B: Expression level of TIMP in the supernatant of culture medium after different concentrations of LMWHC on mouse trophoblastic cells. Compared with the control group, *P<0.05.Figure 5 Effects of LMWHC on MMP-2 and TIMP in supernatant of culture medium of mouse trophoblast cells
2.6 LMWHC对小鼠滋养层细胞MMP-2和TIMP-2 mRNA水平表达的影响
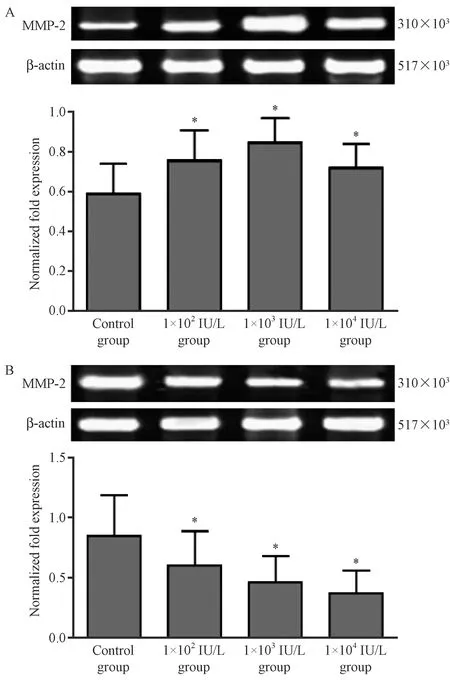
注:A:不同浓度LMWHC干预小鼠滋养层细胞后,培养基上清中MMP-2 mRNA表达水平。B:不同浓度LMWHC干预小鼠滋养层细胞后,培养基上清中TIMP mRNA表达水平。与对照组比较,*P<0.05。图6 LMWHC对小鼠滋养层细胞培养基上清中MMP-2和TIMP的影响Note. A: MMP-2 mRNA expression level in the supernatant of culture medium after different concentrations of LMWHC on mouse trophoblast cells. B: TIMP mRNA expression level in the supernatant of culture medium after different concentrations of LMWHC on mouse trophoblastic cells. Compared with the control group, *P<0.05.Figure 6 Effects of LMWHC on MMP-2 and TIMP in supernatant of culture medium of mouse trophoblast cells
LMWHC不同浓度干预滋养层细胞24 h后,滋养层细胞上清液中MMP-2 mRNA表达水平较未用LMWHC干预的细胞均升高(P<0.05),且当LMWHC干预浓度为1×103IU/L时,MMP-2表达水平最高。滋养层细胞上清液中TIMP-2表达水平随着LMWHC干预浓度的升高而降低,LMWHC干预浓度为1×103IU/L和1×104IU/L时,与未用LMWHC干预的细胞比较,差异有显著性(P<0.05),见图6。
3 讨论
生殖是物种繁衍的重要生理过程,而相对低效率的妊娠对生殖造成严重影响。正常育龄期女性每个排卵周期妊娠成功的几率仅在30%左右,妊娠失败的原因主要为胚胎着床失败[6]。尽管现代的体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)技术为不孕患者提供了妊娠机会,但IVF-ET的着床率也仅20%~30%,胚胎着床失败仍是当前生殖医学的难题之一[7]。胚胎着床是否成功主要与影响配子或胚胎发育的因素、影响子宫内膜容受性的因素、影响子宫的全身因素有关[8]。
LMWHC是肝素经化学解聚或在酶的作用下产生的小分子片段,可通过抑制凝血因子Ⅱa和凝血酶Ⅹa活性发挥抗凝作用,同时对血管内皮细胞具有保护作用,使血液粘稠度降低,从而增加胎盘血液供应,改善胎盘微循环,有利于胚胎生长发育[9-10]。在产科中多用于妊娠合并症、复发性流产的治疗,且应用于IVF-ET多次失败患者,可有效改善妊娠结局[11-13]。
为探讨LMWHC对胚胎着床的影响及其作用机制,本研究构建了妊娠小鼠模型,给予LMWHC干预,结果发现,LMWHC组妊娠D6和D9小鼠的着床位点数均多于对照组,差异有显著性(P<0.05),提示LMWHC对胚胎着床具有促进作用。滋养细胞源于胚胎外的滋养层,可分化为胎盘和胎膜。滋养细胞在胎盘着床过程中分化为2个不同亚群,即绒毛膜滋养细胞和绒毛膜外滋养细胞。其中绒毛膜外滋养细胞能通过母体蜕膜和子宫血管的侵入降解并重建子宫内膜组织结构。滋养细胞侵入子宫内膜不足会影响胚胎着床以及胎盘血管重塑,导致各种妊娠期并发症以及胎儿发育迟缓、流产、死胎发生[14-15]。Chen[16]等人发现LMWH对孕早期滋养层细胞的侵袭能力具有调节作用,2.5×102IU/L和2.5×103IU/L组滋养层细胞侵袭能力明显增强,2.5×104IU/L和2.5×105IU/L组滋养层细胞侵袭能力则受到抑制。但Quenby[17]等人研究结果显示,无论是2.5×102IU/L还是2.5×103IU/L的LMWH对滋养层细胞侵袭能力均无明显作用。鉴于此,本研究对小鼠滋养层细胞进行分离培养,并采用不同浓度LMWHC处理细胞,结果发现,当不同浓度LMWHC处理后,滋养层细胞的侵袭力均明显增强,且在LMWHC浓度为1×103IU/L时最强,提示一定浓度范围内的LMWHC可通过增强滋养层细胞侵袭力而促进胚胎着床。不同研究结果存在差异,可能与选取样本、实验方法或取样部位不同有关。
滋养层细胞的侵袭力主要受其分泌的MMPs调节,MMP-2是妊娠早期滋养细胞分泌的最主要蛋白酶,可将子宫内膜细胞外基质中的IV型胶原降解,促进滋养细胞侵入。TIMP是MMP的抑制物,两者的相互制约对于滋养细胞侵袭力的控制起到重要作用[18-19]。Chen[16]等人虽指出LMWHC可调节孕早期滋养层细胞的侵袭能力,但未对其调节机制进一步探索,本研究采用不同浓度LMWHC处理小鼠滋养层细胞,通过ELISA法、Western blot和RT-PCR检测细胞上清液中MMP-2和TIMP-2的蛋白和mRNA水平表达情况,结果显示采用LMWHC处理的细胞上清中MMP-2表达水平较未处理细胞明显上升,而TIMP-2表达水平较未处理细胞明显下降,以上结果提示LMWHC可能是通过上调MMP-2表达同时下调TIMP-2表达而增强滋养层细胞侵袭力。
综上所述,LMWHC对小鼠胚胎着床具有积极作用,其机制可能与LMWHC调控MMP-2和TIMP-2表达,进而增强滋养层细胞侵袭力有关。当然,影响滋养层细胞侵袭力的因素众多,LMWHC是否与其他细胞因子的表达以及信号通路有关,还需进一步研究。

