右美托咪啶对人宫颈癌细胞Hela生长和转移能力的影响
,,
(1.西安交通大学第二附属医院麻醉科,陕西 西安 710004;2.安康市中医医院麻醉科,陕西 安康725000)
宫颈癌是女性常见的恶性肿瘤,发病率占女性癌症发病率的第二位,并且呈逐年上升的趋势[1]。每年全球宫颈癌的新发病例可高达50万人,每年有超过27万女性死于宫颈癌[2]。虽然近年来癌症诊疗水平提高,宫颈癌的病死率有所降低,但仍是导致发展中国家女性死亡的重要原因[3]。腹腔镜手术是目前治疗宫颈癌的最主要方法,但术后复发率仍然较高[4]。研究表明,癌细胞转移是导致宫颈癌复发的重要原因[5]。因此,有效减少手术过程中癌细胞的转移可能有利于降低宫颈癌的复发率。右美托咪啶(dexmede-tomidine,Dex)是一类脂溶性的α2肾上腺素激动剂,具有镇静、止痛及血流动力学效应,是临床常用的手术麻醉辅助用药[6-7]。有研究表明,吗啡、丙泊酚等麻醉药会影响癌症的发展[8-9]。还有研究发现Dex也能调控乳腺癌细胞的增殖及转移,但Dex对宫颈癌细胞生长和转移能力的影响还未见报道[10]。因此,本文采用不同浓度的Dex处理宫颈癌Hela细胞,以探究Dex对宫颈癌细胞生长及转移的作用及机制。
1 材料与方法
1.1 主要试剂
Dex购自江西恒瑞医药公司 (生产批号:13120134)。人宫颈癌细胞系Hela细胞由中国科学院上海细胞库提供。RPMI 1640培养液和胎牛血清购自美国Gibco公司。CCK8试剂盒、Hoechst染色剂和RIPA裂解液购自北京索莱宝生物公司;Transwell小室和Matrigel购自美国Millipore公司。Ki67、Caspase-3、血管内皮生长因子(vascular endothelial growth factor,VEGF)、磷酸肌醇3激酶(phosphatidy inositol 3-kinase,PI3K)、p-PI3K、Akt和p-Akt一抗购自英国Abcam公司,山羊抗兔和山羊抗小鼠二抗购自北京博奥森生物公司。
1.2 细胞分组及给药
用含有10%胎牛血清的RPMI 1640培养液将人宫颈癌Hela细胞培养于37 ℃、5%CO2的细胞恒温培养箱中,隔天换液,细胞融合率达到80%以上时进行传代培养。将细胞随机分为Hela组、Dex(1 μM) 组、Dex(2 μM) 组和Dex(5 μM) 组,每组6个复孔,并分别加入0,1,2,5 μM的Dex处理细胞,24 h后进行检测。
1.3 CCK8检测细胞增殖
将细胞接种于96孔板内,接种密度为1×104个/mL。待细胞贴壁后将细胞随机分为Hela组、Dex(1 μM) 组、Dex(2 μM) 组和Dex(5 μM) 组,加入相应浓度的Dex分别处理0 h、24 h、48 h、72 h和96 h后,根据CCK8试剂盒说明书检测各组细胞的细胞活性。
1.4 Hoechst染色检测细胞凋亡
将用不同浓度Dex处理后的细胞弃去培养液,并用磷酸盐缓冲液清洗3次,加入4%多聚甲醛室温固定细胞30 min,随后弃去多聚甲醛并洗净,加入少量Hoechst染色液,以覆盖底部细胞为宜,室温染色30 min后,弃染色液,用磷酸盐缓冲液清洗3次,于荧光显微镜下观察细胞凋亡情况。
1.5 Transwell检测细胞侵袭能力
将Hela细胞以1×105个/mL的密度接种于Transwell小室上层,并用含有不同浓度Dex的无血清培养液培养细胞,小室下层则加入正常培养液进行培养,24 h后用结晶紫对侵袭到小室下层的细胞进行染色,于显微镜下拍照记录。
1.6 划痕实验检测细胞迁移能力
实验前用灭菌的Maker笔于12孔板背面每孔划5条平行直线,灭菌后备用。将细胞接种于12孔空板内,密度为1×105个/mL,待细胞贴壁后,用10 μL的枪头垂直于培养板背面直线划痕,用缓冲液洗去悬浮细胞,将培养液更换为含有不同浓度Dex的无血清培养液继续培养,于0 h和24 h拍照记录,计算各组细胞的划痕闭合率 ,划痕闭合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度。
1.7 Western blot检测蛋白表达
用RIPA裂解液提取各组细胞蛋白,用BCA试剂盒检测各组细胞总蛋白浓度并调平,取等量蛋白用10% SDS-PAGE分离蛋白质并采用半干法将蛋白质转移到PVDF膜,加入5% BSA室温封闭蛋白质2 h,随后加入一抗于4 ℃封闭过夜。第2天用缓冲液洗去未结合一抗,加入二抗室温孵育1 h后,洗去未结合二抗并滴加化学发光显色液于暗室曝光显影,以GAPDH为内参,用ImageJ对蛋白质条带灰度值进行半定量分析。
1.8 统计学分析

2 结果
2.1 Dex对宫颈癌Hela细胞生长的影响
用Dex处理细胞4 d后,与Hela组细胞比较,Dex(1 μM)组、Dex(2 μM) 组和Dex(5 μM)组细胞增殖速度均明显降低(P<0.05,P<0.01),见图1;同时,Dex(1,2,5 μM) 组细胞凋亡率也显著高于Hela组(P<0.05,P<0.01,P<0.01),进一步表明Dex能抑制Hela细胞存活(图2);此外,Dex(1,2,5 μM)还能显著降低Hela细胞增殖相关蛋白Ki67的表达水平(P<0.01),升高细胞凋亡相关蛋白Caspase-3的蛋白表达水平 (P<0.05,P<0.01,P<0.01),进一步表明Dex能抑制Hela细胞生长(图3)。
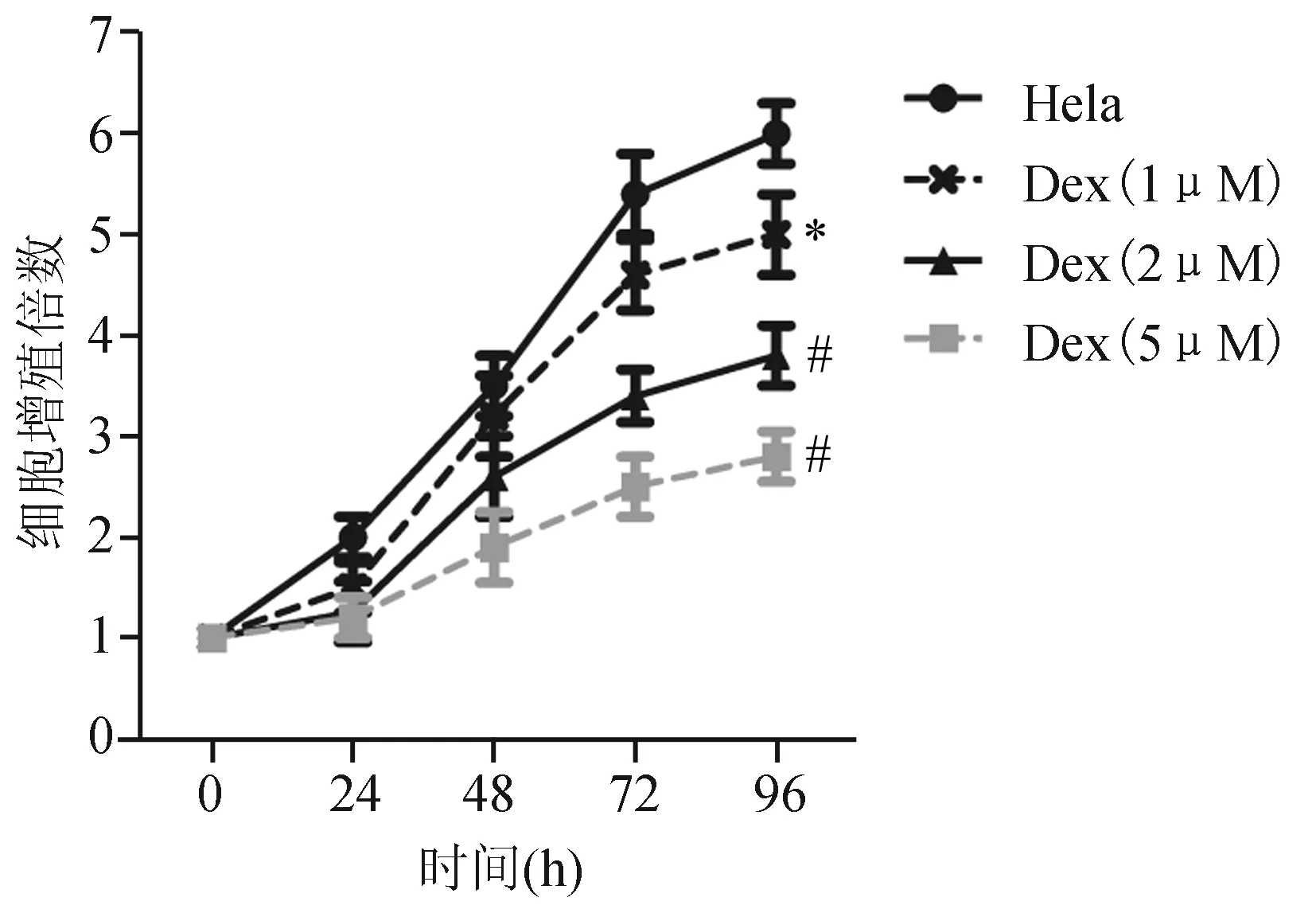
*:与Hela组比较,P<0.5;#:与Hela组比较,P<0.01
2.2 Dex对PI3K/Akt信号通路的影响
Western blot实验结果表明,Dex(1,2,5 μM) 能抑制p-PI3K和p-Akt的表达,显著降低p-PI3K/PI3K和p-Akt/Akt的比值(P<0.01),并随浓度升高作用逐渐增强,表明Dex能抑制Hela细胞PI3K/Akt通路的激活(图4)。
2.3 Dex对宫颈癌Hela细胞转移的影响
与Hela组比较,Dex(1,2,5 μM)组侵袭细胞数明显减少,并具有量效关系(P<0.01),见图5;如图6所示,Dex(2,5 μM)还能显著抑制Hela细胞迁移(P<0.01),提示Dex能降低Hela细胞的转移能力;此外,Dex(1,2,5 μM)还能显著降低Hela细胞VEGF的蛋白表达水平(P<0.01),进一步表明Dex具有抑制Hela细胞转移的能力(图3)。

a:Hoechst染色结果;b:细胞凋亡率统计 *:与Hela组比较,P<0.05;#:与Hela组比较,P<0.01

a:Western blot图片;b:蛋白表达水平 *:与Hela组比较,P<0.05;#:与Hela组比较,P<0.01
图3Dex对Ki67、Caspase-3和VEGF表达的影响

a:Western blot图片;b:蛋白表达水平 *:与Hela组比较,P<0.01

a:结晶紫染色结果;b:细胞侵袭数目统计 *:与Hela组比较,P<0.01

a:划痕实验检测结果;b:划痕闭合率 *:与Hela组比较,P<0.01
3 讨论
宫颈癌是导致女性死亡的主要原因之一,虽然目前有很多抗癌的新药和方法能减缓宫颈癌的发展,但其副作用使癌症患者的生活质量下降,且病死率并未出现降低的趋势[11]。手术切除是临床治疗癌症的常用方法,手术期是影响癌症预后的一个重要时期[12]。近年来的研究表明,手术期的操作不当会增加癌症的术后复发率,同时,麻醉药的正确使用能有效降低手术期间癌细胞转移的风险[13-14]。Zhang等[15]的研究表明,麻醉药物丙泊酚能有效抑制乳腺癌MCF7和MDA-MB-231细胞系细胞的转移,并抑制细胞转化基因1的表达,还能通过调控mTOR信号通路诱导宫颈癌细胞凋亡[16]。Dex是临床常用的麻醉辅助用药,能增强布比卡因等麻醉药物的麻醉效果,并能有效降低其副作用,但其对癌症的作用还较少见报道[17]。本研究采用不同浓度的Dex处理人宫颈癌Hela细胞,并检测细胞的生长及转移能力以探究Dex对宫颈癌的作用。
细胞无限增殖及凋亡抑制是导致癌症发生及发展的主要原因。抑制癌细胞增殖和诱导癌细胞凋亡是目前癌症化疗和放疗的主要机制,抑制癌细胞增殖及促进癌细胞凋亡能有效减缓癌症的发展,延长癌症患者的存活时间[18]。研究表明,Dex能通过抑制p38MAPK/NF-κB信号通路激活提高卵巢癌大鼠的自身免疫功能,从而抑制卵巢癌细胞增殖和转化,提示Dex可能具有一定的抗癌活性[19]。本研究发现,用Dex处理Hela细胞4 d后,Hela细胞增殖速度明显降低,并随Dex浓度的升高作用逐渐增强。Ki67是细胞增殖有丝分裂期间表达的一类蛋白,因此常被用作细胞增殖的标志性蛋白[20]。本研究显示,Dex还能显著抑制细胞增殖相关蛋白Ki67的表达,提示Dex能抑制宫颈癌Hela细胞增殖。此外,Dex还能显著增加Hela细胞的凋亡率,并上调细胞凋亡相关蛋白Caspase-3的表达,表明Dex能促进Hela细胞凋亡,从而降低宫颈癌Hela细胞的生长能力。
癌细胞转移是癌症恶化和术后癌症复发的主要原因。据报道,出现癌细胞转移的患者5年生存率仅有25%,因此有效降低癌细胞的转移能力是降低癌症复发率和减缓癌症恶化的关键[21]。癌细胞转移是由多种细胞因子调控的过程,如基质金属蛋白酶、VEGF等[22]。其中VEGF是血管新生相关蛋白,能够促进新血管的形成。研究表明,新血管形成是癌细胞转移的第一步,新形成的血管能为转移的癌细胞提供充足的氧气和营养成分[23]。此外,VEGF还能促进细胞外基质的降解,从而促进癌细胞的转移,因此常被作为癌细胞转移的标志蛋白[24]。本研究发现,Dex能降低Hela细胞VEGF的表达水平,同时还能显著减少侵袭细胞,降低Hela细胞的划痕闭合率,提示Dex能抑制Hela细胞的侵袭和转移,从而降低Hela细胞的转移能力。
PI3K/Akt信号通路是调控细胞增殖、凋亡、分化和转移的重要信号通路之一。同时,PI3K/Akt信号通路在调控癌细胞及肿瘤的生长过程中起到了关键作用[25]。抑制PI3K/Akt信号通路激活能抑制宫颈癌细胞的增殖、侵袭和迁移,从而减缓宫颈癌的发展[26]。研究表明,Dex能通过促进PI3K/Akt信号通路的激活对抗缺血引起的脑损伤及肺损伤[27-28]。本研究发现,Dex能抑制Hela细胞p-PI3K和p-Akt的表达,降低p-PI3K/PI3K和p-Akt/Akt的比值,表明Dex能抑制宫颈癌Hela细胞PI3K/Akt信号通路的激活。
综上所述,Dex能降低Hela细胞的增殖速度和Ki67的表达水平,增加Hela细胞凋亡率和Caspase-3的表达水平;同时,Dex能降低Hela细胞侵袭数和划痕闭合率,降低VEGF的表达水平;此外,Dex还能降低p-PI3K/PI3K和p-Akt/Akt的比值,表明Dex可能通过抑制PI3K/Akt信号通路的激活抑制Hela细胞增殖、侵袭和迁移,促进Hela细胞凋亡,从而降低Hela细胞的生存和转移能力。本研究探讨了Dex对宫颈癌Hela细胞的作用,可能为降低宫颈癌术后复发率提供了一种新的潜在药物。

