棕榈酸通过上调Wnt5a基因表达抑制胰岛β细胞瘤INS-1细胞增殖
吴杏儿,孙世珺,郑 磊
(1.广东省中山市人民医院分子诊断中心 528403;2.南方医科大学南方医院检验科,广州 510515)
胰岛β细胞受损是2型糖尿病(T2DM)的特征之一[1]。血循环中游离脂肪酸(FFAs)升高可引起胰岛β细胞数量明显减少[2]。体外实验发现,FFAs对啮齿类动物及人的胰岛β细胞同时产生诱导凋亡及抑制增殖的效应[2-3]。迄今已有大量研究阐释FFAs如何诱导胰岛β细胞凋亡,如FFAs激活神经酰胺通路、引起线粒体膜损伤等机制已被证实与β细胞凋亡关系紧密[3-4]。然而,FFAs抑制胰岛β细胞增殖的机制尚不明确。进一步研究FFAs抑制胰岛β细胞增殖的可能机制,有助于了解脂毒性参与糖尿病发生、发展的过程,以及为可能的药物开发甚至治疗策略改进提供依据。Wnt信号通路是一类参与调节器官发育、细胞有丝分裂等过程的重要信号通路,其不同层面的信号分子在胰腺组织中均有不同程度的表达[5]。目前鼠及人类Wnt配体家族成员已知的有19个,不同的Wnt蛋白亚型可起不同的生物学效应。笔者前期研究发现,Wnt5a亚型在β细胞系INS-1细胞及小鼠胰岛中基础表达丰度高,可通过激活钙调蛋白依赖蛋白激酶Ⅱ(CaMKⅡ)通路下调细胞周期蛋白D1(Cyclin D1)表达;此外,首次报道了Wnt5a是抑制β细胞增殖的重要调控基因[6]。有研究表明,Wnt5a与脂代谢紊乱密切相关[7]。然而Wnt5a是否参与介导脂毒性抑制β细胞增殖尚未明确。本实验利用饱和脂肪酸棕榈酸(PA)刺激大鼠胰岛β细胞系INS-1细胞,观察其对Wnt5a基因表达的调控作用,探讨PA抑制胰岛β细胞增殖的可能机制,为进一步理解脂毒性损伤β细胞及治疗糖尿病提供理论依据。
1 材料与方法
1.1 主要材料 大鼠胰岛β细胞瘤INS-1细胞[美国典型培养物保藏中心(ATCC)细胞库]。小牛血清和RPMI-1640培养基(美国Gibco公司);PA、牛血清蛋白(BSA)、2-巯基乙醇、4-羟乙基哌嗪乙磺酸(HEPES)、二甲基亚砜(美国Sigma公司);小干扰RNA(siRNA,广州吉捷生物科技有限公司);EdU试剂盒(锐博生物技术公司);转染试剂LipofectamineTM2000、PCR引物(美国Invitrogen公司);兔抗鼠Wnt5a抗体、兔抗鼠甘油醛-3-磷酸脱氢酶(GAPDH,14C10)抗体(美国Cell Signal Technology公司);辣根过氧化物酶标记IgG(弗德生物技术有限公司);Eastep通用型总RNA提取试剂盒、GoScriptTM反转录试剂盒、GoTaq®qPCR Master Mix(美国Promaga公司)。荧光定量PCR仪7500(美国ABI公司);倒置荧光显微镜(日本Olympus公司)。
1.2 方法
1.2.1 细胞培养及分组 大鼠胰岛β细胞瘤细胞INS-1培养在37 ℃、含5% CO2的培养箱,每100毫升细胞培养液含有10%小牛血清、1%青/链霉素双抗、2-巯基乙醇0.35 μL、碳酸氢钠0.2 g、10 μmol/L HEPES 0.1 mL。以含0.25%胰酶消化细胞传代,每隔24 h更换1次培养液。细胞分组:(1)EdU标记实验中细胞分为溶剂对照组(BSA组),200 μmol/L PA刺激24、48 h组,500 μmol/L PA刺激24、48 h组,1 000 μmol/L PA刺激24、48 h组;(2)实时荧光定量PCR(qRT-PCR)实验中细胞分为:溶剂对照组,200 μmol/L PA刺激1、6、12、24 h组,以及200、500、1 000 μmol/L PA刺激6 h组;(3)Western blot实验中细胞分为:溶剂对照组,200 μmol/L PA刺激1、3、6、12、24、36 h组,以及200、500、1 000 μmol/L PA刺激6 h组;(4)siRNA转染实验中细胞分为:转染无意义siRNA组(NC组)、转染siRNA-Wnt5a-1组、转染siRNA-Wnt5a-2组、转染无意义siRNA+500 μmol/L PA组、转染siRNA-Wnt5a-1+500 μmol/L PA组、转染siRNA-Wnt5a-2+500 μmol/L PA组(转染培养36 h后予 PA继续共培养24 h)。
1.2.2 EdU标记染色法检测细胞增殖率 细胞染色:细胞以4×104个/孔密度种植至铺有盖玻片的24孔板,细胞贴壁后更换培养基,进行转染或共培养,离观察终点2 h前往培养基中加入EdU溶液(终浓度为50 μmol/L),按试剂盒说明固定细胞、染色及铺片。细胞增殖率计数:使用倒置荧光显微镜,观察Appolo567染色使用550 nm激发光,观察Hoechst3342染色使用350 nm激发光,放大倍数为400倍。每复孔等分4象限,每个象限随机拍摄3张不同视野照片均计数,分别计算细胞核(Hoechst)及增殖细胞(Appolo)染色细胞数,Appolo/Hoechst比值为细胞增殖率,每复孔Hoechst染色阳性细胞计数大于1 000个。同组设3个复孔,取增殖率平均数及标准差。
1.2.3 脂质体法转染siRNA 按LipofectamineTM2000转染试剂盒操作说明,分别将含有1 μg无意义siRNA,Wnt5a-siRNA-1(5′-CAA GGA AUU CGU GGA CGC ACG AGA AdT d-3′,5′-UUC UCG UGC GUC CAC GAA UUC CUU GdT d-3′)及Wnt5a-siRNA-2(5′-GCA UCC UCA UGA ACU UGC ACA ACA AdT d-3′,5′-UUG UUG UGC AAG UUC AUG AGG AUG CdT d-3′)稀释液加入含无血清培养基的EP管中混匀,缓慢加至含1 μL LipofectamineTM2000的50 μL无血清培养基中,混匀后室温静置20 min形成转染复合物。使用转染复合物培养细胞6~8 h后吸出转染复合物,换含有血清的培养基继续培养,总培养时间为36 h。到达实验终点收集细胞用于Western blot检测或EdU标记染色进行细胞增殖率计数。
1.2.4 qRT-PCR检测Wnt5a表达水平 RNA转录为cDNA:按试剂盒说明柱提法冰面操作提对数生长期细胞总RNA,行反转录。按试剂盒说明进行反转录,反应条件:25 ℃退火5 min,延伸1 h,70 ℃灭活15 min。cDNA样本-20 ℃保存备用。RT-PCR反应体系:反应总体系为20 μL,包括反转录产物样品5 μL,无酶核酸水4 μL,正、反向引物各0.8 μL,Master Mix 2×10 μL。CXR100×0.2 μL。反应条件:95 ℃ 10 min,95 ℃ 15 s后60 ℃ 1 min(40个循环)。mRNA相对表达水平采用2-△△Ct方法计算,内标基因为β-actin。
1.2.5 蛋白质印迹法(Western blot)检测细胞Wnt5a的表达 按分组处理细胞,提取蛋白后用12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,转膜,4% BSA封闭2 h,PBS洗膜3次后加一抗(1∶1 000),4 ℃孵育过夜,洗膜3次加二抗(1∶5 000)室温孵育1 h,洗膜后于暗室中加入发光剂,显影后定影。以GAPDH为内参,Image J软件灰度扫描图像检测Wnt5a蛋白表达差异。
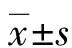
2 结 果
2.1 PA对INS-1细胞增殖的影响 EdU标记法检测不同浓度PA处理INS-1细胞24、48 h后细胞增殖率的变化,结果显示,与溶剂对照组相比,PA各浓度处理组或同一浓度不同时间组的细胞增殖率明显下降,差异有统计学意义(P<0.05), PA抑制INS-1细胞增殖具有浓度及时间依赖性,见图1。

A:EdU标记细胞增增率分析图;B:不同浓度PA处理细胞24 h后EdU标记染色图(×400);*:P<0.05,与溶剂对照组(0 h)比较
图1 PA对INS-1细胞增殖的影响
A:200 μmol/L PA处理细胞不同时间后Wnt5a mRNA表达水平;B:不同浓度PA处理细胞6 h后Wnt5a mRNA表达水平;*:P<0.05,与溶剂对照组比较
图2 PA对INS-1细胞Wnt5a mRNA转录水平的影响
2.2 PA对INS-1细胞Wnt5a mRNA转录水平的影响 qRT-PCR检测200 μmol/L PA处理细胞后Wnt5a mRNA随时间表达变化,结果显示,自6 h起细胞Wnt5a mRNA表达水平明显升高(P<0.05),见图2A。使用不同浓度PA刺激细胞6 h,结果显示,细胞Wnt5a mRNA表达水平随 PA浓度升高逐渐增加(P<0.05),见图2B。
2.3 PA对INS-1细胞Wnt5a蛋白表达水平的影响 Western blot检测200 μmol/L PA处理细胞后Wnt5a蛋白随时间表达变化,结果显示,自6 h起细胞Wnt5a的蛋白表达水平明显升高(P<0.05),见图3A。使用不同浓度PA刺激细胞6 h,结果显示,细胞Wnt5a的蛋白表达水平随PA浓度升高逐渐增加(P<0.05),见图3B。
2.4 沉默Wnt5a表达对PA抑制INS-1细胞增殖的影响 使用两组不同的siRNA瞬时转染沉默Wnt5a,转染36 h后Western blot验证siRNA序列的有效性,见图4。使用siRNA-Wnt5a转染细胞24 h后予500 μmol/L PA继续刺激细胞24 h,EdU标记法检测细胞增殖率,结果显示,转染无意义siRNA情况下,PA降低细胞增殖率;沉默Wnt5a后PA抑制细胞增殖的效应明显减弱,差异有统计学意义(P<0.05),见图5。

A:200 μmol/L PA处理细胞不同时间后Wnt5a的蛋白表达水平;B:不同浓度PA处理细胞6 h后Wnt5a的蛋白表达水平;*:P<0.05,与溶剂对照组比较
图3 PA对INS-1细胞Wnt5a蛋白表达的影响

A:Western blot检测转染无意义siRNA或siRNA-Wnt5a各组中Wnt5a蛋白表达;B:转染无意义siRNA或siRNA-Wnt5a各组中Wnt5a蛋白表达分析图;*:P<0.05,与转染无意义siRNA(NC组)比较
图4转染无意义siRNA或siRNA-Wnt5a各组中Wnt5a蛋白表达

A:转染各组细胞EdU标记染色图(×400);B:转染各组细胞增殖率分析图;*:P<0.05,与NC+PA组比较
图5 EdU标记转染siRNA-Wnt5a对PA抑制INS-1细胞增殖的影响
3 讨 论
脂毒性与β细胞数量减少密切相关,FFAs对β细胞同时产生诱导凋亡及抑制增殖的效应,大量研究已经对FFAs如何诱导β细胞凋亡进行了详尽的机制阐释:如在多种不同来源的胰岛β细胞中神经酰胺通路已被证实与β细胞凋亡关系紧密[3],FFAs介导线粒体膜损伤导致一系列细胞因子(如细胞色素C)释放,可诱导β细胞凋亡[4]。然而,FFAs抑制胰岛β细胞增殖的机制尚不清楚。在T2DM疾病发展过程中,脂、糖代谢紊乱常相伴出现,FFAs可明显抑制葡萄糖诱导的β细胞增殖,具有分泌功能的β细胞数量减少,机体最终失代偿发展成为T2DM[8]。因此,探索FFAs抑制β细胞增殖的机制对理解T2DM发病机制及研究治疗策略十分重要。
大量报道显示,Wnt5a与脂代谢紊乱关系密切:T2DM大鼠肝脏Wnt5a表达水平明显升高[7];动物实验中Wnt5a基因敲除可减轻脂肪组织的炎性反应,并同时改善胰岛素抵抗[9]。Wnt5a及其受体广泛表达于多种组织,HELLER等[10]通过RT-PCR检测发现,在人胰岛中Wnt5a是Wnt配体家族中表达丰度最高的亚型之一。过去发现Wnt5a在调控β细胞迁移及胰岛发育的过程中起重要作用,但鲜有研究探索Wnt5a在调控β细胞增殖中的作用。笔者前期研究证明,Wnt5a是抑制β细胞增殖的重要调控因子[6]。因此,本研究着重于探索Wnt5a是否参与介导FFAs抑制β细胞增殖。本研究使用了饱和脂肪酸PA刺激大鼠胰岛β细胞INS-1,通过EdU标记染色观察到细胞增殖明显被抑制。同时,研究发现PA促进Wnt5a mRNA及蛋白的表达呈浓度及时间依赖性。为了进一步阐明Wnt5a在PA抑制INS-1细胞增殖中的作用,本研究使用脂质体法瞬时转染有效的siRNA序列沉默Wnt5a基因表达,再给予PA刺激细胞。通过EdU标记检测发现,与转染无意义siRNA+PA组相比,转染siRNA-Wnt5a+PA组细胞增殖率明显回升,表明Wnt5a参与介导PA抑制INS-1细胞增殖过程,PA通过上调Wnt5a基因表达抑制INS-1细胞增殖。
本研究观察到PA可调控INS-1细胞Wnt5a基因表达,但相关调控机制尚未阐明。有报道指出,在人类Wnt5a基因序列启动子区域存在核因子-κB(NF-κB)(-111/-101)、Forkhead-box(FOX,-780/-770)、Smad(-1965/-1953)等转录因子的结合位点[11]。而在脂肪细胞及内皮细胞中PA可激活NF-κB转录活性[12-13];游离脂肪酸被证实可经FOXO1介导胰岛素-IGF-1信号通路促进β细胞系MIN6细胞凋亡[14]。至于转录因子Smad2和Smad3,则有报道指出它们与部分胰腺切除术后胰岛细胞增殖抑制密切相关[15]。虽无胰岛β细胞或细胞系实验提供直接证据揭示PA对Wnt5a基因表达的调控机制,但本课题组已正在进一步开展实验探索其具体机制。至于PA通过Wnt5a抑制β细胞增殖的下游通路机制,也有待进一步实验探索。本课题组在前期已通过体外实验证实,基础状态下Wnt5a通过磷酸化CaMKⅡ,下调全细胞β-catenin水平,抑制β-catenin与核内TCF/LEF形成活性转录复合物,最终下调细胞周期因子CycinD 1的表达,达到抑制细胞增殖的作用[6]。但PA是否也通过Wnt5a/CaMKⅡ信号通路抑制INS-1细胞增殖尚不清楚,有待进一步研究。
综上所述,PA抑制胰岛β细胞系INS-1细胞增殖,其主要机制与调控Wnt5a基因表达有关。本实验中PA上调Wnt5a基因表达抑制INS-1细胞增殖的具体机制并未阐明,有待进一步研究探索。

