养猪发酵床不同发酵程度垫料微生物群落结构特征的PLFA分析*
郑雪芳, 刘 波, 朱育菁, 王阶平, 蓝江林, 陈倩倩
养猪发酵床不同发酵程度垫料微生物群落结构特征的PLFA分析*
郑雪芳, 刘 波**, 朱育菁, 王阶平, 蓝江林, 陈倩倩
(福建省农业科学院农业生物资源研究所 福州 350003)
发酵床养猪是一种新型的养殖技术, 可有效缓解养猪的环境污染问题, 微生物在其中起关键作用。为明确养猪发酵床发酵过程微生物群落的变化规律, 为发酵床的科学管理提供依据, 本研究采用磷脂脂肪酸生物标记(phospholipid fatty acids, PLFA)法分析养猪发酵床不同发酵等级垫料的微生物群落结构特征。采用色差法将垫料分为3个发酵程度等级: 1级、2级和3级, 采集不同发酵等级表层(0~15 cm)和里层(30~45 cm)垫料样本, 测定各样本的PLFA。结果表明, 共检测到61种PLFA, 发酵2级垫料的PLFA种类最多, 发酵3级垫料的PLFA种类最少。在各垫料中, PLFA分布量均表现为细菌>真菌>放线菌。指示细菌、真菌、放线菌、革兰氏阳性细菌(G+)、革兰氏阴性细菌(G-)的PLFA及总PLFA在各发酵等级表层垫料的分布量均显著大于其在里层垫料的分布量, 最大值出现在发酵1级表层垫料中。与对照(未发酵垫料)相比, 发酵垫料总PLFA含量均显著增加(<0.05)。发酵3级表层垫料的真菌/细菌值最大, 发酵2级表层垫料的G+/G-值最大。多样性分析表明, Shannon指数和Pielou指数最大值出现在发酵2级垫料中, 而Simpson指数最大值出现在发酵3级表层垫料中。聚类分析表明, 当欧氏距离为233.15时, 可将不同发酵等级垫料聚为3个类群, 同一发酵级别的垫料聚在相同类群中; 主成分分析表明, 发酵1级表层和里层垫料单独归一类群, 其他发酵等级垫料和对照垫料归另一类群中。综上, 不同发酵等级垫料的微生物种群结构不同, 发酵1级表层垫料微生物分布量最大, 发酵2级垫料的微生物种类最多, 相同发酵级别表层和里层垫料微生物群落结构相似。
养猪发酵床; 垫料; 发酵程度; 微生物群落结构; 磷脂脂肪酸(PLFA); 聚类分析
微生物发酵床养殖技术是一种新型的环保养殖技术[1], 畜禽在谷壳、秸秆、锯糠、椰糠等制作的发酵床上生长, 畜禽粪污被发酵床中的微生物分解, 无恶臭、零排放, 彻底解决规模化养殖的环境污染问题[2-3]。微生物发酵床养殖的核心技术是利用其形成的有益功能微生物种群, 长期和持续稳定地将畜禽粪污进行降解[4-5]。发酵床中的微生物种类和组成受物理、化学和生物因素的影响而呈现动态变化[6]。刘波等[7]研究发现, 不同深度和空间的发酵床微生物种类和组成差异显著, 发酵床表层微生物种类明显小于里层的微生物种类。熊宽荣等[8]研究表明, 增加垫料的翻耙次数和发酵菌剂添加量能显著提高发酵床芽胞杆菌的数量和微生物总量。张学峰等[9]认为发酵床微生物分布与外界环境变化有关, 表层垫料微生物组成受环境影响较大, 其主要微生物为大肠杆菌。作者前期研究中, 利用PLFA技术分析养猪发酵床微生物群落结构的空间分布特点[10]及使用时间对发酵床微生物群落结构的影响[11]。然而, 目前关于养猪发酵床不同发酵等级微生物群落结构的变化特征未见报道。
研究微生物群落结构的方法很多, 包括磷脂脂肪酸(phospholipid fatty acid, PLFA)法、DGGE (denaturing gradient gel electrophoresis)法、Biolog法、宏基因组等[12-15]。PLFA是一种可定性和定量分析环境微生物群落多样性的方法, 根据不同微生物体PLFA组成和含量的种属特异性, 对微生物生物量及其群落结构进行估算[16]。该技术能解决传统微生物分离法中大部分微生物不可培养的问题, 是一种无需分离和培养技术, 较为准确、有效的研究环境微生物多样性的方法。
本文以养猪发酵床为研究对象, 采用PLFA研究发酵床中不同发酵程度垫料微生物群落结构的特征, 揭示发酵床微生物群落在发酵过程中的动态变化规律, 以期为养猪发酵床科学化管理和应用提供参考。
1 材料与方法
1.1 试验地点和发酵床管理
试验地点位于福清市渔溪现代设施农业样本工程示范基地的微生物发酵床大栏养猪舍。猪舍占地面积3 069 m2, 发酵床面积1 617 m2。微生物发酵床是由30%谷壳和70%椰糠构成, 发酵床厚度为80 cm。发酵床管理方法为每周将表层垫料翻耙2~3次, 每2个月深翻一次, 每批猪出栏后, 用新垫料替换表层腐熟程度高的垫料。猪饲养密度为1头·m-2, 按常规方法进行管理。
1.2 不同发酵等级垫料样本的采集
养猪发酵床垫料根据发酵程度分为3个等级, 发酵程度等级划分按宋泽琼等[17]色差(∆)判别法进行(表1),以未发酵的垫料(按发酵床垫料组分配比配制的垫料, 未经堆制发酵)为对照。将整个发酵床划分为3个区域采样, 为3个重复。采用五点取样法, 采集发酵床表层(0~15 cm)和里层(30~45 cm)的垫料, 每个点取100 g, 将相同发酵等级表层或里层5个点样本混合均匀成1个样本, 取出混合后小样(10 g), 进行PLFA测定。

表1 养猪发酵床垫料不同发酵等级的样本特点
1.3 PLFA提取和测定方法
PLFA的提取方法参考Frostegård等[18]和Kourtev等[19]方法。采用气相色谱仪(Agilent 6890N, 美国)进行PLFA成分测定。分流进样法, 分流比为100∶1, 进样量l μL。二阶程序升高柱温: l70 ℃起始, 5 ℃·min-1升至260 ℃, 而后40 ℃·min-1升温至310 ℃, 维持90 s; 汽化室温度250 ℃、检测器温度300 ℃; 载气为H2(2 mL·min-1)、尾吹气为N2(30 mL·min-1); 柱前压l0.00 psi; PLFA的鉴定采用Sherlock MIS 4.5系统(MIDI, Newark, 美国)。
1.4 数据分析
数据分析采用Microsoft Excel 2007、DPS 7.5等软件, 采用单因素方差分析(LSD法)比较不同数间的差异(<0.05)。
1)微生物PLFA生物标记的识别: 不同PLFA指示不同类群微生物, 细菌细胞膜一般含有饱和、不饱和、支链或直链脂肪酸, 其中革兰氏阴性细菌(G-)主要含有羟基、单烯和环丙烷脂肪酸, 而革兰氏阳性细菌(G+)主要含有支链脂肪酸, 偶数和多烯脂肪酸是大部分真菌细胞膜的成分[20-22]。
2)微生物群落多样性分析: 根据磷脂肪酸含量和种类计算丰富度指数Shannon、多样性指数Simpson和均匀度指数Pielou, 分析不同发酵等级垫料微生物群落的多样性[23]。按照计算物种指数方法计算各指数值。
Shannon-Wiener指数:=-∑PlnP(1)
Simpson指数:=1-∑(n/)2(2)
Pielou指数:=/ln(3)
式中:为群落中的脂肪酸总种类数,P=n/,n为类脂肪酸个数,为该试验中总脂肪酸个数。
3)聚类分析: 以磷脂脂肪酸生物标记为样本, 以每个磷脂脂肪酸生物标记在不同样本分布量为指标, 构建矩阵, 将数据进行中心化处理, 欧氏距离为聚类尺度, 用可变类平均法对数据进行系统聚类, 分析各类的特点。
4)主成分析(principal component analysis, PCA): 采用DPS软件中多元统计分析中的主成分分析方法,包括数据求协方差矩阵, 计算特征方程中所有特征值, 并根据特征值累积比例确定主成分的数量, 计算主成分载荷值和主成分得分, 进行一级主成分评分等, 具体步骤参见文献[24]。
2 结果与分析
2.1 不同发酵等级垫料微生物PLFA组成及含量
统计不同发酵等级和不同深度垫料微生物PLFA组成及含量, 结果如图1所示。共检测到61种PLFA, 发酵2级垫料的PLFA种类最多, 其表层和里层的PLFA种类均为44种; 发酵3级垫料的PLFA种类最少, 其表层和里层的PLFA种类分别为31种和36种。PLFA含量随着发酵等级增加而减少, 最大值出现在发酵1级表层垫料, 其次是发酵1级里层垫料, 对照和发酵3级里层垫料的PLFA含量最少。发酵1级和2级及对照垫料中饱和脂肪酸16:00含量最高, 发酵3级垫料中不饱和脂肪酸18:1 w9c含量最高。脂肪酸生物标记10:00、12:00、13:00、14:00、16:00、17:00、18:00、20:00、i11:0、a15:0、i15:0、16:1 2OH、i16:0、a17:0、cy17:0、i17:0、17:1w8c、cy19:0 w8c、18:1 w9c、18:3 w6,9,12、cy19:0 w8c和20:1 w9c在各发酵等级垫料中均有分布, 说明这类PLFA指示的微生物适应性强, 在发酵全过程均能生长。
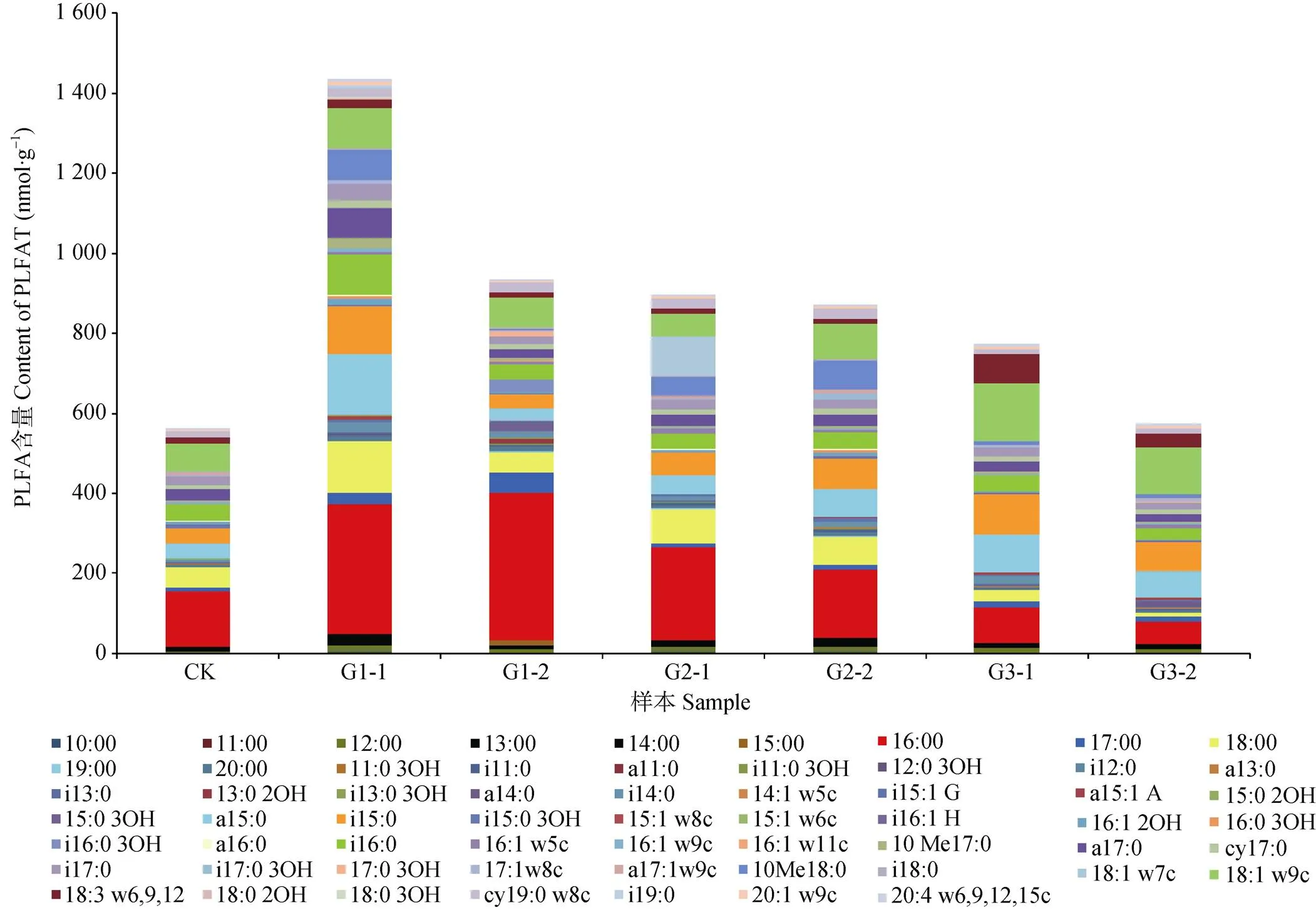
图1 养猪发酵床不同发酵等级垫料的PLFA组成
2.2 不同发酵等级垫料特征微生物的分布特性
由表2可以看出, 不同发酵等级垫料细菌、真菌、放线菌、革兰氏阳性细菌(G+)、革兰氏阴性细菌(G-)和总PLFA含量差异显著(<0.05); 细菌、真菌、放线菌、G+、G-和总PLFA含量在表层垫料的分布量均显著大于其在里层垫料(放线菌在发酵3级垫料分布量除外), 且在发酵1级表层垫料分布量最大。与对照相比, 发酵过垫料总PLFA含量显著增加(发酵3级里层垫料除外), 总PLFA含量随着发酵等级增加而减少, 如发酵1级表层垫料和里层垫料总PLFA含量分别为1 435.05 nmol·g-1和932.69 nmol·g-1, 显著大于发酵3级表层垫料总PLFA含量(772.22 nmol·g-1)和里层垫料总PLFA含量(574.94 nmol·g-1); 细菌、真菌和放线菌在各个不同发酵等级垫料分布量均为细菌>真菌>放线菌。
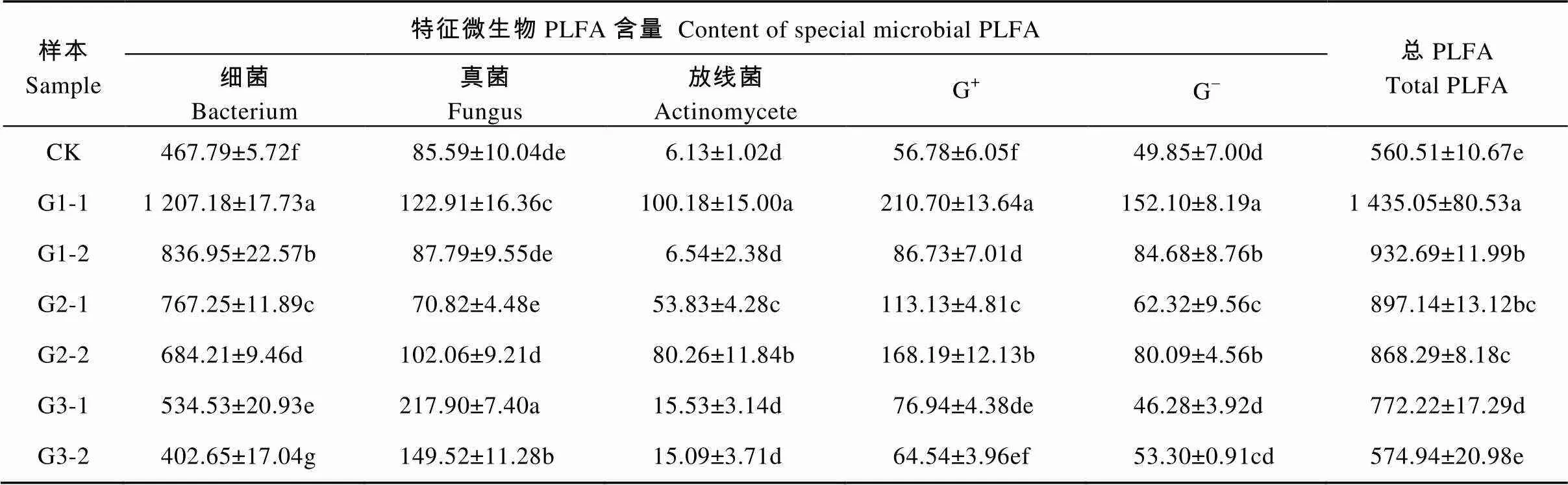
表2 养猪发酵床不同发酵等级垫料特征微生物PLFA含量
表中数值为平均值±标准差, 同列数值后不同小写字母表示差异显著(<0.05)。Data were means±standard deviation. Data within the same column followed by different lowercase letters are significantly different (< 0.05).
不同发酵程度垫料真菌/细菌值和G+/G-值差异显著(<0.05)。发酵3级表层垫料的真菌/细菌值最大,发酵3级里层垫料次之, 发酵1级垫料和发酵2级表层垫料真菌/细菌值最小(图2A)。发酵2级里层垫料的G+/G-值最大, 发酵2级表层垫料次之, 发酵1级里层的G+/G-值最小(图2B)。
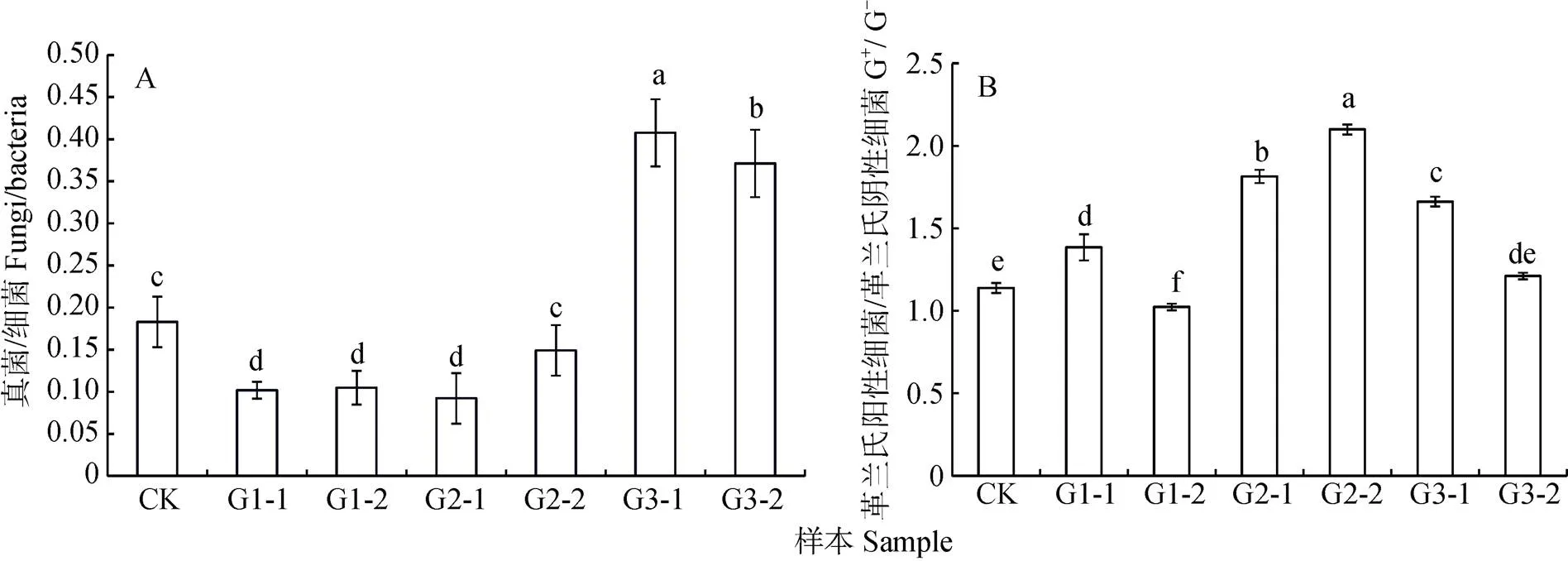
图2 养猪发酵床不同发酵等级垫料真菌/细菌(A)和G+/G-值(B)
柱状图中不同小写字母表示差异显著(<0.05)。Different lowercase letters in the figure indicate significant differences at 0.05 level.
2.3 不同发酵程度垫料微生物群落多样性分析
发酵2级垫料表层和里层的Shannon指数和Pielou指数值相同且最大, 分别为2.964 8和0.721 2, 显著高于其他发酵程度垫料及对照(<0.05)(表3), Simpson指数最大值为发酵3级表层垫料, 为0.991 7, 发酵3级里层垫料次之, 为0.990 3, 发酵2级垫料的Simpson指数值最小, 为0.988 2。
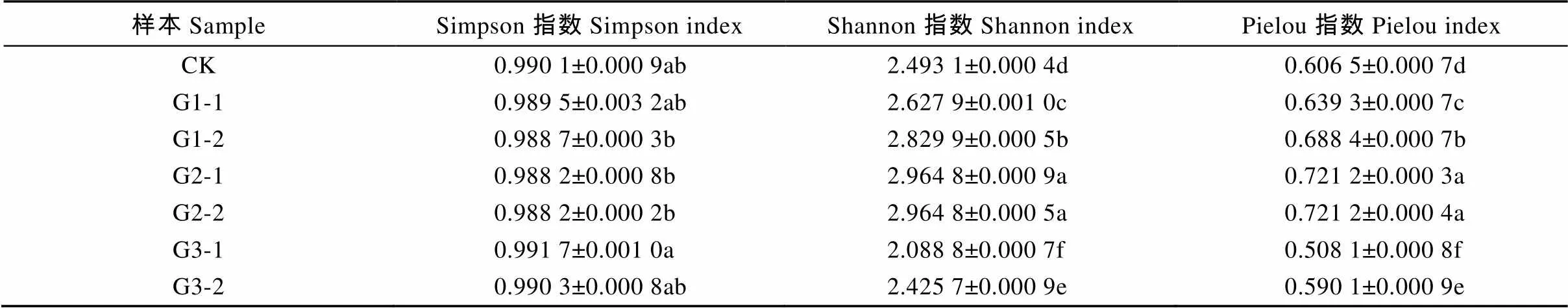
表3 养猪发酵床不同发酵等级垫料微生物群落多样性指数
表中数值为平均值±标准差, 同列数值后不同小写字母表示差异显著(<0.05)。Data were means±standard deviation. Data within the same column followed by different lowercase letters are significantly different (< 0.05).
2.4 不同发酵等级垫料群落结构的聚类分析
不同发酵等级垫料聚类结果如图3所示, 当欧氏距离为233.15时, 可将不同发酵等级垫料聚为3个类群, 同一发酵级别的垫料聚在相同类群中; 未发酵垫料(CK)与发酵2级垫料聚在同一类群中, 说明这两种垫料微生物种群结构相似; 发酵2级垫料与发酵3级垫料的距离较其与发酵1级垫料的距离更近, 说明发酵2级垫料与发酵3级垫料的微生物结构较接近, 与发酵1级垫料的微生物结构差异较大。
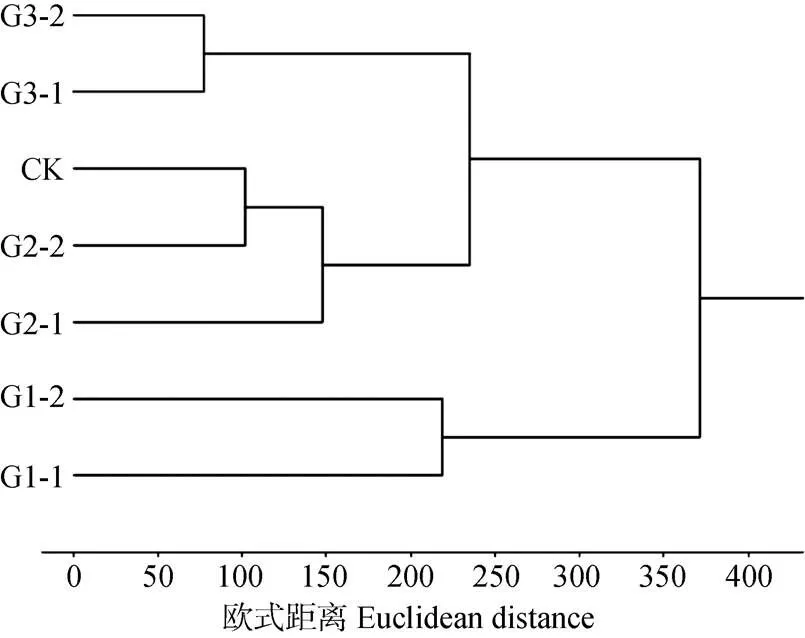
图3 养猪发酵床不同发酵等级垫料微生物群落结构的聚分类析
2.5 不同发酵等级垫料群落结构的主成分分析
基于PLFA发酵床不同发酵等级垫料经主成分分析得出,主成分1(PC1)贡献率为59.38%,主成分2(PC2)贡献率为20.01%, PC1和PC2基本能将不同发酵等级垫料样本区分出来(图4)。发酵1级表层和里层的垫料归在一类群; 发酵2级、发酵3级和未发酵垫料归在另一类群中。发酵1级表层和里层垫料微生物种群均与PC1和PC2呈正相关; 发酵3级表层和里层垫料微生物种群均与PC1和PC2呈负相关。
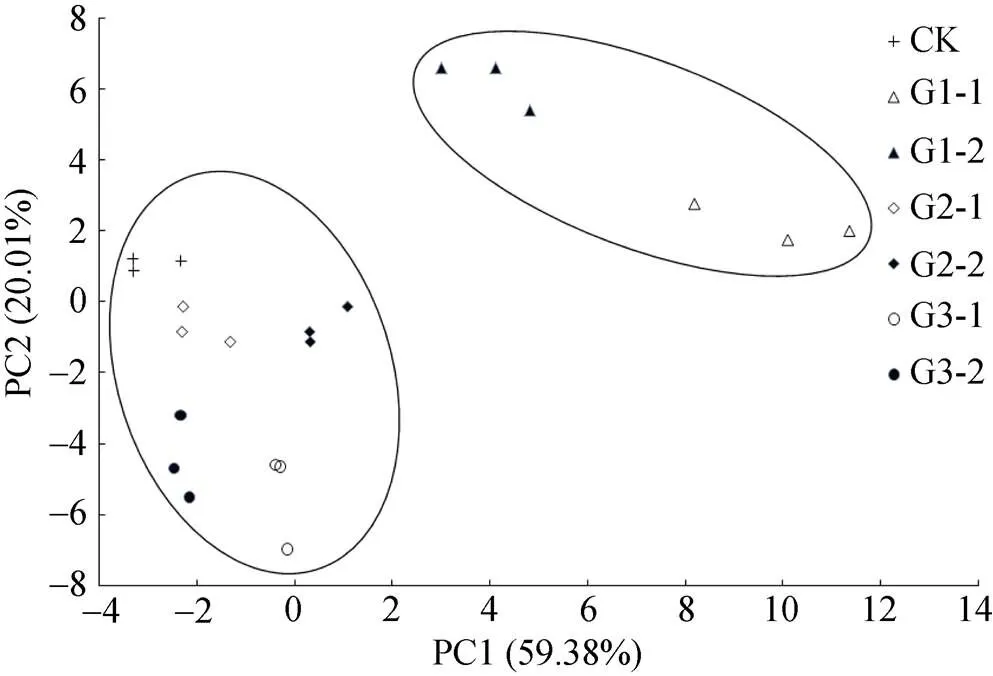
图4 养猪发酵床不同发酵等级垫料微生物群落结构的主成分分析(相同图案代表3个重复样本)
3 讨论
养猪发酵床特点是将有机垫料和功能微生物菌剂按一定比例混合, 高温发酵后, 利用其形成的有益微生物菌群对猪粪尿进行降解[25]。微生物是发酵床完成对猪粪尿降解的关键因素, 要使发酵床更好地发挥作用, 研究发酵床不同发酵等级垫料中微生物种类、数量和组成非常必要。磷脂脂肪酸存在于活体微生物的细胞膜, 磷脂脂肪酸的组成可以表示微生物群落的组成和结构[26]。Klamer等[27]和Steger等[28]的研究指出, 脂肪酸量的增减能很好地反映微生物种群的兴衰。本研究利用磷脂脂肪酸生物标记技术研究发酵床不同发酵等级垫料微生物群落结构特性, 研究结果表明, 不同发酵等级垫料PLFA种类和含量不同, 发酵2级垫料的PLFA种类最多, 发酵3级垫料的PLFA种类最少, 表明发酵2级垫料微生物种类多, 而发酵3级垫料微生物种类少; 各类特征微生物(细菌、真菌、放线菌)在各发酵等级表层垫料的分布量均大于其在里层垫料的分布量, 可能原因如下: 1)发酵床的发酵是一个耗氧过程[29], 表层通风通气性好, 有利于微生物生长; 2)发酵床发酵过程中, 猪粪尿是微生物活动的主要营养来源[30], 表层直接接触新鲜猪粪尿, 营养丰富, 促进微生物的生长; 3)里层温度高, 可达60~70 ℃[5,31-32], 高温杀死了一部分微生物, 从而导致里层微生物种类和数量低于表层。
真菌/细菌比可反映真菌和细菌相对含量的变化和两个种群的相对丰富程度, 比值越高表明生态系统越稳定[33-34]。在本研究中, 发酵3级垫料的真菌/细菌显著大于发酵1级和发酵2级垫料, 表明发酵3级时, 发酵过程进入稳定期, 发酵床已形成稳定的微生物群落结构, 微生态系统稳定。此外, 本研究发现, 发酵2级表层垫料G+/G-值最大, 而发酵1级里层垫料的G+/G-值最小。Saetre等[16]认为较高的G+/G-值是环境从富营养到寡营养的转变。Merilä等[35]认为革兰氏阳性细菌能够适应条件较差的环境, 且资源有限的情况下更擅长竞争资源, 而革兰氏阴性细菌的生存更依赖环境提供新鲜的有机物。因此, 当养猪发酵床垫料的发酵达到2级, 可以考虑补充一些新鲜的垫料, 来提高发酵床对猪粪尿的降解效果。
多样性指数可作为度量生态系统中微生物群落多样性高低的指标, 高的多样性指数表明高的微生物群落多样性[36]。多样性指数是由物种数量(Simpson指数)、丰富度(Shannon指数)和均匀度(Pielou指数)组成[37]。本研究显示, Simpson指数、Shannon指数和Pielou指数在不同发酵等级垫料存在显著差异, 表明随着发酵进程, 发酵床微生物群落结构发生明显变化。Shannon指数和Pielou指数值在发酵2级垫料中最大, 而在发酵3级垫料中最小, 表明发酵2级垫料微生物种类最多, 且分布均匀, 而发酵3级垫料微生物种类最少, 与PLFA测定结果相吻合, 即发酵2级垫料的PLFA种类最多, 发酵3级垫料PLFA种类最少。
养猪发酵床垫料微生物群落结构及其稳定性是发酵床“健康状态”的主要表征[2]。发酵床中微生物活动受抑制, 其分解粪便的能力就会下降, 导致粪便大量的蓄积, 氨气味道加重等。本研究中发现, PLFA含量随着发酵等级增加而减少, 即随着发酵进程, 发酵床微生物量呈现减少趋垫, 如发酵1级垫料表层PLFA总量(1 435.05 nmol×g-1)显著高于发酵3级表层垫料(772.22 nmol×g-1), 说明发酵床由健康状态(发酵1级)转为非健康状态(发酵3级), 此时微生物生长受到抑制, 需要考虑更换新的垫料, 以利于发酵床正常运作。因此, 发酵床的日常管理中可以根据发酵等级来补充或替换新的垫料, 同时可以通过控制光、温、水、气等环境因素, 改善微生物的生长条件, 延长发酵床的使用寿命。
4 结论
不同发酵等级垫料微生物群落结构均存在明显差异: 1)细菌、真菌、放线菌、G+、G-和总PLFA含量在发酵1级表层垫料中分布量最大, 且在各发酵等级的表层垫料分布量均显著大于其在里层垫料的分布量; 2)发酵3级垫料的真菌/细菌值显著大于其他发酵等级垫料, 该发酵等级垫料已形成稳定的微生物群落结构; 3)与其他发酵等级垫料及对照相比, 发酵2级垫料微生物种类最多, 且分布均匀; 4)聚类分析和主成分分析表明相同发酵等级垫料微生物群落组成较为相似。
[1] 孔凡真. 日本发酵床养猪技术简介[J]. 国际信息, 2005, (2): 40–42 KONG F Z. Technique of pig-raising on the fermentation bed in Japan[J]. International Information, 2005, (2): 40–42
[2] 刘波, 朱昌雄. 微生物发酵床零污染养猪技术研究与应用[M]. 北京: 中国农业科学技术出版社, 2009 LIU B, ZHU C X. Research and application of microbial fermentation-bed for pig raising[M]. Beijing: Chinese Agricultural Science and Technology Press, 2009
[3] CHEN Q Q, LIU B, WANG J P, et al. Diversity and dynamics of the bacterial community involved in pig manure biodegradation in a microbial fermentation bed system[J]. Annals of Microbiology, 2017, 67(7): 491–500
[4] GROENESTEIN C M, OOSTHOEK J, VAN FAASSEN H G. Microbial processes in deep-litter systems for fattening pigs and emission of ammonia, nitrous oxide and nitric oxide[C]//VERSTEGEN M W A, DEN HARTOG L A, VAN KEMPEN G J M, et al. Nitrogen Flow in Pig Production and Environmental Consequences. Proceedings of the First International Symposium. Wageningen: Pudoc Scientific Publishers, 1993: 168–176
[5] TAM N F Y, VRIJMOED L L P. Effects of the inoculum size of a commercial bacterial product and the age of sawdust bedding on pig waste decomposition in a pig-on-litter system[J]. Waste Management & Research, 1993, 11(2): 107–115
[6] 陈倩倩, 刘波, 王阶平, 等. 微生物发酵床猪舍不同发酵等级垫料中大肠杆菌的分离鉴定[J]. 中国畜牧兽医, 2017, 44(1): 268–274 CHEN Q Q, LIU B, WANG J P, et al. Isolation and identification of.in the microbial-fermentation bed of piggery[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(1): 268–274
[7] 刘波, 王阶平, 陈倩倩, 等. 养猪发酵床微生物宏基因组基本分析方法[J]. 福建农业学报, 2016, 31(6): 630–648 LIU B, WANG J P, CHEN Q Q, et al. Metagenomic analysis of microbial community in a microbial fermentation-bed for pig raising[J]. Fujian Journal of Agricultural Sciences, 2016, 31(6): 630–648
[8] 熊宽荣, 张益焘, 曹珍, 等. 翻耙频率和发酵菌剂对猪舍外发酵床垫料微生物群落的影响[J]. 家畜生态学报, 2016, 37(6): 43–50 XIONG K R, ZHANG Y T, CAO Z, et al. Effects of microorganism inoculants and turning frequency on the litter microbial community of noncontact deep-litter-system[J]. Acta Ecologae Animalis Domastici, 2016, 37(6): 43–50
[9] 张学峰, 周贤文, 陈群, 等. 不同深度垫料对养猪土著微生物发酵床稳定期微生物菌群的影响[J]. 中国兽医学报, 2013, 33(9): 1458–1462 ZHANG X F, ZHOU X W, GHEN Q, et al. The influence of padding of different depth in native microorganism fermentation bed of pigs on microbial flora during steady period[J]. Chinese Journal of Veterinary Science, 2013, 33(9): 1458–1462
[10] 郑雪芳, 刘波, 朱育菁, 等. 磷脂脂肪酸生物标记法分析养猪发酵床微生物群落结构的空间分布[J]. 农业环境科学学报, 2018, 37(4): 804–812ZHENG X F, LIU B, ZHU Y J, et al. Spatial distribution of microbial communities in a fermentation bed based on phospholipid fatty acid biomarkers[J]. Journal of Agro-Environment Science, 2018, 37(4): 804–812
[11] 郑雪芳, 刘波, 林营志, 等. 利用磷脂脂肪酸生物标记分析猪舍基质垫层微生物亚群落的分化[J]. 环境科学学报, 2009, 29(11): 2306–2317 ZHENG X F, LIU B, LIN Y Z, et al. Using phospholipid fatty acid biomarkers for analysis of the microbial subcommunity in pigsty litter[J]. Acta Scientiae Circumstantiae, 2009, 29(11): 2306–2317
[12] 文倩, 林启美, 赵小蓉, 等. 北方农牧交错带林地、耕地和草地土壤微生物群落结构特征的PLFA分析[J]. 土壤学报, 2008, 45(2): 321–327 WEN Q, LIN Q M, ZHAO X R, et al. Application of PLFA analysis in determination of soil microbial community structure in woodland, cropland and grassland in farmland-pasture interleaving zone of north China[J]. Acta Pedologica Sinica, 2008, 45(2): 321–327
[13] DENG B, SHEN C H, SHEN X H, et al. PCR-DGGE analysis on microbial communities in pit mud of cellars used for different periods of time[J]. Journal of the Institute of Brewing, 2012, 118(1): 120–126
[14] XUE D, YAO H Y, GE D Y, et al. Soil microbial community structure in diverse land use systems: A comparative study using biolog, DGGE, and PLFA analyses[J]. Pedosphere, 2008, 18(5): 653–663
[15] LAUBER C L, STRICKLAND M S, BRADFORD M A, et al. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biology and Biochemistry, 2008, 40(9): 2407–2415
[16] SAETRE P, BÅÅTH E. Spatial variation and patterns of soil microbial community structure in a mixed spruce-birch stand[J]. Soil Biology and Biochemistry, 2000, 32(7): 909–917
[17] 宋泽琼, 蓝江林, 刘波, 等. 养猪微生物发酵床垫料发酵指数的研究[J]. 福建农业学报, 2011, 26(6): 1069–1075 SONG Z Q, LAN J L, LIU B, et al. Study on the fermentation index for the pig litter in the piggery of microbial fermentation bed[J]. Fujian Journal of Agricultural Sciences, 2011, 26(6): 1069–1075
[18] FROSTEGǺRD A, TUNLID A, BǺǺTH E. Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals[J]. Applied and Environmental Microbiology, 1993, 59(11): 3605–3617
[19] KOURTEV P S, EHRENFELD J G, HӒGGBLOM M. Exotic plant species alter the microbial community structure and function in the soil[J]. Ecology, 2002, 83(11): 3152–3166
[20] WILKINSON S G. Gram-negative bacteria[M]//RATLEDGE C, WILKINSON S G. Microbial Lipids. London: Academic Press, 1988: 299–488
[21] O’LEARY W M, WILKINSON S G. Gram-positive bacteria[M]//RATLEDGE C, WILKINSON S G. Microbial Lipids. London: Academic Press, 1988: 117–202
[22] ZELLES L. Community structure of soil microorganisms[M]//SCHINNER F, ÖHLINGER R, KANDELER E, et al. Methods in Soil Biology. London: Springer Press, 1996: 77–92
[23] GARLAND J L, MILLS A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbo-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351–2359
[24] 唐启义, 冯明光. 实用统计分析及其DPS数据处理系统[M]. 北京: 科学出版社, 2002 TANG Q Y, FENG M G. DPS Data Processing System for Practical Statistics[M]. Beijing: Science Press, 2002
[25] 蓝江林, 刘波, 宋泽琼, 等. 微生物发酵床养猪技术研究进展[J]. 生物技术进展, 2012, 2(6): 411–416 LAN J L, LIU B, SONG Z Q, et al. Advances in research of microbial fermentation bed in pig farming[J]. Current Biotechnology, 2012, 2(6): 411–416
[26] BARDGETT R D, HOBBS P J, FROSTEGǺRD Ǻ. Changes in soil fungal: Bacterial biomass ratios following reductions in the intensity of management of an upland grassland[J]. Biology and Fertility of Soils, 1996, 22(3): 261–264
[27] KLAMER M, BǺǺTH E. Microbial community dynamics during composting of straw material studied using phospholipid fatty acid analysis[J]. FEMS Microbiology Ecology, 1998, 27(1): 9–20
[28] STEGER K, JARVIS A, SMǺRS S, et al. Comparison of signature lipid methods to determine microbial community structure in compost[J]. Journal of Microbiological Methods, 2003, 55(2): 371–382
[29] 夏飚. 发酵床养猪冬季注意事项[J]. 农村养殖技术, 2010, (24): 10 XIA B. The notice matters of pig raising in fermentation-bed in winter[J]. Journal of Rural Animal-Breeding Technology, 2010, (24): 10
[30] 黄灿, 唐新燕, 彭绪亚. 猪排泄物恶臭产生与控制的微生物学原理[J]. 中国生态农业学报, 2009, 17(4): 823–828 HUANG C, TANG X Y, PENG X Y. Microbiological mechanism of swine excreta odor production and control[J]. Chinese Journal of Eco-Agriculture, 2009, 17(4): 823–828
[31] 赵瑞廷, 栾冬梅. 发酵床养猪的研究及应用[J]. 黑龙江畜牧兽医, 2010, (3): 81–83 ZHAO R T, LUAN D M. Research and application of fermentation-bed for pig raising[J]. Heilongjiang Animal Science and Veterinary Medicine, 2010, (3): 81–83
[32] DEININGER A, TAMM M, KRAUSE R, et al. Penetration resistance and water-holding capacity of differently conditioned straw for deep litter housing systems[J]. Journal of Agricultural Engineering Research, 2000, 77(3): 335–342
[33] DE VERIES F T, HOFFLAND E, VAN EEKEREN N, et al. Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092–2103
[34] 孙凤霞, 张伟华, 徐明岗, 等. 长期施肥对红壤微生物生物量碳氮和微生物碳源利用的影响[J]. 应用生态学报, 2010, 21(11): 2792–2798 SUN F X, ZHANG W H, XU M G, et al. Effects of long-term fertilization on microbial biomass carbon and nitrogen and on carbon source utilization of microbes in a red soil[J]. Chinese Journal of Applied Ecology, 2010, 21(11): 2792–2798
[35] MERILÄ P, MALMIVAARA-LÄMSÄ M, SPETZ P, et al. Soil organic matter quality as a link between microbial community structure and vegetation composition along a successional gradient in a boreal forest[J]. Applied Soil Ecology, 2010, 4(2): 259–267
[36] 席劲瑛, 胡洪营, 钱易. Biolog方法在环境微生物群落研究中的应用[J]. 微生物学报, 2003, 43(1): 138–141 XI J Y, HU H Y, QIAN Y. Application of Biolog system in the study of microbial community[J]. Acta Microbiologica Sinica, 2003, 43(1): 138–141
[37] MAGURRAN A E. Ecological Diversity and its Measurement[M]. Princeton: Princeton University Press, 1988
Analysis of microbial community structure of litter with different fermentation levels in pig-on-litter system using phospholipid fatty acid biomarkers*
ZHENG Xuefang, LIU Bo**, ZHU Yujing, WANG Jieping, LAN Jianglin, CHEN Qianqian
(Institute of Agricultural Bio-Resources, Fujian Academy of Agricultural Sciences, Fuzhou 350003, China)
Pig-on-litter system is a new pig-raising technology that can reduce environmental pollution. In this system, micro-organisms are generally considered as thekey factor. In order to determine the change in microbial community during fermentation and to set up basic data for scientific management of pig-on-litter system, microbial community of litter with different fermentation levels was analyzed using phospholipid fatty acid (PLFA) biomarkers. Fermentation levels of litters were divided into three grades (1st, 2ndand 3rd) using the chromatic aberration () method. Both surface (0-15 cm) and inner layer (30-45 cm) litters of each fermentation level were sampled. PLFA composition of each sample was determined by the Sherlock MIS 4.5 system. The results showed that the method used was sufficient to detect total 61 kinds of PLFA biomarkers. The most and least kinds of PLFA biomarkers occurred in litters with the 2ndand 3rdfermentation levels, respectively. PLFA biomarkers displayed the same order of distribution abundance in all samples — bacteria > fungi > actinomycetes. The contents of PLFAs that were referable to bacteria, fungi, actinomycetes, G+, G-and total PLFA in the surface layer samples were all higher than those in the inner layer samples; being highest in surface layer litters with the 1stfermentation level. Fermented litter had significantly higher content of total PLFA than unfermented litter (CK) (< 0.05). The highest fungi/bacteria and G+/G-ratios were for surface layer litter with the 3rdand 2ndfermentation levels, respectively. Diversity analyses indicated that the maximum values of the Shannon index and Pielou index were for litter of the 2ndfermentation level and the maximum values of the Simpson index were for surface layer litter of the 3rdfermentation level. Based on cluster analysis, the samples were clustered into three groups for Euclidean-distance of 223.15. Samples with the same fermentation level were clustered together. Also based on principal component analysis, surface layer and inner layer samples of the 1stfermentation level were clustered into one lone group, while the other samples were clustered into other several groups. Put together, litters with different fermentation levels had different microbial community structures. The maximum values of microbial content and species were in surface layer litter with the 1stand 2ndfermentation levels, respectively. Moreover, surface layer and inner layer litters of the same fermentation level had similar microbial communities.
Pig-on-litter system;Litter; Fermentation level; Microbial community; Phospholipid fatty acid (PLFA); Clustered analysis
, E-mail:fzliubo@163.com
Jun. 12, 2018;
Sep. 28, 2018
Q938.1
A
2096-6237(2019)01-0042-08
10.13930/j.cnki.cjea.180548
郑雪芳, 刘波, 朱育菁, 王阶平, 蓝江林, 陈倩倩. 养猪发酵床不同发酵程度垫料微生物群落结构特征的PLFA分析[J]. 中国生态农业学报(中英文), 2019, 27(1): 42-49
ZHENG X F, LIU B, ZHU Y J, WANG J P, LAN J L, CHEN Q Q. Analysis of microbial community structure of litter with different fermentation levels in pig-on-litter system using phospholipid fatty acid biomarkers[J]. Chinese Journal of Eco-Agriculture, 2019, 27(1): 42-49
* 国家公益性行业(农业)科研专项(201303094)、福建省公益类科研院所专项(2018R1017-1)和福建省农业科学院科技创新团队项目(STIT2017-1-11)资助
刘波, 主要从事微生物生物技术和农业生物药物研究。E-mail: fzliubo@163.com
郑雪芳, 主要从事农业微生物和生物防治研究。E-mail: zhengxuefangfz@163.com
2018-06-12
2018-09-28
* This study was supported by the Special Fund for Agro-scientific Research in the Public Interest of China (201303094), Fujian Provincial Special Fund for Non-profit Institutions (2018R1017-1) and the Science and Technology Innovation Team Program of Fujian Academy of Agricultural Sciences (STIT2017-1-11).

