产油脂微藻的分离、鉴定及筛选
涂泽敏,吴芳燕,罗剑飞,林炜铁
(华南理工大学生物科学与工程学院,广东广州 510006)
生物质能是可再生能源的重要组成部分。随着世界经济的快速发展,能源紧缺问题和环境污染问题日益严峻,研究生物质能源开发利用可以缓解环境压力,对解决能源、生态环境问题将起到十分积极有效的作用[1]。微藻是制备生物柴油的理想原料,具有生长迅速、能够实现大规模养殖的优点[2]。伴随着燃料乙醇和生物柴油等第一代生物质能被不断消耗利用,以及以麦秆等农林废弃物为主要原料的第二代生物燃料面临开发技术成本较高等问题,以微藻为原料的第三代生物质能将是更加有效的理性选择,也是生物燃料未来必然的发展方向[3]。
微藻细胞中含有丰富的蛋白质、维生素和矿物质等,其细胞一些独特的初级或次级代谢产物是生产药品、精细化学品和新型燃料的潜在资源[4]。某些微藻中富含的多不饱和脂肪酸(PUFA)是合成机体内多种功能物质的前体,如微拟球藻中的EPA具有降血脂、降血压、促进脂肪代谢等作用,可用于防治心血管疾病,对人体健康具有重要的作用[5~7]。然而由于微藻培养及其在制备生物柴油的过程中存在着资源消耗高、回报低,单一培养容易被害虫和病原体入侵等问题,这些都大大限制了微藻生物燃料的商业化应用。当前能源微藻想要实现规模化培养,总的来说主要面临着生物质资源供应不足和生产成本过高的困难,尤其是高成本问题,严重制约着其大规模开发应用[8]。因此研究提高微藻产油能力,提高光生物反应器效率,通过基因工程改造微藻提高产油能力等仍然是研究者们努力的方向[9,10]。
本研究从广州东湖自然水体中筛选鉴定出一些微藻,并研究其生长及油脂积累特性,期望筛选出油脂积累较高的藻类以便后续进一步研究,同时也为该水域是否潜在富油微藻提供一定依据。
1 材料与方法
1.1 实验材料
主要试剂与仪器:二甲基亚砜(DMSO)、尼罗红溶液(2 g/L尼罗红母液,稀释 100倍使用)、DL2000Marker,购于Zomanbio公司;植物基因组提取试剂盒,TAKARA;LRH-150生化培养箱、Infinite®200多功能酶标仪、Eppendorf 5804R冷冻离心机。
样本采集:含藻种的样本采自广州华南理工大学校内东湖,共设置2个采集点,采集水样用采样瓶装好,分离纯化在实验室中进行。
培养基:培养分离均采用BG-11培养基,其中分离在BG-11固体培养基中进行,分离后纯培养及后续培养在液体BG-11中进行。
1.2 试验方法
1.2.1 藻株富集与分离纯化
分别采集东湖两侧表面、底部水样各一份,将采集水样在布氏漏斗中用中速定性滤纸进行抽滤,然后将表层滤液及底层滤液分别以7%和5%接种量接种于BG11培养基中。一周后将培养基中的藻液再次转接至BG11培养基中培养。
取少量梯度稀释藻液接种于BG11固体培养基中划线培养,待平板中长出不同形态单菌落后将其分别接种于新的固体平板中培养,直至平板中长出单一稳定的菌落,后挑取单菌落接种于液体培养基中培养用于后续实验。
1.2.2 藻株显微观察
取纯培养的藻液20 μL置于无菌载玻片上,用结晶紫染色固定后在光学显微镜下观察微藻形态特征。参考《中国淡水藻类-系统、分类及生态》对微藻进行初步分类鉴定。
1.2.3 藻株18S rDNA测序与进化树构建
18S rDNA基因提取与测序:离心收集对数期藻细胞,用植物基因组试剂盒提取基因组总DNA,电泳跑胶验证后进行PCR扩增。PCR反应体系(25 μL)为:基因组DNA 1 μL,上下游引物各0.5 μL,2×Taq MasterMix 12.5 μL,ddH2O 10.5 μL。PCR反应程序为94 ℃预变性5 min,94 ℃变性1 min,53 ℃退火1 min,72 ℃保留1 min,程序共设置30个循环,最后72 ℃延伸10 min。
用于扩增18S rDNA的引物序列为:18s-F:5’-GTA GTCATATGCTTGTCTC-3’;18s-R:5’-TCCGCAGGTT CACCTACGGA-3’。PCR产物测序由广州艾基生物技术有限公司完成。
藻株进化树的构建:将测序序列在NCBI数据库中进行BLAST同源性比对分析,下载相关序列,使用MEGA7.0软件,采用邻接法构建藻株进化树。
1.2.4 藻株生物量的测定
培养过程中生物量变化情况以叶绿素含量及光密度-干重曲线来反应。培养条件为温度(30 ℃),光照强度(~4000 lux),光照周期(12 h:12 h)。培养过程中,小球藻采用细胞计数法与叶绿素含量测定来衡量生物量积累情况,栅藻则通过叶绿素含量测定来衡量。
叶绿素含量测定:取1 mL藻液,12000 r/min离心弃上清,加入200 μL蒸馏水混匀,再加入1800 μL 95%无水乙醇,混匀后75 ℃水浴5 min,冷却后在波长649 nm、665 nm、750 nm处测量吸光度。叶绿素含量计算公式如下:
叶绿素a和b=5.24×(A664-A750)+22.24×(A649-A750)
OD-干重关系:取不同浓度的藻液,测定其在680 nm处的吸光度值,然后取10 mL藻液分次置于2 mL已烘干至恒重的EP管中离心,后置于60 ℃烘箱中烘干至恒重,转移至干燥器内冷却,准确称量记录重量。以波长680 nm处测得OD值为横坐标,测量得到的细胞干重为纵坐标建立OD680-细胞干重关系,得到6株藻回归方程如表1:

表1 微藻OD680-细胞干重相关性方程Table 1 Correlation equation between OD680 and dry weight of algal
1.2.5 微藻油脂含量的测定
油脂测量标准曲线的建立:采用尼罗红荧光染色法[11],以三油精为标准品,以三油精含量为纵坐标,平均检测荧光值为横坐标建立三油精-荧光值标准曲线如图 1。该图呈较好的线性关系,表明可以通测量尼罗红染色荧光值来间接测定藻细胞胞内中性油脂含量。

图1 三油精含量-荧光值标准曲线Fig.1 The standard curve between triolein content and fluorescence value
微藻油脂含量测定:取适量藻液稀释,调节使体系OD680=0.1。然后取1.5 mL稀释藻液,加入480 μL DMSO,20 μL 150 μg/mL 尼罗红染液,混匀后于 45 ℃水浴3 min,以480 nm为激发波长,580 nm为吸收波长测定荧光值。由标准曲线计算得到油脂含量。油脂百分比及油脂产量计算公式如下:

1.2.6 数据统计分析
标准曲线制作,细胞生物量及油脂含量测定均进行三次平行重复,数据汇总后以SPASS 22.0(IBM Co.Ltd)软件进行相关性分析,后利用Origin Pro 2016对数据进行整理作图。
2 结果与讨论
2.1 微藻的分类鉴定
光学显微镜观察:光学显微镜下观察藻细胞形态,结合参考《中国淡水藻类-系统、分类及生态》对微藻进行初步分类鉴定。显微观察下观察到藻株 DH1、DH2、DH6呈绿色球状,DH3、DH4、DH5则为椭圆状,且均不同程度上伴有丛生现象,由图2可看到DH3明显伴有对生现象。
分子鉴定:提取藻株基因组DNA,利用特异性引物进行PCR扩增得到微藻18S rDNA片段,由图3可得,该片段大小约为1800 bp。
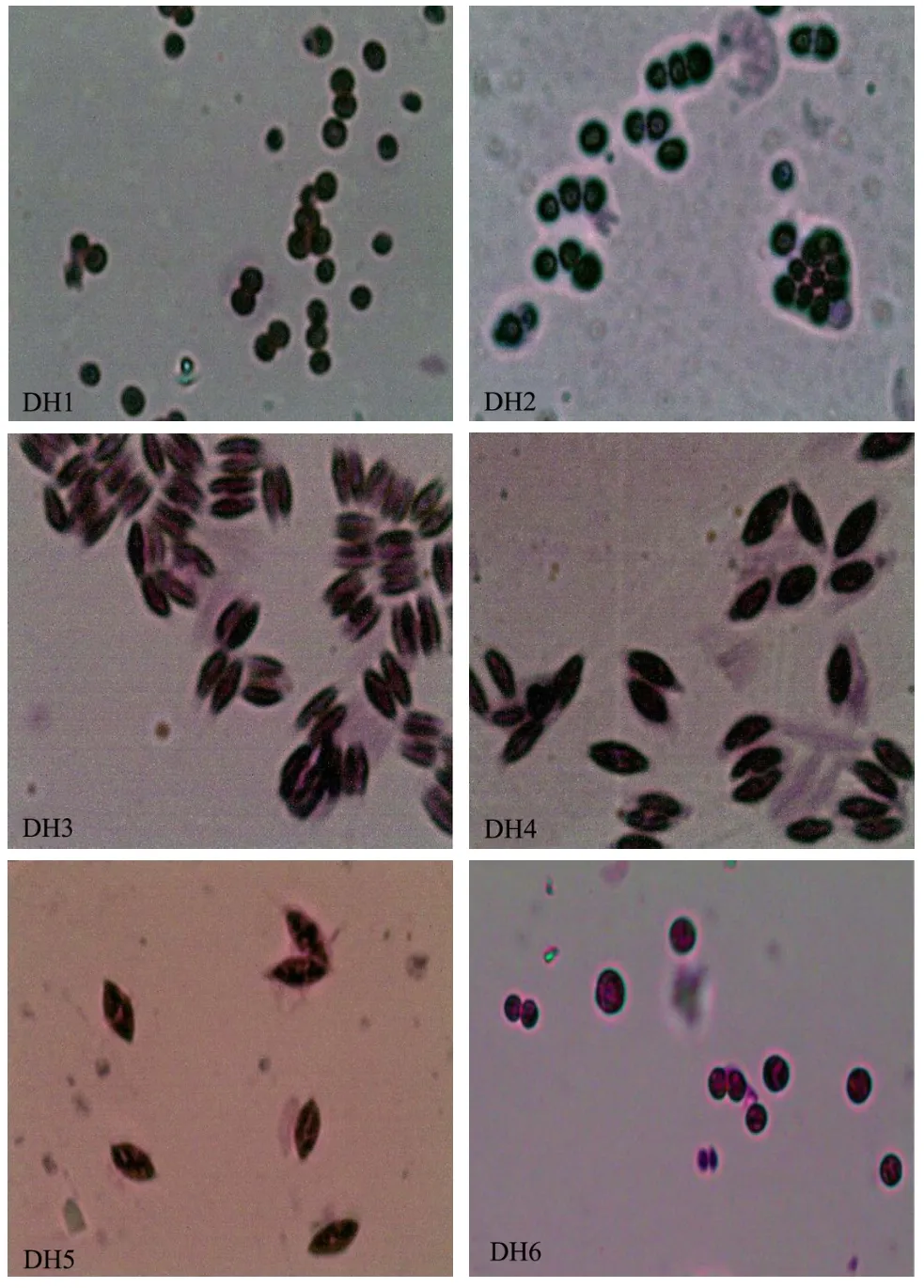
图2 光学显微镜下微藻形态特征(x100)Fig.2 Morphology of six algae in optical microscope (x100)
对 PCR产物测序,并在 NCBI数据库中进行BLAST同源性比对分析,进一步构建系统发育树如图4。结果表明DH1、DH2、DH6与Chlorellasp.18S rDNA同源性达到99%,DH3、DH4、DH5与栅藻属亲缘关系最近,其与多株栅藻的18S rDNA的序列同源性达到99%,确定其都为栅藻属。

图4 藻株18S rDNA序列系统发育树Fig.4 18S rDNA sequencephylogenetictreeofalgae
张翼等从青岛海水和武汉南湖水中筛选分离出11株小球藻和1株胶网藻[12],黄秋婷等从吉林工学院荷花池中筛选分离出4株栅藻和1株小球藻[13]。本研究从华南理工大学校内东湖中筛选分离到6株绿藻,18S rDNA鉴定结合采样点筛选分离结果表明这6株微藻分别属于小球藻属与株栅藻,其中 DH1、DH6和DH3分别筛自采样点1表层水样和底层水养,DH4和DH2、DH5分别筛自采样点2表层和底层水养,不同取样点的筛选结果差异可能与不同藻株的生长习性有关。
2.2 微藻生长及油脂积累特性研究
2.2.1 微藻生物量的测定
生物量是衡量微藻产业化的重要条件之一。而叶绿素是海洋微藻光合作用的基础,是描述海洋微藻将无机物质转变为有机物质能力的一个重要指标,可以作为衡量生物量积累的参考[14]。6株微藻的生长情况如图5所示。
从图中可知,小球藻和栅藻都能很好地在 BG11培养基中适应并快速生长,在最初的1~3 d内没有明显的生长停滞现象,SPASS统计学分析显示小球藻之间(DH1、DH2、DH6)、栅藻之间(DH3、DH4、DH5)生物量差异显著(p<0.05)。三株小球藻细胞数基本在12~15 d达到最高,之后开始出现下降,其中DH6细胞浓度相对于DH1和DH2来说在培养15 d后达到最高,为 2.74×107/mL,之后出现明显下降。小球藻叶绿素含量均在培养至15 d后达到最高,然后开始下降,同样地,DH6叶绿素含量15 d后达到最高,为10.97 mg/L。15 d后细胞数与叶绿素含量均呈现下降,此时微藻细胞逐渐进入衰亡期,生长代谢缓慢。三株栅藻叶绿素含量在18 d后达到最高,且叶绿素含量普遍高于小球藻,最高的栅藻DH5可达16.16 mg/L。

图5 藻细胞生物量积累曲线Fig.5 Biomass curves of microalgae species
2.2.2 微藻油脂积累研究
油脂积累量是衡量筛选微藻能否大规模应用于微藻柴油开发的最重要指标,本文通过对东湖水体中微藻的培养,希望可以筛选出潜在的富油微藻,以便进一步研究探讨。BG11培养基中培养25 d后收集藻细胞,测量OD680及尼罗红染色荧光值得到胞内中性油脂含量,整理如图6。
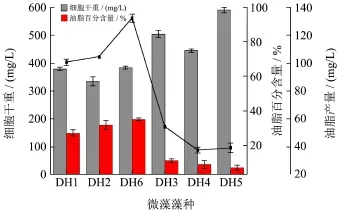
图6 微藻油脂产量比较Fig.6 Comparison of microalgae oil yields
由图6可知,小球藻细胞干重普遍低于栅藻,然而油脂产量及藻细胞油脂百分含量却比栅藻高,SPASS统计学分析显示6株微藻细胞干重与油脂产量之间均差异显著(p<0.05),其中油脂产量及油脂百分比最高的为DH6,其产量达到131.69 mg/L,其次为DH2,油脂产量达到103.89 mg/L,且这两株藻细胞油脂百分比均在30%以上,分别为34.54%和31.33%。DH1产量低于DH2和DH6,其油脂产量为100.06 mg/L,油脂百分比为 26.60%。栅藻中,DH3油脂产量及油脂百分比均高于另外两株,其数值分别为58.73 mg/L和10.73%,另外两株栅藻藻细胞油脂百分比均低于10%,最低的为DH5,仅为6.56%。由此可知,微藻生物量的积累与油脂积累并没有直接的关系,生物量积累较高不一定积累大量油脂,生物量低却反而可能较好地积累油脂。与其他一些研究工作相比,本研究筛选出的2株小球藻产油能力处于中等水平,如孙漫等从海南岛周围水域筛选出105株海洋微藻,其中33株微藻油脂产量较高,最高的藻株XG01油脂产量达到221.9 mg/L,油脂百分含量达到38.93%[15];郭建东等人在淮坊不同生境中筛选出19株产油微藻,其中有8株超过30%,两株超过40%[16];王玉荣等人从东北地区筛选分离出 14株产油微藻中有两株高于40%[17,18]。本研究筛选得到的小球藻DH2及DH6在普通BG11培养基中可积累一定的油脂,后期通过营养条件及培养条件的优化有可能进一步提高其油脂产量,两者可以选作为微藻柴油研发的潜在藻种。
3 结论
3.1 作者通过对广州华南理工东湖自然水体的筛选,共得到6株绿藻。6株绿藻通过光学显微镜观察及基因检测得知它们分别为3株小球藻和3株栅藻。培养得知该6株藻种均能在BG11培养基中较好生长。
3.2 一般来说,微藻生长与油脂积累存在矛盾关系,油脂大量积累通常发生在细胞分裂受阻即藻细胞生长收到抑制时,而生物量的积累通常与藻种、培养基营养条件、培养模式等有关[19~21]。以增加微藻生物量为基础提高藻细胞油脂含量,即同时提高微藻生物量与油脂产量,这是微藻生物柴油发展必须解决的问题[22]。分析本研究中微藻生物量及油脂积累情况可知,有些微藻生物量虽高却不能很好地积累油脂,如DH5,其叶绿素含量培养21 d后在所有微藻中最高,达到16.16 mg/L,且25 d藻细胞干重也为最高,达到587.71 mg/L,然而其油脂百分比仅为6.56%;有些藻种虽然生物量低,却能有效地积累油脂,如DH2,叶绿素含量最低,仅为9.54 mg/L,油脂百分含量却能达到31.33%。因此应该综合考虑生物量与油脂产量来权衡微藻的生长产油效率微藻产油能力与培养基营养条件和培养环境,以及缺氮等有关,不同条件下产油效果都会有所不同[23]。后续拟展开相关工作进一步研究提高其产油效率。该研究取样于华南理工校内东湖,之前未有人做过该水体微藻相关研究,因此本结果将为也为该水体微藻研究以及中国湖泊微藻研究提供一定参考和借鉴。

