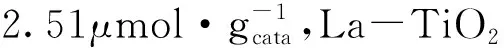金属单掺杂纳米TiO2光催化还原CO2实验研究
李 欢,王剑波
(安徽理工大学化学工程学院,安徽 淮南 232001)
近年来,全球变暖和碳资源短缺问题日益加剧,降解CO2成为研究者们研究的重点。植物的光合作用可以实现二氧化碳的转化,通过模拟这种途径,研究者们设计了人工光合作用来实现二氧化碳的转化。人工光合作用即光催化还原二氧化碳[1]。光催还原CO2的过程中光催化剂的选择至关重要,光催化剂决定产物的种类、产量等。在光照射下,利用光催化剂将CO2转化为甲烷等烃燃料的方法被视为减少大气中CO2的一种有发展前景的方法[2]。TiO2由于其制备工艺简单、产物纯净、性能稳定和无毒等优点,而被广泛运用。文献[3]通过超声喷雾热解制备过氧化钛酸前驱体,然后用湿化学法浸渍处理制备CuxO接枝富氧TiO2微球,使TiO2光催化活性大大提高。制备TiO2的方法很多,文献[4]用溶胶-凝胶法制备均相掺钛干凝胶,此法制得的TiO2粒径大小均匀且粒度较小。水热晶化法制备纳米TiO2,制得的催化剂颗粒大小不易控制,但在染料敏化太阳能电池中的光催化作用显著[5]。此外,Hongfu Sun和张少华等人采用微乳液法和化学气相沉积法分别制备了TiO2纳米催化剂[6-7],溶胶-凝胶法是实验室最常用且最安全的方法。研究发现,金属掺杂TiO2可以使TiO2的光催化活性增强,具有良好的研究价值[8-13]。
本文是以硝酸盐和钛酸四正丁酯为原料,采用溶胶-凝胶法掺杂制备了Ni/TiO2、Co/TiO2、La/TiO2金属单掺杂纳米TiO2粉体光催化剂,该制备方法简易安全。
1 实验部分
1.1 实验试剂与仪器
钛酸四正丁酯[C16H36O4Ti,化学纯];硝酸镍[Ni(NO3)2.6H2O,分析纯];硝酸镧[La(NO3)2水合,分析纯];硝酸钴[Co(NO3)2.6H2O,分析纯];无水乙醇[C2H6O,分析纯];冰乙酸[C2H4O2,分析纯];硝酸[HNO3,分析纯];氢氧化钠[NaOH,分析纯];亚硫酸钠[Na2SO3,分析纯];去离子水(自制)。
恒温鼓风干燥箱(DZF-200型),上海精宏实验设备有限公司;电阻炉(SX2-2.5-12型),上海意丰电炉有限公司;电阻炉温度控制器(KSJ0-6.3-16型),上海意丰电炉有限公司;分析天平;磁力搅拌器;扫描电子显微镜(SEM,Sirion 200型),荷兰Philips-FEI公司;红外光谱仪(FT-IR,VECTOR-33型),德国布鲁克公司;DX-2800X-ray Diffractometer X射线粉末衍射仪;差示热分析仪(TG-DTA);自制光催化反应器。
1.2 实验
光催化剂的制备:量取20mL钛酸四正丁酯于烧杯中,先加入10mL正丁醇,边搅拌边加入40mL无水乙醇,搅拌20min后滴加5mL冰乙酸,抑制钛酸四正丁酯水解,继续搅拌至溶液呈黄色澄清溶胶。标记为A液。称一定量硝酸盐于烧杯中,用4mL的水溶解,加0.5mL硝酸后再加入40mL无水乙醇搅拌10min,标记为B液。将B液以2 s/滴的速度滴入A溶液中,边滴边搅拌,滴完后持续搅拌30min,静置12h,将混合液置于80℃烘箱中干燥12h,再将烘干后的样品研磨成粉末,移至坩埚中,将坩埚放入马弗炉中以10℃/min的速率升温至580℃,煅烧5h,将得到的粉末研磨后制成金属单掺杂纳米TiO2粉末。实验中,按照不同的配比制备得到金属掺杂质量百分比为0%、0.3%、0.5%、0.7%、1.0%的单掺杂TiO2光催化剂。
催化剂表征:用XRD对光催化剂进行表征,测试的扫描范围2θ为20°~80°。样品充分研磨后用FT-IR进行扫描分析扫描范围为300~4 000cm-1。使用SEM分析纳米粉体的微观形貌。用TG-DTA对样品进行热分析,载气为空气,以10℃/min的升温速率升温至750℃。
光催化还原CO2实验:光催化还原CO2实验过程参照文献[14]。
2 结果与讨论
2.1 热重分析
对不同掺杂量的Ni/Co/La-TiO2光催化剂进行热重分析,得到如图1的TG-DTA-DSC曲线。不同掺杂量的光催化剂热重曲线基本相同,故取其中一组进行分析。分析可得到有机物的分解温度,从而确定光催化剂的焙烧温度。热重测试在空气气氛下进行,以10℃/min的升温速率从室温升温到750℃。
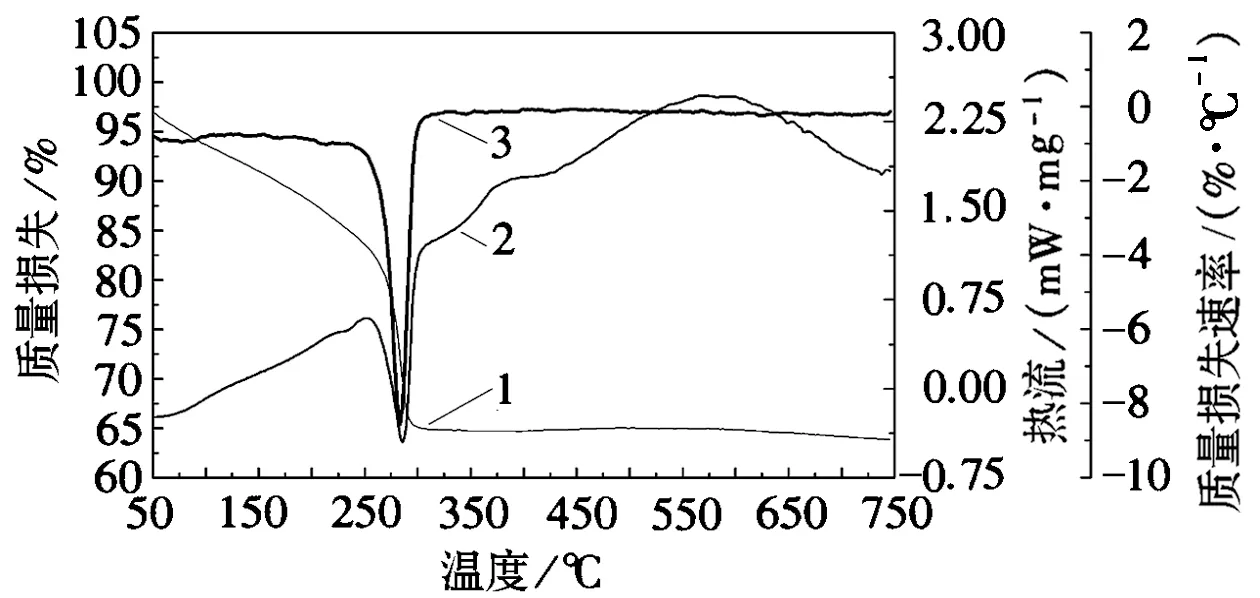
1.TG曲线;2.DSC曲线;3.DTG曲线图1 光催化剂的TG-DTA-DSC曲线图
结合TG曲线和DSC曲线共同分析。由TG曲线可知,第一阶段从室温升温到260℃,失重率约为17%,DSC曲线在此阶段出现了吸热峰,此阶段是干凝胶中吸附水和溶剂的脱除,以及其表面吸附的少量有机物的热分解所致。第二阶段是从260℃上升到300℃,失重率高达19%,此过程是TiO2前躯体脱氮的过程。第三阶段由300℃升温到450℃,失重率很小,此阶段是TiO2从非晶态向晶态转变的过程。第四阶段从450℃到620℃,此过程是锐钛矿向金红石转变的过程[15]。620℃后未发生明显失重。
2.2 XRD分析
图2是金属掺杂TiO2样品的XRD图,由图可知,Ni-TiO2和La-TiO2所有的特征峰与TiO2标准卡片PDF#21-1272一致,Co掺杂量为1.0%时的特征峰与金红石标准卡片PDF#21-1276基本一致。Ni-TiO2谱图中的衍射峰尖锐,可以看出样品结晶度较高。无明显特征峰存在,可能是Ni的掺杂量太少,没有达到出现特征峰的量,不能引起晶体畸变。Co-TiO2样品随着Co掺杂量的增加,TiO2锐钛矿晶型逐渐向金红石晶型转变,表明Co的掺入促进了锐钛矿向金红石转变,Co即使掺杂量很少也可以改变TiO2的晶型,掺杂量少于1.0%时呈混晶状态。La-TiO2样品的结晶度下降,表明La抑制了TiO2结晶,使其结晶度降低,可能是因为La的掺杂导致样品的原子序列度下降,从而抑制了晶粒的生长,造成结晶度下降或晶粒细化。通过Scherrer公式[16]可得,纯TiO2的粒径为21nm,Ni-TiO2的粒径在18~21nm之间,Co-TiO2的粒径在35~77nm之间,La-TiO2的粒径在38~80nm之间,表明Ni掺杂可以抑制晶粒的长大。La的金属性较强,可与水发生反应,可能是La在掺杂时夺取了水,使Ti和OH-的比值下降,不够合成TiO2的中间体,导致TiO2的结晶度下降。四种催化剂的粒度从小到大顺序为Ni-TiO2、TiO2、La-TiO2、Co-TiO2,结晶度顺序相反,表明催化剂的粒度与结晶度之间存在反比例关系,粒径是通过Scherrer公式得到的,Scherrer公式中粒径和衍射峰的半高宽度呈反比关系,半高宽度和结晶度呈正比关系,故催化剂的粒度与结晶度之间存在反比例关系。

1.TiO2;2.0.3%Ni/Co/La-TiO2;3.0.5%Ni/Co/La-TiO2;4.0.7%Ni/Co/La —TiO·;5.1.0%Ni/Co/La-TiO2图2 金属掺杂TiO2样品的XRD图

1.La-TiO2;2.Co-TiO2;3.Ni-TiO2图3 样品XRD图中掺杂量与2θ变化量的关系图
由图3可以看出,Ni-TiO2和La-TiO2的XRD图谱特征峰向大角度偏移且随着Ni和La掺杂量的增加向大角度偏移量也随之增加,表明它们的晶格发生畸变,晶面间距增大(晶格收缩),根据多位理论,催化剂晶格收缩,催化剂与反应物之间的几何间距减小,导致反应活化能降低,故Ni-TiO2和La-TiO2光催化活性增强。Co-TiO2的XRD图谱特征峰向小角度偏移且随Co掺杂量的增加向小角度偏移量逐渐降低,表明Co-TiO2发生晶格畸变(晶格扩张),同晶胞收缩的情况相反,故Co-TiO2光催化活性降低。
2.3 FT-IR分析
由图4各金属掺杂TiO2的红外谱图可看出,各金属图谱中在450~750cm-1区域内出现了TiO2八面体中的Ti-O的强伸缩振动峰,在2 925cm-1处出现了TiO-H的弱伸缩振动峰,在3 394cm-1处出现了弱强度的非缔和伸缩振动峰,在1 385cm-1处的中强衍射峰为O-O超氧基特征峰,此超氧基在TiO2表面。在1 037cm-1有一个TiO2面内较强的OH弯曲振动峰。由图4可知,金属负载后,各样品的超氧基特征峰强度均变弱了,可能是因为金属在掺杂过程中夺去了TiO2表面的氧,导致超氧基特征峰强度变弱。La负载使TiO2面内OH弯曲振动峰减弱,可能是因为铜离子的电子亲和能力较强,夺走了面内OH-,导致特征峰减弱。Ni-TiO2、Co-TiO2和La-TiO2的红外谱图中均未出现相应的金属氧化物的特征峰,可能是因为金属掺杂量较少,未达到出现特征峰的量,这一结果和XRD结果一致。
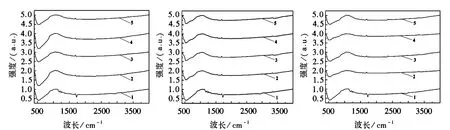
1.TiO2;2.0.3%Ni/Co/La-TiO2;3.0.5%Ni/Co/La-TiO2;4.0.7%Ni/Co/La-TiO2;5.1.0%Ni/Co/La-TiO2图4 Ni/Co/La掺杂TiO2的FT-IR图
2.4 SEM分析
由图5可知,(1)是纯TiO2,样品表面光滑,均匀负载少量小微粒。(2)为Ni-TiO2,表面凹凸不平且存在着许多小孔,说明Ni使TiO2结构发生了改变,使样品的比表面积增大,正是因为这个原因使得(2)的光催化活性大大提高。(3)是Co-TiO2,它和纯TiO2的区别是c的表面没有了太多的棱角且表面负载的微粒更小和更多,表面无任何缺陷不利于光催化还原CO2。(4)为La-TiO2,它的棱角变得更加尖锐且表面负载的微粒更大,可以为CO2提供更多的吸附点,故光催化活性比TiO2强。

图5 Ni/Co/La掺杂TiO2的SEM图
3 光催化还原CO2实验结果
两组空白实验未检测出气液体产物中有任何有机物存在,故推知,光催化剂和光照是光催化还原CO2的两个必要因素,二者缺一不可。
光催化还原CO2反应的气相未检出任何有机物,液相产物有甲醇和少量的甲烷和CO,其中甲醇产量最多,以甲醇作为目的产物,分析催化剂光催化活性。反应温度为80℃。图6为不同催化剂下随反应时间变化的甲醇产率。Ni/Co/La-TiO2光催化剂的甲醇产率都是随着负载量增加而增加的,故每种光催化剂均取1.0%掺杂量作图。

1.Co-TiO2;2.TiO2;3.La-TiO2;4.Ni-TiO2图6 金属掺杂TiO2对甲醇产率的影响
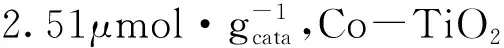
4 结论
采用溶胶-凝胶法制备了TiO2、Ni-TiO2、Co-TiO2和La-TiO2光催化剂,此制备方法操作简便,所得催化剂粒径分布均匀且比表面积增大,为CO2吸附提供更多位点,使金属负载光催化剂的光催化活性提高。四者的光催化活性从大到小顺序为Ni-TiO2、La-TiO2、TiO2、Co-TiO2。
利用XRD、FT-IR和SEM等表征手段对样品进行表征。由XRD图谱得到Ni-TiO2和La-TiO2为锐钛矿相,Co-TiO2以金红石相为主,Ni-TiO2的结晶度最高,La-TiO2的结晶度最低。Ni-TiO2、Co-TiO2和La-TiO2的FT-IR图谱均保持着TiO2原本的特征峰,但超氧特征峰减弱,表明Ni、Co、La均以氧化物的形式存在于TiO2上。