利用隐性性状及其分子标记快速选择大白菜育种纯系
张烨 贺立龙 魏清岗 王红霞 李景娟 王凤德 徐少君 荆世新 孙令强 李洪雷 邓永林 高建伟


摘要:加快纯系选育速度、缩短育种进程,是大白菜新品种选育的重要目标。本试验利用大白菜桔红色、无表皮毛、亮绿秆三个隐性性状及其分子标记辅助大白菜优良纯系选择,开展加快大白菜育种效率的研究。结果表明:该分子标记属于基因本身外显子区段的InDel或SNP标记,选择效率高(100%),可使大白菜优良纯系培育时间缩短3年,与常规育种相结合形成的育种技术体系,可实现桔红心、无表皮毛、亮绿秆优质大白菜新品种选育的精准分子设计。本研究结果直接来源于大白菜育种实践,具有重要的理论和实践价值。
关键词:大白菜;隐性性状;分子标记;分离纯化;育种效率
中图分类号:S634.103.7 文献标识号:A 文章编号:1001-4942(2019)12-0007-08
Abstract Improving the speed of breeding pure lines and shortening the breeding process were the goals of breeding new Chinese cabbage varieties. Here, we used three recessive traits, including orange color, non-trichome and bright green stem, and their molecular markers to assist the selection of fine pure lines in Chinese cabbage in order to accelerate the breeding efficiency. The results showed that the molecular markers with higher selection efficiency as 100% belonged to InDel or SNP markers of the gene exon segment, which could shorten breeding time of excellent pure lines in Chinese cabbage by three years. They could realize precise molecular designation about orange color, non-trichome and bright green stem in Chinese cabbage compared with conventional breeding. The results were directly derived from the breeding practice of Chinese cabbage, so they had important theoretical significance and practice value.
Keywords Chinese cabbage(Brassica rapa L.ssp. pekinensis);Recessive traits; Molecular marker; Separation and purification; Breeding efficiency
大白菜(Brassica rapa L. ssp. pekinensis)起源于中國,是我国分布最广、种植面积最大的蔬菜作物,素有“国菜”之称,其丰欠对能否满足人们生活需求有一定影响[1,2]。长期以来,研究者对大白菜新品种选育及良种良法配套技术研究较多。因其是典型的异花授粉作物,育种方式以杂种优势育种为主,生产用种主要是一代杂交种。F1代杂交种制种方式有两种:一是利用自交不亲和性生产,二是利用雄性不育系生产,目前市场以第一种制种方式为主。大白菜具有自交不亲和性,即使高自交结实的亲本纯系,也具有系内自交迟配的特性,这是目前利用优良的纯合亲本生产F1代杂种的理论基础,也是利用自交不亲和性生产F1代杂种占据多数市场的主要原因[1]。上述杂种优势育种的关键是快速选育优良亲本纯系,筛选出优良组合。而加快纯系选育速度、缩短育种进程,是大白菜新品种选育的重要目标。
为提高选择效率、加快育种进程,人们使用的方法主要有细胞工程技术和分子育种技术。单倍体培养(包括小孢子培养、未受粉子房或胚珠培养等)属于细胞工程技术,主要用于快速获得纯系植株。1989年,Sato等[3]首次报道用早熟大白菜品种的小孢子成功诱导再生植株。我国大白菜小孢子培养研究虽然起步晚于日本,但育种实践应用最早,已成功育成豫新5号、豫白菜7号、豫白菜12号、京秋1号等品种[1,4-6]。因受供试材料基因型等多种不确定因素的影响,该方法的利用受到限制。随着大白菜基因组测序的完成、重要性状基因及其分子标记的挖掘、遗传转化体系的优化和CRISPR/Cas9基因编辑技术的不断完善,分子育种技术正成为大白菜育种的重要方法。因此,重要性状功能基因及其分子标记辅助选择技术,也逐步成为提高大白菜育种效率的重要工具[1]。
桔红色、无表皮毛及亮绿秆(叶)是大白菜的3个重要农艺性状,均属单基因控制的隐性质量性状。控制大白菜桔红心性状形成的关键基因是BrCRISO([STBX]Bra031539[STBZ]),位于A09染色体[7],与该性状紧密连锁的分子标记有SNP(C952-T952)和InDel标记(Bror-intron1),SNP(C952-T952)标记可造成BrCRISO氨基酸的突变(L318-F318),InDel标记(Bror-intron1)则在桔红心BrCRISO基因的第1个内含子上,与白心相比存在25个碱基的插入[8],因此,可以用来鉴定桔红心与白心大白菜。控制大白菜无表皮毛性状的遗传位点位于A06染色体,该性状形成的主要原因是[STBX]BraGL1[STBZ]基因的第3个外显子区域存在5个碱基的插入,造成蛋白翻译的提前终止,据此本课题组开发了无表皮毛分子标记GL1-CDS-MK[9]。2012—2013年间,我们试图验证[STBX]Bra013809[STBZ]基因突变是导致大白菜亮绿秆产生的原因,但是Zhang等[10]已研究出控制大白菜亮绿秆(叶)形成的关键基因是[STBX]BrWax1[STBZ]([STBX]Bra013809[STBZ]),位于A01染色体上,与该性状紧密连锁的分子标记是BRNW标记,它在[STBX]BrWax1[STBZ]基因的第一个外显子中有130 bp的插入[11]。常规育种中,利用隐性性状可以快速纯化分离个体,提高选育效率,而分子标记辅助选择可以快速聚合多个优良性状。本研究拟利用大白菜桔红色、亮绿秆和无表皮毛三个隐性性状及其分子标记辅助大白菜优良纯系选择,以期大幅度提高大白菜育种效率,并为育种实践提供参考。
1 材料与方法
1.1 材料
大白菜种质资源材料100份(表1)。利用分子标记进行鉴定,结合综合农艺性状,选配组合;5个杂交组合分别为:玉青×津绿75、黄娃1×金贝贝、石特×Am198、叠锥抗×Am199、黄娃1×黄娃2的F1,以及F1自交分离后代至F10。
1.2 总DNA提取
大白菜叶片经液氮冷冻后快速研磨,采用CTAB法进行DNA提取[10],利用1%琼脂糖凝胶电泳进行DNA质量检测。
1.3 PCR扩增
PCR反应体系(20 μL):cDNA模板2 μL,5×FastPfu DNA Polymerase buffer 4 μL,2.5 mmol/L dNTP 2 μL,10 μmol/L 5′引物、3′引物各1 μL,FastPfu DNA Polymerase 0.5 μL,ddH2O 9.5 μL。扩增所用引物见表2。PCR反应程序根据引物的退火温度和目的片段的长度设定。PCR反应结束后,进行琼脂糖凝胶电泳。
1.4 SDS-PAGE电泳检测
将PCR产物与上样缓冲液混匀,95℃预变性10 min,取4 μL点样,利用8%变性聚丙烯酰胺凝胶电泳进行检测,在Sequi-GenGT核酸电泳系统(Bio-Rad,USA)中进行电泳分离,25℃、55 W恒功率下电泳1 h,电极缓冲液为1×TBE,银染法显影,拍照并记录结果。
1.5 生物信息学分析
将克隆的基因序列在GenBank中进行BLAST检索,查找大白菜目标基因在其它物种中的同源序列。利用DNAMAN 6.0软件对来自不同物种的基因编码氨基酸序列进行比对并构建系统进化树。
2 结果与分析
2.1 大白菜BRNW分子标记
拟南芥(Arabidopsis thaliana)ECERFERUMP ([STBX]cer2[STBZ]) 基因突變可产生亮绿色的茎秆与果荚,若生物之间亲缘关系相近,它们的基因组就会表现出共线性,即基因序列部分或全部保守。因此,我们利用拟南芥[STBX]AT4G24510[STBZ]基因序列及其编码的氨基酸序列在BRAD(http://brassicadb.org/brad/)中搜寻,获得了对应的大白菜[STBX]Bra013809[STBZ]基因及其序列。分别对亮绿秆、灰秆大白菜纯系进行[STBX]Bra013809[STBZ]基因扩增,结果如图1所示,亮绿秆纯系在靠近5′端的外显子中有一个130 bp的插入片段(图2)。
2.2 大白菜无表皮毛GL1-CDS-MK分子标记
王红霞等[9]利用母本冠291(P1)与父本早黄白(P2)的杂交F2代群体进行无表皮毛GL1-CDS-MK分子标记,扩增带型及序列如图3、图4所示。
2.3 大白菜桔红心InDel标记
大白菜桔红心InDel标记Bror-intron1如图5所示,与白心相比存在25个碱基的插入(图6)。
2.4 大白菜亮绿秆、桔红心及无表皮毛分子标记在优良种质资源筛选中的应用
利用三个分子标记对100份种质资源进行鉴定(图7),并结合综合农艺性状,共筛选获得28个优良种质资源(表3)。
2.5 大白菜亮绿秆、桔红心及无表皮毛分子标记在优良亲本创制中的应用
利用亮绿色BRNW标记、桔红心InDel标记以及无表皮毛GL1-CDS-MK标记,结合自交分离纯化,我们仅用2年时间就选育出大白菜纯系贝迷你1(自交不亲和系)、娃短1(自交不亲和系)、高娃黄(自交不亲和系)、绿12-430(自交不亲和系)、绿12-1466(自交不亲和系)。贝迷你1:叶球内叶黄色,直筒形,亮绿秆(叶)。娃短1:耐抽薹性好,黄心,外观形状好,抗多种病害。高娃黄:叶球比贝迷你1和娃短1大,属中型,直筒形,黄心,剖面对称。绿12-430:筒形合抱,叶深绿、无毛,黄心,抗霜霉病、黑斑病、病毒病。绿12-1466:田间表现高抗病毒病,叶深绿、无毛,叶球合抱、柱形,配合力好。
2.6 优良组合及新品种培育
2.6.1 高春黄1号 母本为贝迷你1,父本为娃短1。2013年进行第一次测配,2014年确定品系高春黄1号(图8)。生长期55~60 d。近中棵,株高35 cm,开展度40 cm,球高25 cm,球粗16 cm,球形指数1.8。粗纤维少,口感好,质地脆嫩,熟食易烂。外叶绿色,叶柄白色,心叶黄色,叶面微皱、有毛。球叶扣抱,球顶尖,叶球小炮弹形。单球重1.0 kg,净菜率72%以上。耐抽薹性强。2015、2016年品种比较试验分别比对照京春娃3号增产7.35%、7.13%。对三种病害(霜霉病、病毒病和软腐病)的抗性均为抗,霜霉病、病毒病、黑腐病的病情指数分别为21.16、27.57、24.35。
该品种春、秋均可种植,由于生长期短,可根据上市时间分期播种。因耐抽薹性强,又可早春种植,但需要保护设施。平畦种植和起垄种植均可。起垄种植:株行距35 cm×(50~60)cm,定植密度每666.7m2 3 500株左右。畦栽:株行距35 cm×40 cm。冬季、早春和秋季晚播种植因温度低,生长期延长,叶球小,种植密度适当加大。施肥应注意重施基肥和早追肥,加大有机基肥用量,注意氮磷钾肥配合使用,及时浇水,及时防治菜青虫、小菜蛾等各种害虫。收获前一周停止浇水,成熟后及时收获。
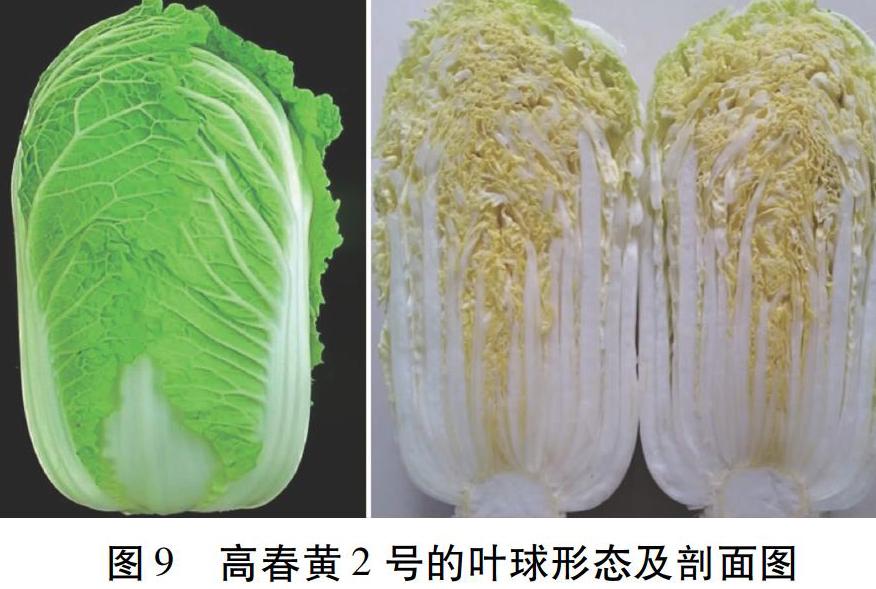
2.6.2 高春黄2号 母本为高娃黄,父本为贝迷你1。2014年进行第一次测配,2015年确定品系高春黄2号(图9)。生长期55 d。近中棵,株高37 cm,开展度50 cm,球高27 cm,球粗16 cm,球形指数1.8。粗纤维少,口感好,质地脆嫩,熟食易烂。外叶绿色,叶柄白色,叶球心叶黄色,叶面微皱、有毛。球叶扣抱,球顶尖。单球重1.5 kg,净菜率70%以上。耐抽薹性强。抗病毒病、霜霉病、软腐病。2016、2017年品种比较试验比对照京春娃3号增产8.15%、9.12%。
该品种春、秋均可种植,由于生长期短,可根据上市时间分期播种。因耐抽薹性强,又可早春种植,但需要保护设施。平畦种植和起垄种植均可,种植方式与高春黄1号相似。施肥应重施基肥和早追肥,加大有机基肥的用量,注意氮磷钾肥配合使用,及时浇水,及时防治菜青虫、小菜蛾等各种害虫。收获前一周停止浇水,成熟后及时收获。
2.6.3 高绿1号 母本为绿12-430,父本为绿12-1466。2012年进行第一次测配,2013年确定品系高绿1号(图10)。该品种适合包装运输,抗病,中晚熟,生长期72 d左右,株高55 cm,高桩直筒青麻叶类型,净菜率为78%,单球重3.0 kg。株型直立紧凑,外叶少,叶色深绿、无毛,中肋浅绿色球顶呈花心,叶纹适中,品质优良。室内苗期人工接种高抗病毒病、霜霉病和软腐病。2014、2015年品比试验比对照津绿75增产5.1%、5.7%。
该品种属中熟偏早熟类型,在山东8月中旬可播种。高垄栽培,每666.7m2 种植2 500株左右。
施肥应重施基肥和早追肥,注意氮磷钾肥配合使用。苗期防水淹、干旱,结球初期重施氮肥和钾肥,及时浇水,生长期间及时治虫防病。收获前一周停止浇水,成熟后及时收获。
2.6.4 高绿2号 母本为贝迷你1,父本为绿12-430。该品种(图11)早熟,生长期55~60 d,株高26 cm,开展度45 cm,直筒,净菜率为79%,单球重1.5~2.0 kg。株型直立紧凑,叶色深绿,中肋浅绿色球顶呈合抱,叶纹适中,品质优良。室内苗期人工接种高抗病毒病、霜霉病和软腐病。2015、2016年品种比较试验比对照京春娃3号增产6.6%、7.2%。
该品种在山东早春、秋季8月中旬均可播种。高垄栽培,每666.7m2 种植5 000株左右;可畦播,每666.7m2 种植6 500株左右。春播要地膜覆盖。施肥应重施基肥和早追肥,加大有机基肥用量,注意氮磷钾肥配合使用,及时浇水,及时防治菜青虫、小菜蛾等各种害虫。收获前一周停止浇水,成熟后及时收获。
3 讨论与结论
杂种优势育种是作物改良的一个有效手段。现已广泛应用于玉米、水稻等粮食作物,棉花、油菜等油料作物,以及大白菜、青梗菜、甘蓝、菜花、番茄、黄瓜、西瓜、西葫芦等蔬菜作物的育种实践中[12,13]。杂种优势育种的关键是如何快速获得自交纯系。传统育种对目标性状的改良,需要将供体亲本(含相对应的优良性状)的花粉授给受体亲本(需改良性状的亲本),再经过5~10代的回交和背景选择,最后筛选出目标性状改良、其它性状完全像受体亲本的纯系个体,用于下一步育种。上述过程费时、费力,成本昂贵,特别是因表型观察准确性和遗传累赘效应等因素的影响,选择效果并不总能与预期育种目标相符[14,15]。因此,提高选择效率、加快育种进程、建立快速精准的育种技术显得越来越重要。本研究将位于3个不同染色体上的单基因隐性性状及其分子标记辅助选择技术应用于大白菜育种实践中,大大提高了育种效率,使育种年限缩短3年左右。
本研究发现,将三隐性性状及其分子标记应用于辅助选择育种时,亲本材料需要具备优良的综合农艺性状,其A01、A06和A09染色体上的重要农艺性状要符合育种目标要求,不能有严重缺陷,否则会延长育种进程;若能结合使用遗传位点位于其它七个染色体上的独立隐性分子标记辅助选择,选择速率会更高。
Wang等报道了一种称为IMGE (haploid inducer-mediated genome editing)的育种策略,巧妙地将单倍体诱导与CRISPR/Cas9基因编辑技术结合起来,成功地在两代内创造出经基因编辑改良的双单倍体(DH)纯系[16]。该研究结果与Kelliher等[17]较先提出的HI-Edit育种策略不谋而合。两篇完全独立的报道为该策略的可靠性提供了进一步的佐证。Kelliher等(2019)还发现HI-Edit技术可以和CENH3系统结合用于双子叶作物的改良;利用携带有Cas9-TaGT1s 载体的玉米转基因植株的花粉授给已去雄的小麥品种AC Nanda或者胞质雄性不育系(CMS)植株的柱头上,通过胚拯救的方式成功获得经基因编辑改良的小麦单倍体植株[17]。IMGE和HI-Edit为农作物遗传改良提供了一种快捷、精准的方法,但其高效使用的前提是必须有单倍体诱导系[18]。对于绝大多数农作物来说,高效的单倍体诱导系尚未被发现或创制。在这种情况下,应当开发寻找其它高效育种方法,把多个优良隐性性状及其分子标记应用于辅助选择不失为一种明智的策略。
参 考 文 献:
[1] 柯桂兰.中国大白菜育种学[M].北京:中国农业出版社,2010:16-34.
[2] 徐家炳,张凤兰.中国大白菜图鉴[M].北京:中国农业出版社,2016:1-32.
[3] Sato T,Nishio T, Hirai M. Plant regeneration from isolated microspore cultures of Chinese cabbage (Brassica campestris spp. pekinensis)[J]. Plant Cell Reports,1989,8(8):486-488.
[4] 栗根义,高睦枪,杨建平,等.利用游离小孢子培养技术育成豫白菜7号(豫园1号)[J].中国蔬菜,1998(4):16-19.
[5] 高睦枪,张晓伟,耿建峰,等.通过游离小孢子培养育成的优质大白菜新品种‘豫白菜12号[J].园艺学报,2001,28(1):88-94.
[6] 耿建峰,原玉香,张晓伟,等.利用游离小孢子培养育成早熟大白菜新品种‘豫新5号[J].园艺学报,2003,30(2):249-256.
[7] 張一卉,李化银,王凤德,等.优质桔红心大白菜种质创新与新品种选育[J].山东农业科学,2017,49(5):14-22,26.
[8] Li J J, Zhang Y H, Ding Q, et al.Transcriptome analysis of orange head Chinese cabbage (Brassica rapa L. ssp. pekinensis) and molecular marker development[J]. International Journal of Genomics,2017,2017:6835810.
[9] 王红霞. 大白菜产量相关性状的QTL定位及叶片毛刺基因的精细定位与克隆[D]. 济南:山东大学,2018.
[10]Zhang X, Liu Z, Wang P, et al. Fine mapping of BrWax1, a gene controlling cuticular wax biosynthesis in Chinese cabbage (Brassica rapa L. ssp.pekinensis)[J]. Molecular Breeding,2013,32(4):867-874.
[11]梁爽,原玉香,张晓伟,等.大白菜InDel-PCR反应体系的优化[J].河南农业科学,2012,41(9):110-113.
[12]卢庆善,孙毅,华泽田.农作物杂种优势[M].北京:中国农业科学技术出版社, 2001.
[13]孙其信主编.作物育种学[M].北京:高等教育出版社,2011.
[14]Peng T,Sun X, Mumm R H. Optimized breeding strategies for multiple trait integration:Ⅰ.minimizing linkage drag in single event introgression[J].Molecular Breeding,2014,33(1):89-104.
[15]Li C X, Liu C L, Qi X T, et al. RNA-guided Cas9 as an in vivo desired-target mutator in maize[J]. Plant Biotechnology Journal, 2017, 15(12):1566.
[16]Wang B, Zhu L, Zhao B, et al. Development of a haploid-inducer mediated genome editing system for accelerating maize breeding[J]. Molecular plant,2019,12(4):597-602.
[17]Kelliher T, Starr D, Su X, et al. One-step genome editing of elite crop germplasm during haploid induction[J]. Nature Biotechnology,2019,37(3):287-292.
[18]Kelliher T, Starr D, Richbourg L, et al. MATRILINEAL, a sperm-specific phospholipase, triggers maize haploid induction[J]. Nature, 2017, 542:105-109.

