植物挥发物对黏虫性诱剂引诱效果的影响
蒋世雄 张蕾 程云霞 仵均祥 江幸福

摘要 :黏虫Mythimna separata (Walker)是一种重要的季节性、远距离迁飞害虫,近些年在我国的发生有明显加重的趋势。本试验运用电生理学技术和风洞技术,测定黏虫的触角对5种植物挥发物的反应,并进一步评价了植物挥发物与黏虫性诱剂在田间联合应用对成虫的诱捕效果,为黏虫性诱剂的高效利用和虫情监测提供依据。电生理学试验结果表明,黏虫雌、雄蛾对苯乙醛、芳樟醇、Z 3 己烯基乙酸酯的反应有显著差异(P<0.05)。除α 法尼烯外,黏虫雌、雄蛾对植物气味化合物的触角电位值均随浓度的升高而升高;风洞行为试验结果表明,与对照相比,雄蛾对苯乙醛、Z 3 己烯基乙酸酯、β 石竹烯均表现出逆风飞行行为(比例分别为 50.6%、50.3%和44.9%),芳樟醇则对雄蛾具有一定的驱避作用。田间试验结果表明,单一植物挥发物对黏虫的吸引力较小,且各挥发物之间无显著差异;苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯和性诱剂组合配方的引诱效果最佳,诱捕量是单独使用性诱剂的1.8倍(P <0.05)。
關键词 :黏虫; 性诱剂; 植物源挥发物; 增效作用; 田间诱捕
中图分类号:
S 433.4
文献标识码: A
DOI: 10.16688/j.zwbh.2018479
Effects of plant volatiles on the attractive effect of sex attractants of Mythimna separata (Walker)
JIANG Shixiong1, ZHANG Lei2, CHENG Yunxia2, WU Junxiang1, JIANG Xingfu2
(1. State Key Laboratory of Crop Stress Biology in Arid Areas, College of Plant Protection, Northwest A&F University,
Yangling 712100, China; 2. State Key Laboratory for Biology of Plant Disease and Insect Pests, Institute of Plant
Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China)
Abstract
Mythimna separata (Walker) is a seasonal, long distance migratory pest which causes significant damage to food crops in the past several years in China. In order to provide an effective method for predicting its migration and population dynamics, we used electrophysiological and wind tunnel techniques to test the response of M.separata to several plant volatiles, and further evaluated the trapping effect of sex attractants combined with plant volatiles in the field. EAG tests showed that the male and female moths had significant differences in their responses to phenylacetaldehyde, linalool, and Z 3 hexenyl acetate (P<0.05). EAG values increased with increasing concentrations of plant volatiles, except for α farnesene. The wind tunnel behavior test showed that the upwind behavior of male moths for phenylacetaldehyde, Z 3 hexenyl and β caryophyllene acetate reached 50.6%, 50.3% and 44.9%, respectively, compared to the control, while linalool showed a certain repellent effect against M.separata. Field experiments showed that the single plant volatiles were less attractive to the oriental armyworm and there was no significant difference among all tested volatiles. The combination of phenylacetaldehyde, β Caryophyllene, Z 3 hexenyl acetate with sex pheromones of M.separata had the best attractive effect in all formulas and the ratio of insect attraction to pheromone alone reached 1.8 (P<0.05).
Key words
Mythimna separata; sex attractant; plant volatile; synergism; field trapping
黏虫Mythimna separata (Walker)又名行军虫,属鳞翅目夜蛾科,是一种暴食性、迁飞性害虫,每年有4~5次大范围迁飞过程[1],在我国除新疆外其他各省市均有发生为害。其幼虫主要取食禾本科植物,对水稻、小麦、玉米等粮食作物的安全生产造成严重威胁[23]。近年来,随着气候条件、种植结构及自身适应性等的变化,黏虫在我国的发生有明显加重的趋势[45]。
昆虫性信息素作为一种绿色防控技术,已被广泛应用于多种农业害虫的监测预警、大量诱捕和干扰交配的防治实践中[610]。黏虫信息素的组分鉴定及应用在国内早有报道,前人利用超微量技术测得其含有顺 11 十六碳烯醛(Z11 16:Ald)、顺 9 十六碳烯醛(Z916Ald),并且運用电生理学技术证实二者可引起黏虫雄蛾的电生理学反应[1112];田间试验表明单一组分Z11 16:Ald就能诱捕到黏虫[13];刘孟英等[14]发现Z11 16:Ac对Z11 16:Ald有增强效果;宋亚茹等[15]运用GC MS检测并通过室内选择试验表明Z11 16:Ald、十六碳烯醛(16:Ald)和顺 11 十六碳烯醇(Z11 16:OH)为黏虫种群的雌蛾性信息素特征成分。但也有报道认为黏虫性诱剂在田间应用的引诱效果并不理想[16]。
自然界中,昆虫取食、交配及产卵等行为均受环境中复合气味影响。将植物挥发性气味纳入害虫综合治理,能更好地协调农业、化学、物理和生物等防治技术之间的相互关系,最终达到生态调控的目的[17]。当前,已有将植物挥发性物质和昆虫信息素协同作用应用于小菜蛾Plutella xylostella、苹果蠹蛾Cydia pomonella、甜菜夜蛾Spodoptera exigua、斜纹夜蛾S.litura等多种害虫的综合治理的实践当中[1821]。
基于前期我们对黏虫迁飞过程中密切相关的蜜源植物——紫云英Astragalus sinicus花香特征成分的鉴定[22],本试验选择一些有代表性的植物挥发物,利用触角电位(electroantennogram,EAG)和风洞(wind tunnel)技术,测定黏虫的触角电位反应和风洞反应,并进一步结合黏虫性诱剂进行田间试验,旨在为黏虫性信息素的高效利用和虫情监测提供更好的技术手段。
1 材料与方法
1.1 供试材料
1.1.1 供试虫源
田间采集的黏虫在室内饲养,并繁殖多代。养虫室温度(25±1)℃,相对湿度约70%、光周期L∥D=14 h∥10 h。成虫羽化后置于纱笼 (25 cm×20 cm×20 cm)中,用10%蜂蜜水饲喂。
1.1.2 供试试剂
依据前期对与黏虫迁飞密切相关的蜜源植物紫云英Astragalus sinicus花香成分的鉴定结果(未发表数据),以及前人报道的对黏虫具有电生理学活性反应的植物挥发物[23]、对其他鳞翅目蛾类具有增效作用的植物挥发物选择供试试剂。苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯的标准品购自北京百灵威化学技术有限公司,芳樟醇和α 法尼烯购自东京化成工业株式会社。其标准化合物纯度和选择参考见表1。
1.1.3 触角电位仪
选用德国Syntech公司生产的触角电位仪,该装置主要由显微操作台(MP 12)、IDAC 2双通道数据采集控制器、EAG和GC/EAD信号记录分析软件、PRG 2昆虫触角电位探头及刺激气流控制单元5部分组成。
1.1.4 风洞装置
风洞外壁由透明的有机玻璃制成,规格为长×宽×高=2.0 m×0.8 m×0.8 m。风洞的鼓气装置包括风扇和过滤器,风速调节为0.3~0.4 m/s。观察室采用红色灯管光源,光强调节在1.0~1.5 lx。风洞室温24~26℃,相对湿度60%~70%。每种样品测试后,用乙醇清洗风洞内侧。
1.1.5 田间试验供试场所
田间试验于2018年6-8月在吉林省公主岭市吉林省农业科学院试验田(43°30′38″N,124°48′14″E)进行,试验田地势平坦。种植作物为玉米大豆混栽,玉米长势良好,经调查,此地为二代黏虫迁入区。
1.1.6 田间供试诱芯与诱捕器
黏虫诱芯为凹型橡皮诱芯,购自宁波纽康生物技术有限公司;将植物挥发物原液用液体石蜡稀释为102μL/mL,将稀释后的植物挥发物加到2.0 mL的塑料离心管中即为植物挥发物诱芯;诱捕器为桶式诱捕器,购自北京中捷四方生物科技股份有限公司,诱捕器离地面约1.5 m,各诱捕器“Z”字形排列,诱捕器之间相距≥20 m,每个处理重复4次。
1.2 供试方法
1.2.1 标准溶液配制
供试的气味化合物的5个标准品用正己烷配制成5个浓度梯度,分别为0.001、0.01、0.1、1和10 μg/μL,首先制备10 μg/μL的溶液,再依次稀释10倍以获得其他浓度。用移液枪吸取10 μL稀释液滴加到对折的滤纸条(0.4 cm×4 cm)上,放置1 min,待溶剂挥发后,装入内径3 mm,长12 cm的巴斯德管内,并用Parafilm膜将两端管口封好备用。
1.2.2 触角电位反应试验
将2~3日龄黏虫雌、雄蛾触角用解剖刀沿基部切下,尖端切去0.5 mm,用导电硅胶将触角与EAG的两个银电极联结,然后将电极插入EAG探头中,将巴斯德管尖端插入通有连续气流的钢管(直径12 mm,长17 cm)上一小孔内(小孔直径3 mm,距离钢管气流出口处12 cm),钢管内连续气流速度为4 mL/s,刺激管的阔端与软管相连,软管中间隔气流速度同样为4 mL/s。刺激时间为500 ms,刺激间隔1 min。
EAG信号稳定后,对触角电位反应值进行记录。以滴加10 μL石蜡的滤纸条为对照, 100 ng的Z 3 己烯醇为参比,每根触角先用对照和参比刺激,然后按浓度从低到高依次进行测试,最后再测试对照参比。刺激时间为0.5 s,两次刺激之间的间隔时间≥30 s,黏虫雌、雄成虫各有6个重复。
1.2.3 风洞行为测试
选用2~3日龄雄蛾,进入暗期3 h后移入风洞条件下适应0.5 h,置于距风洞下风端25 cm、距底部约15 cm处的释放支架上,每头雄蛾只使用1次。测试时,将诱芯置于上风端的诱芯架上,受试雄蛾从下风端的放虫口处放入。风洞放虫口处放一支架,待测雄蛾置于其上,任其反应2 min,如无反应则换下。每个处理重复4次,共60头雄蛾。
依据以下标准判断其行为:①兴奋:雄蛾触角摆动,振翅,前足不断地梳理触角,在支架上爬行;②起飞:雄蛾离开支架逆风飞行;③定向飞行:逆风定向飞行距离大于等于风洞长度的1/2;④到达气味源:距离气味源≤10 cm降落[2729]。
1.2.4 田间诱捕试验
田间诱捕试验分为单一植物挥发物的引诱试验和植物挥发物与性信息素结合引诱试验两部分:
单一挥发物诱捕试验对照为液体石蜡。植物挥发物诱芯挂于诱捕器盖下端2 cm处,离心管盖中央开直径为1 mm小孔,每个配方野外引诱时间为30 d。不同配方的诱捕器隨机分布于大田中,处理间距离≥20 m,每天检查并记录诱集量,并剔除成虫,根据化合物的挥发程度进行补充,隔天随机调换诱捕器位置。
协同增效试验对照为黏虫性诱芯。植物挥发物单一组分或混合组分与性信息素协同引诱时,将植物挥发物诱芯与性诱芯一同用铁丝悬挂于桶型诱捕器上端口处,处理方法同单一挥发物的引诱试验。
1.3 数据统计与分析
触角电位相对值=(待测样品的反应值-对照反应值)/(参比反应值-对照反应值)。
运用SPSS 19.0统计软件对数据进行统计分析。不同性别的黏虫对同一植物挥发物触角电位差异显著性用配对样本t检验,显著水平为P <005。同一性别黏虫对不同处理差异显著性采用LSD多重比较法,显著水平为P < 0.05。
2 结果与分析
2.1 黏虫雌、雄蛾对5种植物挥发物的触角电位
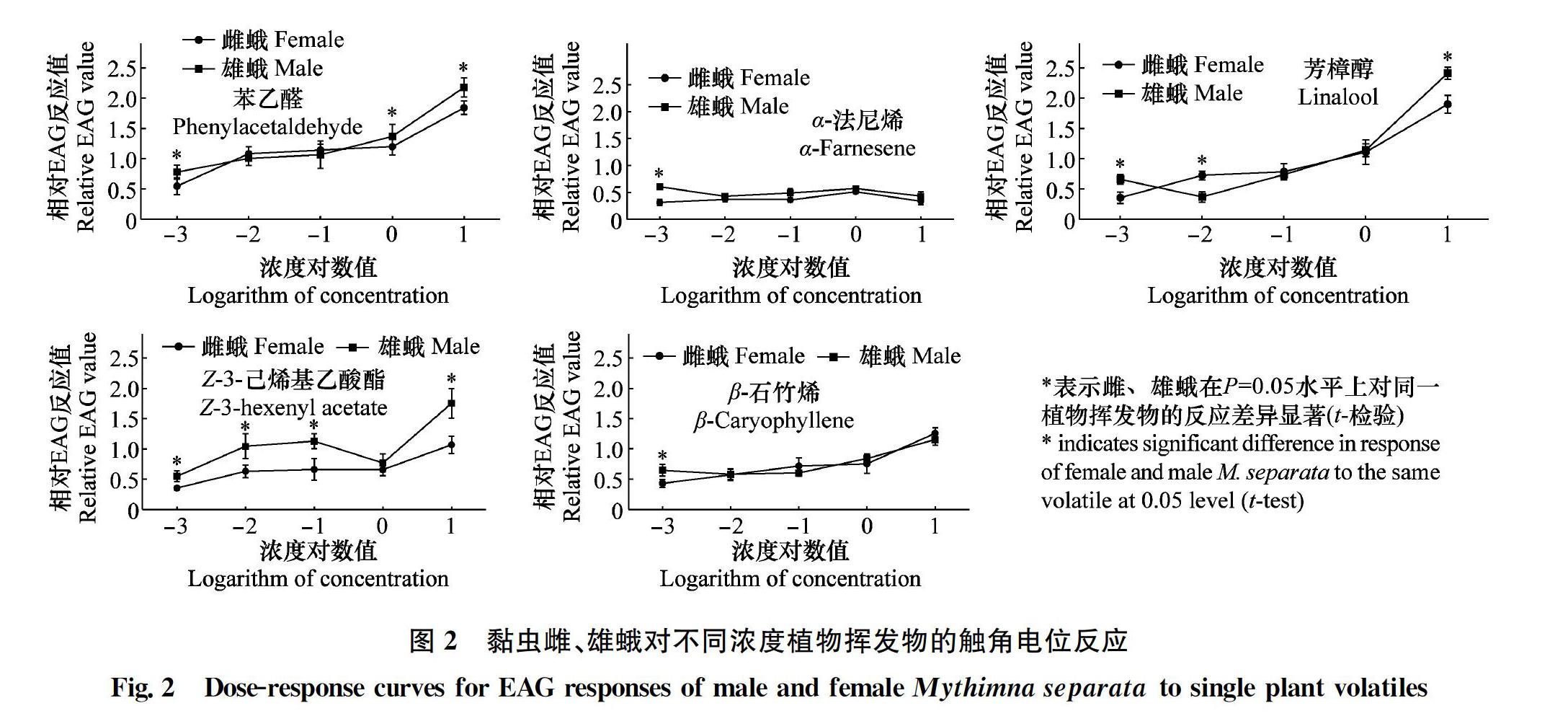
图1表明,同一剂量(100 μg)下黏虫雄蛾对芳樟醇挥发物的EAG相对值最高(2.41),其次为苯乙醛、Z 3 己烯基乙酸酯、β 石竹烯(分别为:2.18、175、1.15),对α 法尼烯的反应最小;与雄性相比,雌性则对芳樟醇、苯乙醛的反应处于同一较高水平(分别为:1.90、1.84),但对β 石竹烯、Z 3 己烯基乙酸酯、α 法尼烯的反应较低(分别为:1.28、106、0.33)。t 检验比较结果显示,雄性与雌性对苯乙醛、芳樟醇、Z 3 己烯基乙酸酯的EAG反应有显著性差异(P<0.05),而且均是雄性大于雌性。而对β 石竹烯和α 法尼烯的EAG反应值不同性别无显著性差异(P >0.05)。
对5种植物挥发物浓度梯度EAG结果表明,除α 法尼烯外,黏虫雌、雄蛾对植物气味化合物的触角电位值均随浓度的升高而升高。植物挥发物在低浓度水平(0.01 μg)时,黏虫对其反应均较弱,但雄蛾反应值均显著高于雌蛾(P<0.05),当浓度逐渐升高时,苯乙醛、Z 3 己烯基乙酸酯、芳樟醇有较强的电生理反应,β 石竹烯反应次之,而黏虫对α 法尼烯的反应并没有随浓度升高而增大(图2)。
2.2 黏虫雄蛾对不同植物挥发物的风洞行为反应
风洞行为反应试验结果表明(图3),与正己烷对照相比,5种单一化合物中,雄蛾对苯乙醛、Z 3 己烯基乙酸酯、β 石竹烯均表现出来逆风飞行行为(逆风飞行比例分别为:50.6%、50.3%、44.9%),其反应强度苯乙醛与Z 3 己烯基乙酸酯相当,其次为β 石竹烯,芳樟醇(35.8%)与对照(38.6%)相比逆风飞行比例有所下降(处理1~5,图3)。
植物挥发物的组合配比(处理6~11,图3)中。β 石竹烯与Z 3 己烯基乙酸酯的二元组合中试虫完成定向飞行的比例(41.7%)低于其他多元组合。雄蛾对三元组合物苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯完成逆风飞行的比例达到了55.7%,显著高于其他组合(P<0.05),而5种植物挥发物等比例混合并没有提高定向飞行比例(46.2%)。当性诱剂同时加入三元组合物苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯三种物质时,逆风飞行比例达到了71.6%,显著高于其对性诱剂的逆风飞行比例(63.6%)(处理12~13,图3)。
2.3 单一植物挥发物的引诱效果
从表2可以看出,供试几种植物挥发物对黏虫的引诱效果不明显。比较而言,苯乙醛、β 石竹烯和Z 3 己烯基乙酸酯的诱蛾效果优于芳樟醇、α 法尼烯。
2.4 植物挥发物混合物与性信息素的协同引诱效果
表3结果表明,苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯对性信息素均具有一定增效作用,其中苯乙醛的增效作用最明显,是单一使用性诱剂的1.5倍;当性诱剂同时加入苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯3种物质时,对黏虫雄蛾的月诱捕量是单一使用性诱剂的1.8倍,其引诱活性增强了70%,差异达到显著水平(P<0.05)。除此之外,对雌蛾也有微弱的引诱效果。
3 结论与讨论
本试验EAG结果表明,除α 法尼烯外,黏虫雌、雄蛾对植物气味化合物的触角电位均随浓度的升高而升高,且雌、雄蛾对苯乙醛、芳樟醇、Z 3 己烯基乙酸酯等的反应有显著差异(P <0.05),即黏虫对同一植物挥发物的EAG反应存在性别差异。此外,雄蛾在风洞中对苯乙醛、Z 3 己烯基乙酸酯、β 石竹烯表现出定向飞行行为,但田间试验结果表明,单一挥发物引诱效果较差,每种挥发物诱芯月诱捕量不足10头,与室内试验存在一定差异,可能是由于诱芯受外界温湿度、背景气味等综合因素的影响所造成的。植物挥发物与性信息素的协同试验表明:苯乙醛、异戊醇、β 石竹烯、Z 3 己烯基乙酸酯能提升性信息素的引诱效果,尤其将苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯混合物与性诱芯同时使用时,引诱作用显著高于仅用性诱芯效果(P<0.05),说明特定配比的植物挥发物对性诱剂具有增效作用。
植物气味在昆虫寄主定向、取食、交配产卵中起着重要的作用[3031],寄主与非寄主植物对昆虫产生吸引或驱避,不仅仅是由于个别单一植物揮发物起作用,而是多种植物挥发物以一定的比例形成其特定化学指纹图谱来吸引或驱避昆虫[3233]。单一化合物在田间引诱小地老虎Agrotis ipsilon和小菜蛾P.xylostella的效果较差[20,34]。与之类似,本试验单一植物气味引诱黏虫的效果差,月诱蛾量不足10头。前人开展类似试验也表明仅植物挥发物的单一组分和混合配方对黏虫的诱集效果不理想[22]。
植物源挥发物和昆虫信息素均是昆虫的重要信息物质,二者协同作用以调节昆虫的行为。将E β 金合欢烯,芳樟醇等加入到苹果蠹蛾C.pomonella的主要信息素物质中其引诱作用也明显增强[26];Z 3 己烯基乙酸酯与性信息素在田间对小菜蛾P.xylostella雄蛾的诱捕中具有协同效应[20]。与前人研究类似,本研究将苯乙醛、β 石竹烯、Z 3 己烯基乙酸酯混合物与性诱芯同时使用时,引诱作用显著高于仅用性诱芯的效果(P<0.05)。杨巧等报道的几种植物气味化合物与性信息素对黏虫的引诱效果不理想[35],其可能的原因有:1)所用性诱剂缺少微量活性组分;2)植物气味化合物直接加入到性诱剂橡皮载体上影响了其功效的发挥;3)植物气味化合物的配比、剂量及气候因子的影响等。
王振华等认为植物挥发物之所以起到增强性信息素的效果,是因为昆虫体内的章鱼胺(octopamine,OA)及其受体介导特异性植物源挥发物与OA受体结合,降低性信息素接收神经元对性信息素的反应阈值,增强了性信息素接收神经元敏感性[36]。对美洲棉铃虫H.zea和家蚕Bombyx mori特异性信息素接收神经元的研究均表明OA或植物挥发物对昆虫性信息素接收神经元敏感性调节因昆虫种、性别和神经元而异[3738]。黏虫性诱剂中增加植物挥发物后引诱效果增强,其机理是否与美洲棉铃虫和家蚕感受气味的机理类似还需要进一步探究。
本试验对植物挥发物及其与性诱剂联合使用对黏虫的引诱作用进行了初步探究,所设比例及剂量相对单一,而自然环境中各种挥发物以何种成分及浓度组成特定的化学指纹图谱、黏虫对植物挥发物的感受机制以及研制更加高效的植物源+性信息素引诱剂还需要进一步的探究与发现。
参考文献
[1] 李光博,王恒祥,胡文绣.粘虫季节性迁飞为害假说及标记回收试验[J].植物保护学报,1964,3(2):101110.
[2] 张云慧,张智,姜玉英,等.2012年三代黏虫大发生原因初步分析[J].植物保护,2012,38(5):18.
[3] 姜玉英,李春广,曾娟,等.我国粘虫发生概况:60年回顾[J].应用昆虫学报,2014,51(4):890898.
[4] 江幸福,张蕾,程云霞,等.我国粘虫发生危害新特点及趋势分析[J].应用昆虫学报,2014,51(6):14441449.
[5] 周靖华,于志浩,武建宽,等.陕西关中地区秋季黏虫发生新动态和影响因素分析[J].中国植保导刊,2017,37(6):3640.
[6] 李永川.云南省农业害虫性诱剂监控技术的应用[J].云南农业,2014(1):2223.
[7] 刘媛,杨旭峰,吴惠玲,等.宁夏小地老虎标准化性诱监测器诱测效果试验[J].宁夏农林科技,2016,57(4):3334.
[8] 屈振刚,盛世蒙,王红托,等.梨小食心虫性诱剂2类诱芯的桃园田间诱蛾效果比较[J].河北农业科学,2010,14(2):3031.
[9] 张振铎,李国忠,李耀光,等.玉米螟性诱剂田间诱捕效果初报[J].吉林农业科学,2010,35(2):3032.
[10]仇保華,刘宗泉,李艳红,等.几种性诱剂,性诱器诱捕棉铃虫成虫效果初探[J].中国棉花,2011,38(6):2628.
[11]汪新文,刘孟英.利用超微量技术分析粘虫单腺体性信息素的化学组成[J].昆虫学报,1997,40(2):158165.
[12]汪新文,刘孟英,吴才宏.粘虫雄蛾触角对其性信息素的电生理反应[J].昆虫学报,1998,41(1):17.
[13]魏志洪, 潘法明. 粘虫Mythimna separata Walker性引诱剂研究初报[J]. 昆虫学报, 1985 (3): 348350.
[14]刘孟英,潘恒,伍德明,等.合成性诱剂对粘虫雄蛾的引诱活性[J].生物防治通报,1985(2):15.
[15]宋亚茹,张蕾,程云霞,等.粘虫雌蛾性信息素特征成分鉴定及其不同配比的室内引诱效果[J].植物保护学报,2017,44(3):393399.
[16]刘莉,卫雅斌,张小龙,等.性诱剂在河北省玉米主要害虫测报上的应用研究[J].河北农业科学,2018,22(1):5458.
[17]莫圣书,赵冬香,陈青.植物挥发物与昆虫行为关系研究进展[J].热带农业科学,2006,26(6):8489.
[18]YANG Zhihua, BENGTSSON M, WITZGALL P. Host plant volatiles synergize response to sex pheromone in codling moth, Cydia pomonella [J]. Journal of Chemical Ecology, 2004, 30(3): 619629.
[19]DENG Jianyu, WEI Hongyi, HUANG Yongping, et al. Enhancement of attraction to sex pheromones of Spodoptera exigua by volatile compounds produced by host plants [J]. Journal of Chemical Ecology, 2004, 30(10): 20372045.
[20]DAI Jianqing, DENG Jianyu, DU Jiawei. Development of bisexual attractants for diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae) based on sex pheromone and host volatiles [J]. Applied Entomology and Zoology, 2008, 43(4): 631638.
[21]沈幼莲,高扬,杜永均. 植物气味化合物与斜纹夜蛾性信息素的协同作用[J]. 昆虫学报, 2009, 52(12): 12901297.
[22]WANG Gaoping, ZHANG Qingwen, YE Zhihua, et al. The role of nectar plants in the severe outbreaks of armyworm Mythimna separate (Lepidoptera: Noctuidae) in China [J]. Bulletin of Entomological Research, 2006, 96(5): 445455.
[23]李黄开媚. 三种植物挥发物组分鉴定及对粘虫的引诱作用研究[D]. 武汉: 华中农业大学, 2017.
[24]VON ARX M, SCHMIDT BSSER D, GUERIN P M.Plant volatiles enhance behavioral responses of grapevine moth males, Lobesia botrana to sex pheromone[J]. Journal of Chemical Ecology, 2012, 38(2): 222225.
[25]MINOLI S, KAUER I, COLSON V, et al. Brief exposure to sensory cues elicits stimulus nonspecific general sensitization in an insect [J/OL]. PLoS ONE, 2012, 7(3): e34141.
[26]SCHMERA D, GUERIN P M.Plant volatile compounds shorten reaction time and enhance attraction of the codling moth (Cydia pomonella) to codlemone [J]. Pest Management Science, 2012, 68(3): 454461.
[27]杜家纬.昆虫信息素及其应用[M].北京:中国林业出版社,1988.
[28]向玉勇,杨茂发,施祖华,等.小地老虎雄蛾对性信息素的行为反应[J].植物保护学报,2009,36(3):207212.
[29]杨美红,刘红霞,刘金龙,等.榆木蠹蛾雄蛾对性信息素不同组分及其不同比例和剂量混合物的风洞行为反应[J].昆虫学报,2015,58(1):3844.
[30]杜永均,严福顺.植物挥发性次生物质在植食性昆虫、寄生植物和昆虫天敌关系中的作用机理[J].昆虫学报,1994(2):233250.
[31]RINDER J, CASAZZA A P, HOEFGEN R, et al. Regulation of aspartate derived amino acid homeostasis in potato plants (Solanum tuberosum L.) by expression of E.coli homoserine kinase [J]. Amino Acids, 2008, 34(2): 213222.
[32]楊真,张宏瑞,李正跃.植物挥发物对蛾类昆虫行为影响的研究进展[J].南方农业学报,2015,46(3):441446.
[33]张文璐,王文强,白树雄,等.亚洲玉米螟雌蛾产卵偏好寄主植物的筛选及对葎草挥发性化学成分的电生理反应[J].昆虫学报,2018,61(2):224231.
[34]李石力.烟草挥发物与性信息素引诱小地老虎的协同增效作用研究[D].重庆:西南大学,2013.
[35]杨巧,郭培,王高平.植物源气味化合物与黏虫蛾性信息素的协同作用[J].安徽农业科学,2015,43(16):8284.
[36]王振华,赵晖,李金甫,等.植物源挥发物对昆虫信息素的增效作用及其增效机制[J].应用生态学报,2008,19(11):25332537.
[37]POPHOF B. Octopamine modulates the sensitivity of silk moth pheromone receptor neurons [J]. Journal of Comparative Physiology A, 2000, 186(3): 307313.
[38]OCHIENG S, PARK K, BAKER T. Host plant volatiles synergize responses of sex pheromone specific olfactory receptor neurons in male Helicoverpa zea [J]. Journal of Comparative Physiology A, 2002, 188(4): 325333.
(责任编辑:田 喆)

