含油污泥中芘降解菌的筛选及代谢活性研究
陈丽 任宏洋 文天祥 段欣欣 雷杰霞 李佳颖


摘要:以多环芳烃芘为唯一碳源对含油污泥中微生物进行富集,筛选出高效降解芘的菌株。菌株形态为杆状,其菌落形态呈现圆球状,生理生化鉴定结果表明为分支杆菌属。代谢活性研究表明,菌株在芘浓度为150mg/L、温度30℃、转速150r/min培养7d后,对芘的降解率可达到39.2%左右,OD600生长曲线表明该菌株在16h后进入对数生长期,其稳定期时间大约持续40h,其呼吸速率曲线趋势与生长曲线具有一致性,菌株代谢过程导致培养液pH有所升高。
关键词:芘降解菌;菌株筛选;菌株鉴定;抗酸染色
中图分类号:X131 文献标识码:A 文章编号:2095-672X(2019)11-00-02
Abstract:Using pahs pyrene as the only carbon source, the microorganisms in the oily sludge were enriched and the strains were screened to degrade pyrene effectively.The shape of the strain was rod, and its colony shape was round ball.Metabolic activity of the research shows that the strain in pyrene concentration of 150mg/L, temperature 30℃, the speed of 150r/min training after 7 d, degradation rate can reach about 39.2% of pyrene, OD600 growth curve showed that the strain after 16h into the logarithmic phase, the stabilization time lasts about 40h, the respiratory rate curve trend consistent with growth curve, strain metabolic processes leading to culture medium pH was increased.
Key words:Pyrene degrading bacteria;Strain screening;Identification of bacterial strains;This acid fast stain
多环芳烃(Polycyclic aromatic hydrocarbons ,PAHs)是具有2个及以上苯环组成的芳香烃化合物,具有强烈的致癌、致畸和致突变效应[1][2]。PAHs随着苯环数的增加毒性增强[3],目前已经被联合国列为持久性有机污染物[4]。芘含有四个苯环,在污染环境中易富集、含量高,与低分子量PAHs相比更不易有效去除[5],是多环芳烃的代表物,也是监测PAHs污染的标志物[6]。
微生物降解技术作为一种经济有效的方法,是当前PAHs降解的研究热点[7]。常见的多环芳烃降解菌有鞘氨醇单胞属、分枝杆菌属、不动杆菌属、芽孢杆菌属、假单胞菌属、红球菌菌属和伯克氏菌属等[8],这些高效降解菌大多从被多环芳烃污染的土壤或沉积物中分离出来[9]。不同于细菌,真菌是通过分泌胞外酶来降解高毒性的多环芳烃,其中最常见的是白腐真菌[10]。目前低分子量多环芳烃的降解菌的研究受到广泛关注,但对于高环PAHs高效降解菌的研究就相对较少[3]。本研究以芘为唯一碳源和能源,从含油污泥中富集分离多环芳烃高效降解微生物,研究其代谢特性,为多环芳烃微生物修复技术应用提供基础数据。
1 材料与方法
1.1 材料
1.1.1 土壤样品
土壤采自四川某油田含油污泥暂存池中的土样,将表面大约5cm的土层去掉,用灭过菌的铁铲采集5-10cm的土样,装入无菌塑料袋中,密封后于4℃的低温条件下保存备用。
1.1.2 培养基
牛肉膏蛋白胨培养基:1.5g牛肉膏,2.5g蛋白胨,2.5gNaCl,1L蒸馏水,pH=7;
无机盐液体培养基:K2HPO4 4g,Na2HPO4 4g,(NH4)2SO4 2g,MgSO4·7H2O 0.2g,CaCl2 1mg,FeSO4·7H2O 1mg,蒸馏水1L,pH=7。
1.1.3 实验仪器
本研究所用的主要仪器设备包括:立式高压蒸汽灭菌锅(LDZF-30L,上海申安)、全温气浴微生物培养震荡床(QYC-200,上海褔玛)、超净工作台(SJ-CJ-2FD,苏州苏洁)、人工气候培养箱(RPX-350A,上海福玛)、高效液相色谱(LC-20A,日本岛津)、微生物降解呼吸仪(AER-208,美国CHALLENGE)、可见光分光光度计(723N,上海佑科)、双目显微镜(M150,麦克奥迪)。
1.2 实验方法
1.2.1 菌株的筛选与鉴定
菌株的富集培养:取5g含油污泥加入100mL蒸馏水,在震荡床振荡12h后静置取其上清液。在振荡速度为150r/min、恒温30℃的摇床中培养3~4d。
菌株的分析:从培养液中取出1mL菌液加入到含芘的无机盐培养液中,梯度驯化培养15d,进行平板划线,培养3~4d,待菌落长出置于4℃冰箱保存备用。将已纯化的菌种接种至含芘的牛肉膏蛋白胨固体培养基,30℃下培养一周,观察菌种生长范围定性选出最优菌种。
菌株生理生化特性研究:在光学显微镜下观察最优菌菌株形态,进行革兰氏染色、过氧化氢酶实验、淀粉水解实验、葡萄糖发酵实验、V-P试验、M-R试验、吲哚实验、反硝化等实验,利用苯酚品红染液对该菌進行抗酸染色,进一步验证菌株的特性。
1.2.2代谢活性
菌株生长速率及呼吸速率:在牛肉膏蛋白胨培养液中,每2h测定一次该菌的OD600,趋于稳定后每4~5h测定一次,当OD600值有明显下降时停止测定,并用呼吸速率仪测定呼吸速率。菌株降解性能测定:采用高效液相色谱(LC-20A,日本岛津)测定分离的微生物对于芘的降解效率,同时测定该菌在7d生长过程中pH变化。
2 结果与讨论
2.1 菌株的筛选与鉴定
取250mg/L芘浓度下培养的菌液于含芘无机盐培养基中培养3~4d后,分离纯化得到三种类型菌落,表观特征分别为为乳白色、橙黄色和橙红色菌落。根据三种菌株在含芘培养基上的生长情况,定性得出橙黄色菌株对芘的耐受性最好。通过显微观察,发现该菌株呈杆状,革兰氏染色为阳性、通过抗酸染色实验发现,该菌株抗酸染色呈阳性,该菌株生理化鉴定结果如表1所示。三种菌株皆属于好氧菌,过氧化氢酶、葡萄糖发酵、吲哚实验均表明三种菌株为阳性。
橙黄菌株形态为杆状,好氧菌,产色素。且相关资料表明,降解多环芳烃这类物质的杆菌主要为芽孢杆菌、苍白杆菌、分支杆菌。根据显微观察,并未发现该菌有芽孢出现,故排除芽孢杆菌的可能。苍白杆菌为革兰氏阴性菌,而该菌为革兰氏阳性,故排除苍白杆菌的可能。且实验结果显示,菌株抗酸染色呈阳性,再结合生理生化指标鉴定和革兰氏染色鉴定,综上所述,可初步鉴定出该菌株属于分枝杆菌属,命名为MYC-1。
2.2微生物在芘降解过程的生长代谢活性研究
2.2.1OD600和OUR
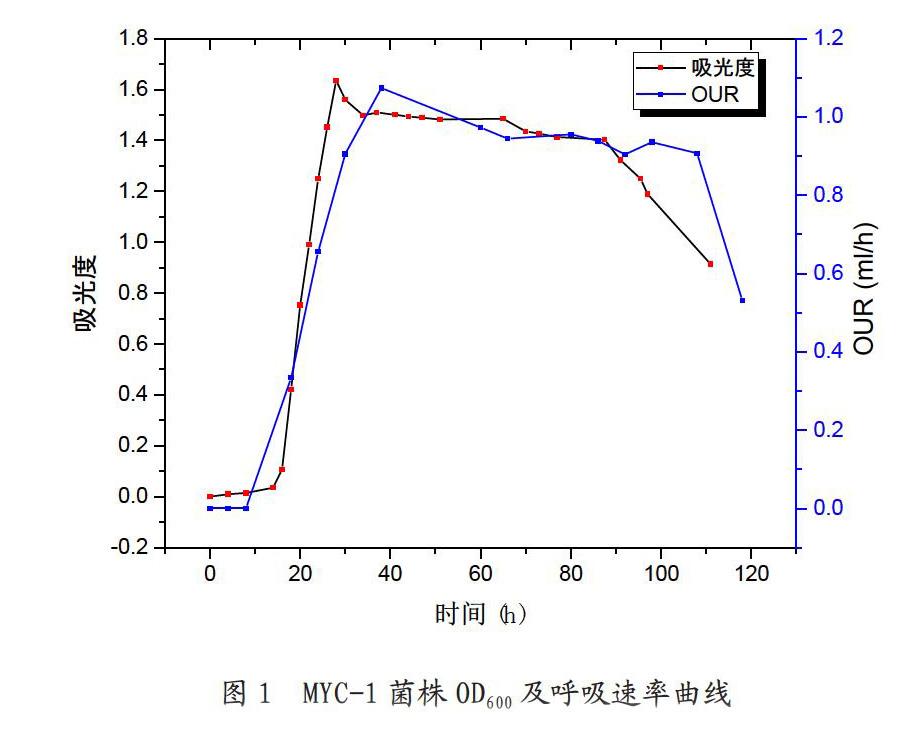
针对筛选出芘高效降解菌MYC-1菌株,测定其在以芘为唯一碳源的培养基中,采用OD600表征菌体的浓度,菌体的生长速率及好氧呼吸速率,如图1所示。
由图可知,在0~12h内,MYC-1菌株生长曲线较为平缓,此时为MYC-1菌株的适应期。在12~28h内OD600值迅速上升,此为MYC-1菌株的对数生长期,在此时间范围内MYC-1菌株数量增长速率最快,菌株浓度增长约97.86%。在28~50h内又趋于平缓,进入到稳定期,该时期持续时间相对较长,在22h左右。在50~70h内,OD600值逐渐下降,说明细菌活性开始减弱,此时MYC-1菌株进入衰亡期。同步测量培养过程中MYC-1菌株的呼吸速率,结果表明在0~40h氧消耗速率速率呈上升趋势,在40h时达到最大,接近1.1mL/h,40h后,氧消耗速率缓慢下降,但趋于稳定,大约在0.9~1.0mL/h区间内,持续到110h,呼吸速率急剧下降。因此可以得出在40h时MYC-1菌株的呼吸速率最大,活性最大,对比微生物浓度变化和氧消耗速率变化表明,微生物的生长速率和呼吸速率具有较好的一致性。
2.2.2 pH变化
MYC-1菌株代谢过程中,培养基中pH变化如图2所示。
由图2可知,最初培养基的pH为7左右,培养液的pH随着时间的增加不断升高,结果显示在MYC-1菌株的生长过程中产生的代谢产物呈碱性,培养152h后,pH达到8.92,与最开始相比pH升高2 左右。
2.2.3 多环芳烃芘降解率的测定
连续测定MYC-1菌株在7d内对芘的降解过程,如下图3所示:
结果显示,在芘浓度为150mg/L的条件下,MYC-1菌株在第1d和第2d降解率均为10%以下,从第3d开始降解率有比较大幅度的提升,在第5d达到34.41%后,降解率上升的趋势开始减缓,第7d,MYC-1菌株对芘的降解率达到39.20%左右。菌株生长初期需要适应含芘的条件,生长活性相对较低,对芘的降解效率为6.36mg/d;当菌株进入对数增长期,活性较高,对芘的降解达到16.28mg/d。当进入衰亡期后,活性降低,对芘的降解仅为3.6mg/d。田晶等人[3]发现的一株黄曲霉菌,在50mg/L条件下,3d内对芘的降解率为71%,降解速率为11.83mg/d,本研究筛选的MYC-1菌株,在较高的初始芘浓度条件下,降解速率相对较高,显示了MYC-1菌株具有较高的代谢活性和对于多环芳烃芘毒性的耐受能力。
3 結论
(1)从含油污泥中,经过富集分离纯化等操作,筛选得到一株对芘有一定降解性能的菌株,在芘浓度为150mg/L、温度30℃、转速150r/min培养7d后,对芘的降解率可达到39.2%。
(2)通过显微镜发现该菌株形态为杆状,其菌落形态呈圆球状,通过生理生化指标发现该菌为革兰氏阳性好氧菌;抗酸染色呈阳性,初步判别该菌株为分支杆菌属。
(3)该菌OD600生长曲线表明菌株在16h后进入对数生长期,其稳定期时间大约持续40h,呼吸速率曲线趋势与生长曲线具有一致性,且在菌株生长过程中培养液pH呈上升趋势。
参考文献
[1]马静. 多环芳烃降解菌的筛选、降解机理及降解性能研究[D].大连理工大学,2013.
[2]Wei Qin, Fuqiang Fan, Yi Zhu, et al. Anaerobic biodegradation of benzo(a)pyrene by a novel Cellulosimicrobium cellulans CWS2 isolated from polycyclic aromatic hydrocarbon-contaminated soil Brazilian Journal of Microbiology, 49(2018), pp. 258-268.
[3]田晶,徐小琳,康彦顺,汤伟华,刘思琪.广谱性多环芳烃降解真菌Aspergillus flavus AD-X-1的筛选及其性能研究[J].生物技术通报,2018,34(08):115-122.
[4] 赵金平.我国持久性有机污染物监测现状、存在问题及对策分析[J].环境与发展,2019,31(05):55-56.
[5]Ashis K , Mukherjee, Pabitra Bhagowati , et al. A comparative intracellular proteomic profiling of Pseudomonas aeruginosa strain ASP-53 grown on pyrene or glucose as sole source of carbon and identification of some key enzymes ofpyrene biodegradation pathway Journal of Proteomics,167(2017), pp. 25-35.
[6] 黄兴如,张彩文,张瑞杰,章俊,张晓霞.多环芳烃降解菌的筛选、鉴定及降解特性[J].微生物学通报,2016,43(05):965-973.
[7] 思显佩. 多环芳烃降解菌的生长特性及其在土壤修复中的应用[D].重庆工商大学,2011.
[8] 杨晓磊,陆贻通,曹林奎.多环芳烃荧蒽降解菌的筛选鉴定及降解特性研究[J].科技通报,2007(01):46-51.
[9] 吴枭雄,王红旗,刘自力.多环芳烃污染土壤的微生物修复技术研究进展[J].环境与发展,2018,30(07):108-109.
[10] 汤云春,尤朝阳,张淑娟,许学峰,徐海阳,张俐.白腐真菌芘降解特性及其与细菌的协同降解[J].环境科学与技术,2018,41(10):34-41.
收稿日期:2019-08-27
基金项目:四川省大学生创新创业训练计划项目(201910615022)
作者简介:陈丽(1996-),女,汉族,本科在读,研究方向为环境工程。

