正常脑组织和脑卒中组织的电阻抗频谱特性研究
杨 琳,代 萌,徐灿华,王 航,文治洪,史学涛,董秀珍*,付 峰*
(1.空军军医大学航空航天医学系,西安 710032;2.空军军医大学军事生物医学工程学系,西安 710032)
0 引言
脑卒中是一种严重的急性脑血管疾病,具有发病急和致死率高的特点,已成为我国首位疾病死因[1]。临床实践表明,早诊断、早治疗是改善脑卒中患者预后的关键(3~6 h为黄金救治期)[2]。现有脑卒中检查技术(MRI和CT)因设备体积庞大、价格昂贵等原因,无法用于院前临床紧急救治,致使大多数脑卒中患者无法得到及时的救治。因此,在临床一线救治中,迫切需要一种便携、造价低廉且适用于基层医疗单位等院前救治的脑卒中快速检测技术。多频电阻抗成像(electrical impedance tomography,EIT)是一种利用生物组织阻抗频谱特性进行成像的技术,其通过体表电极向人体施加多种频率电流,同时测量不同频率处的电压,然后采用一定的图像重构算法估计人体被测部位内部的阻抗分布,最后基于组织的阻抗频谱特异性区分组织类型,达到检测疾病的目的。由于脑卒中组织和正常脑组织的阻抗频谱存在明显差异,所以多频EIT有望实现脑卒中快速检测。此外,多频EIT还具有无创、无辐射、设备便携等优势,因此非常适合作为院前救治中快速检测脑卒中的技术。
准确的正常脑组织和脑卒中病变组织的阻抗频谱是开展多频EIT检测脑卒中研究的重要前提。到目前为止,已有研究小组开展了正常脑组织和脑卒中组织阻抗特性的研究。Surowiec等[3]测量了牛脑灰质和白质在20 kHz~100 MHz内阻抗频率特性;Gabriel等[4]在2 h内测量了绵羊脑灰质和白质在10 Hz~20 GHz的阻抗频谱特性;吴小明等[5]测量了家兔的缺血脑组织在1 Hz~1 MHz的阻抗谱;Dowrick等[6]测量了放置于4℃环境自发凝血的凝血块的阻抗特性。但是,以上研究未同时测量正常脑组织和脑卒中组织的阻抗频谱特性,导致无法系统地对比组织的阻抗频谱。
针对上述问题,本文首先采用自体血注入法和光化学诱导法分别建立家兔脑出血模型和脑缺血模型;其次,分别测量离体15 min内的脑白质、灰质、脑出血组织和脑缺血组织在10 Hz~1 MHz内的阻抗频谱;最后,系统性对比分析正常脑组织和脑卒中组织的阻抗频谱。
1 方法
1.1 动物的麻醉与固定
以42只新西兰大白兔为实验对象,年龄:2个月,体质量:(2±0.5)kg。在实验开始前 2 h 禁水,4 h 禁食。开始麻醉阶段,使用1.5%的戊巴比妥钠(2 ml/kg)腹腔麻醉。待兔子镇静后,通过耳缘注射3%的戊巴比妥钠(0.5 ml/kg)进行深度麻醉。在术中,1.5%的戊巴比妥钠以1 ml/(kg·h)的速率进行腹腔注射,以维持兔子的麻醉状态。兔子被固定在立体定位器上,使用眼睛和耳朵固定闩以俯卧体位固定。42只兔子被分为2组,颅内出血模型和缺血模型各21只。本研究中的所有动物实验方案均受到空军军医大学动物管理和使用委员会的支持。
1.2 家兔脑卒中模型的建立
1.2.1 颅内出血模型的建立
本文采用自体血注入方式制作脑实质出血模型[7]。将兔子固定于立体定位仪,在矢状缝左侧5 mm与冠状缝后5 mm处用牙科钻钻孔,深度以恰好碰到硬脑膜为宜,孔的直径为1 mm,为注射血液做准备,如图1(a)所示。采用心脏取血方式采血,向1 ml注射器内注入0.5 ml的血液,将1 ml注射器固定于立体定位仪上;针头顺孔进入颅内,根据解剖结构选择进针深度为11 mm,确保注血位置位于脑实质;缓慢注血,注射时间为30 s;注血完成后5 min拔针,用骨蜡密封针孔,并缝合伤口。40 min后,采用过剂量麻醉方式将兔子处死,取脑,1只置于福尔马林溶液,20只进行组织阻抗频谱测量,测量组织包括出血组织(血凝块)和脑白质(位于注血位置对侧)。
1.2.2 脑缺血模型的建立
本文采用光化学诱导法制作脑缺血模型[8]。在矢状缝左侧6 mm与冠状缝后5 mm处,采用牙科钻逐层钻透颅骨的外板层和板状层,暴露内板层,并将内板层打磨平整,形成不完全穿透颅骨的直径5 mm圆形骨洞,电凝止血,将视野清理干净,如图1(b)所示。由耳缘静脉按1.5 ml/kg的剂量缓慢注射3.5%Rose Bental(Sigma corporation)溶液。观察兔眼颜色,出现玫瑰红颜色改变后(通常为注药后15 min)启动冷光源,使单绿色光(波长540 nm,强度600 mW/cm2)通过光导纤维,光导纤维探头接近骨洞洞口,垂直照射30 min,然后缝合伤口。待40 min后,采用过量麻醉方式处死兔子,取脑,1只置于福尔马林溶液,20只进行组织阻抗频谱测量,测量组织包括缺血组织和脑灰质组织(位于缺血组织对侧,光化学法制作的缺血组织主要为脑灰质)。

图1 2种脑卒中模型制作
1.3 组织阻抗谱测量与分析
1.3.1 组织阻抗频谱测量
在取脑后,分离兔脑灰质、白质和脑卒中组织(出血组织或者缺血组织),2名实验人员同时装填正常脑组织和脑卒中组织于2个测量盒,以减少离体时间的影响,测量盒如图2所示。测量盒有一个圆柱状空腔,空腔直径为5 mm,长度为15 mm。测量盒共有4个电极(均为银电极),2个电极位于测量盒的两个末端(激励电极),呈圆盘状,电极直径为10 mm,厚度为0.5mm;另外2个电极位于测量盒的内壁上(测量电极),呈环形分布,2个电极之间的距离为8 mm,如图2所示。在本文中,我们采用四电极法进行测量以消除电极和接触阻抗的影响[9]。

图2 阻抗测量盒(单位:mm)
采用本研究小组建立的阻抗测量平台开展阻抗测量[10]。当组织装填完成后,将测量盒连接于Solartron 1260阻抗分析仪(Schlumberger,UK)。本文使用带有接口1294A的阻抗分析仪Solartron 1260进行阻抗测量,通过软件Zplot来控制采集参数和数据采集。采用0.2 mA ACRMS电流,通过2个激励电极进行扫频,测量频率范围为10 Hz~1 MHz,共51个频点;采用2个测量电极测量电压并计算2个测量电极之间的阻抗。为了控制测量条件,使用婴儿培养箱(戴维,宁波)保持测量温度维持在(37±0.3)℃,相对湿度维持在60%。在本研究的每一个实验中,当一种组织测量完毕后,立即更换测量盒,测量下一种组织,保证所有组织测量均在动物死亡后15 min内完成。
1.3.2 组织阻抗谱特性
使用Solartron 1260/1294测量方案可获得阻抗Z=Zreal+jZimag。根据测量原理,组织的电导率(δ)和介电常数(ε)的计算公式[11-12]如下:

其中,S为测量盒的横截面积,l为2个测量电极之间的距离,ω为角频率。
因此,阻抗的实部和虚部可以被改写为与测量盒尺寸、电导率和介电常数有关的形式:

为了直观地比较不同组织之间的阻抗特性,由公式(3)、(4)可以看出,如果令测量盒的横截面积S=1 cm2,2个测量电极之间的距离l=1 cm,则可得到标准化后的阻抗实部和虚部。
在本文中,我们使用导纳率 γ(等于 δ+jωε)、Zreal和Zimag表示组织的阻抗频谱特性。
1.4 组织学检查
为了评估脑卒中病灶的组织病理性变化,处死动物后,从2种脑卒中模型的兔脑中分别挑选正常脑白质、脑灰质、出血组织以及缺血组织(直径为1 cm)置于10%的福尔马林溶液中24 h。然后,每种组织样本被切为3 mm厚的薄片进行HE染色。
1.5 数据分析
采用 SPSS 20.0(IBM Software,Armonk,NY,USA)进行统计学分析,采用t检验比较不同频率处阻抗的差异,P<0.05被认为有显著差异。
为了达到利用多频EIT检测脑卒中的目的,首先,需要从正常组织中鉴别出脑卒中病灶,为此,我们对比分析正常脑组织和脑卒中组织的阻抗在所有频率处的差异,具体计算公式如下:

其中,Δδ和Δ(ωε)分别表示脑卒中组织与正常脑组织的电导率和导纳率虚部差异;δstroketissue和δnormaltissue分别表示脑卒中组织和正常脑组织的电导率;(ωε)stroketissue和(ωε)normaltissue分别表示脑卒中组织和正常脑组织的导纳率虚部。
其次,在脑卒中发病早期,不但要从正常脑组织中检测出脑卒中,而且,需要鉴别脑卒中类型。不同类型脑卒中组织的阻抗随频率的变化特性可能是区分脑卒中类型的依据。为此,将测量频段划分为低频段(10 Hz~1 kHz)、中频段(1~100 kHz)和高频段(100 kHz~1 MHz)3个子频段,然后分别研究缺血组织和出血组织的阻抗在3个频段内的频差变化特点,在3个子频段内,分别以10 Hz、1 kHz和100 kHz为参考频率。具体计算公式如下:

其中,Δδf和 Δ(ωε)f分别表示脑卒中组织的电导率和导纳率虚部在各子频段内的变化和分别表示脑卒中组织的电导率和导纳率虚部分别表示脑卒中组织在参考频率处的电导率和导纳率虚部;fref为参考频率。
2 结果
2.1 脑卒中模型验证
在所有实验过程中,动物保持正常的体温和呼吸等生命体征。实验中建立的脑出血模型如图3(a)所示。图3(b)为出血组织及其周围脑白质,从图中可以看出,血液和脑白质之间边界清晰,并且出血组织中充满大量的红细胞,如图3(c)所示。实验中建立的脑缺血模型如图4(a)所示,从图中可以看出,缺血组织与正常组织之间的边界清晰,并且缺血组织的细胞体积明显大于正常脑灰质,如图4(c)、(d)所示。以上结果表明,本文成功建立了脑出血模型和脑缺血模型。

图3 脑出血模型和病理图
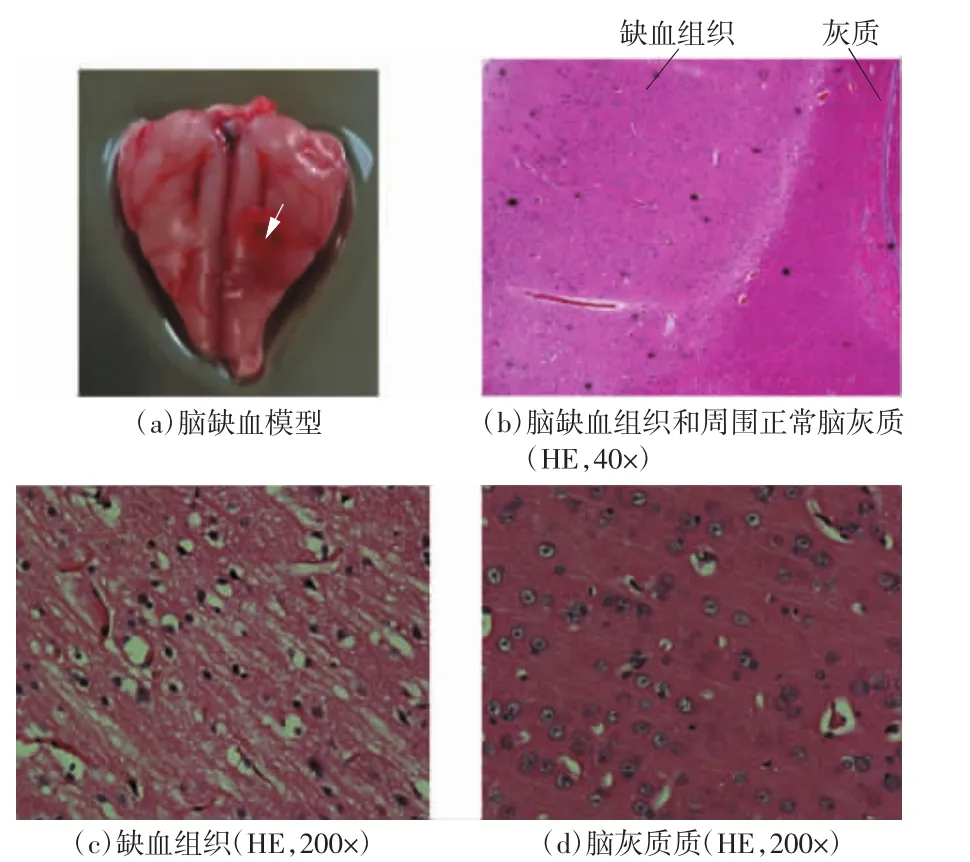
图4 脑缺血模型和病理图
2.2 正常脑组织与卒中组织的阻抗频谱
图5为正常脑组织和卒中组织的电导率和导纳率虚部。从图5中可以看出,白质、灰质以及缺血组织的电导率在整个频段内均随频率升高而增大;出血组织的电导率在10 Hz~100 kHz之间基本保持不变,但电导率在100 kHz~1 MHz之间随频率升高而增大。4种组织的导纳率虚部随频率变化特性与电导率变化相同,特别是出血组织的导纳率虚部在100 kHz~1 MHz之间随频率升高增加最为明显(100 kHz和1 MHz处的导纳率虚部具有明显差异,P<0.05)。在整个频段内,出血组织的电导率均小于其他3种组织的电导率,而缺血组织的电导率介于脑白质和脑灰质之间。

图5 正常脑组织和卒中组织的阻抗频谱
2.3 正常脑组织与卒中组织的阻抗频谱差异
图6为正常脑组织和卒中组织的阻抗频谱。从图6中可以看出,缺血组织与白质和灰质的电导率差异在整个频段内随频率缓慢变化,基本保持在0.2倍。而出血组织与正常脑组织的电导率具有较大差异,特别是在高频段(>100 kHz)差异最为明显:与灰质相比差异可达0.6倍,与白质相比差异可达0.3倍。
缺血组织与白质和灰质的导纳率虚部差异在整个频段内变化缓慢;而出血组织与正常组织的差异在整个频段内均较大,尤其在大于100 kHz范围内,差异可达2倍以上。

图6 正常脑组织和卒中组织的阻抗频谱差异
2.4 2种脑卒中组织的阻抗频差变化特性
图 7(a)表明,在低频段(10 Hz~1 kHz)和中频段(1~100 kHz),缺血组织的电导率呈线性增加(在低频段内,缺血组织的电导率增加了约10%;在中频段内,缺血组织的电导率增加可达20%)。但在这2个频段内,出血组织的电导率基本保持不变。在高频段(100 kHz~1 MHz)内,2种卒中组织的电导率都随频率升高而增加,但出血组织增加幅度明显大于缺血组织。因此,在低频段和中频段,2种卒中组织的电导率随频率变化具有较大差异。
图7(b)显示,在低频段,缺血组织的导纳率虚部的变化幅度大于出血组织,达10倍以上;而在中频段和高频段,出血组织的变化幅度大于缺血组织。说明在整个频段内,2种卒中的导纳率虚部随频率变化都存在明显差异。
3 讨论和总结
从脑卒中组织和正常脑组织阻抗频谱对比结果发现,缺血脑组织和脑白质的电导率差异随频率升高而缓慢上升,差异最大约为20%;而且2种组织的导纳率虚部差异在100 Hz~1 MHz范围内具有最大值,可达到50%。缺血脑组织与脑灰质相比,电导率差异基本维持在20%,而导纳率虚部差异较小。因此,为了区分正常组织和脑缺血组织,可能需要利用整个频段内的数据。此外,脑出血组织与正常脑组织无论是电导率还是导纳率虚部均在高频段(>100 kHz处)存在最大变化,例如,出血组织和灰质的电导率差异为50%,导纳率虚部差异可达3倍,所以在利用多频EIT检测脑卒中时,为了区分脑出血组织和正常脑组织,应着重关注高频段信息(>100 kHz处),即高频段是鉴别脑卒中组织和正常脑组织的最优频率段。

图7 2种脑卒中组织的阻抗频差变化特性
从脑缺血组织和脑出血组织阻抗频谱对比结果发现,在低频段,脑缺血组织的电导率和导纳率虚部相对变化(约7%)明显大于出血组织(小于1%);而脑出血组织的导纳率虚部在中频段和高频段变化分别为16倍和4倍,明显大于脑缺血组织(小于2倍)。因此,在利用多频EIT检测脑卒中时,为了区分脑出血组织和脑缺血组织,应着重关注低频段(10 Hz~1 kHz)和中频段(1~100 kHz)信息,即低频段(10 Hz~1 kHz)和中频段(1~100 kHz)是鉴别脑出血组织和脑缺血组织的最优频率段。
综上所述,本文首先建立了家兔脑出血和脑缺血模型,然后全面测量了正常脑组织和脑卒中组织在10Hz~1MHz内的阻抗频谱,并对比分析了正常脑组织和脑卒中组织的阻抗频谱,为未来开展多频EIT检测脑卒中研究奠定了良好的数据基础。

