当阳地区鲊广椒中乳酸菌的分离鉴定及其应用
李 娜,王玉荣,葛东颖,代凯文,张振东,郭 壮*
鲊广椒以大米粉和辣椒为主要原料,同时辅以食盐、白胡椒和花椒等调味料,通过密封发酵制作而成[1],因口感酸辣而深受湖北及云南、贵州、四川和重庆等我国西南地区人们的喜爱[2]。由于鲊广椒制作环境较为开放,且多以农户手工制作为主,因而其具有较高的微生物多样性[3]。王玉荣等[4-5]采用MiSeq高通量测序技术对当阳地区鲊广椒微生物多样性进行了解析,结果发现其优势真菌属为念珠菌属(Candida)、分枝孢子菌属(Cladosporium)、曲霉菌属(Eurotium)等,且真菌含量过高不利于鲊广椒滋味品质的形成;当阳地区鲊广椒中细菌主要为乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)、葡萄球菌(Staphylococcus)、肉胞菌属(Carnimonas),肠杆菌属(Enterobacter)和普氏菌属(Prevotella),其中乳酸菌的相对含量高达81.75%,且Lactobacillus对鲊广椒风味的形成具有积极的作用。由此可见,从鲊广椒中进行乳酸菌分离鉴定,同时使用分离株强化发酵制备鲊广椒对鲊广椒中致病菌或腐败菌的抑制及品质的提升可能具有积极的意义[6]。
通过仿生技术(电子鼻和电子舌)已经实现了传统发酵食品风味[7]和滋味[8]的数字化评价,且电子鼻和电子舌相结合在苹果汁[9]、红酒[10]、绿茶[11]和牛奶[12]的品质评价中有了广泛的应用。
本研究从湖北省当阳地区采集了5份鲊广椒样品,采用传统培养分离方法和分子生物学技术对其中蕴含的乳酸菌菌株进行了分离鉴定,并采用分离株强化发酵制备鲊广椒,采用电子鼻和电子舌对其风味和滋味品质进行评价,同时通过主成分分析(principal component analysis,PCA)对具有优良发酵特性的乳酸菌菌株进行了初步筛选,为湖北省鲊广椒细菌多样性的解析提供数据支撑,同时为后续具有优良发酵特性鲊广椒菌株的筛选提供菌株支持。
1 材料与方法
1.1 材料与试剂
MRS固体培养基:青岛海博生物技术有限公司。
细菌基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)小量制备试剂盒、DNA凝胶回收试剂盒、DNA Marker:康宁生命科学吴江有限公司;引物27F/1495R:武汉天一辉远生物科技有限公司;蛋白酶K(20 U/μg)、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)、DNA聚合酶(5 U/μL)、2×聚合酶链式反应(polymerase chain reaction,PCR)mix、10×PCR buffer、pMD18-T克隆载体:大连宝生物工程有限公司;大米粉、二荆条辣椒、花椒粉、胡椒粉、食盐(均为食品级):襄阳市鑫源超市;甘油、磷酸二氢钾、氢氧化钠、盐酸、磷酸、氯化钠、吐温-80、草酸、琥珀酸、酒石酸、柠檬酸、苹果酸、乳酸、乙酸(均为分析纯):上海国药集团化学试剂有限公司;参比溶液、内部溶液和外部溶液:日本INSENT公司。
1.2 仪器与设备
HR40-ⅡB2型生物安全柜:青岛海尔股份有限公司;QYC-2102C全温培养摇床:上海新苗医疗器械制造有限公司;DG250厌氧工作站:英国Don Whitley公司;SA402B味觉分析系统:日本INSENT公司;LC-20ADXR高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;VeritiTM96孔梯度PCR扩增仪:美国AB公司;Fluor Chem FC3化学发光凝胶成像系统:美国ProteinSimple公司;XFS-280手提式压力蒸汽灭菌锅:上虞市华宏净化设备厂;ND-2000C微量紫外分光光度计:美国Nano Drop公司;DYY-12水平电泳仪:北京市六一仪器厂;PEN3型电子鼻:德国Airsense公司。
1.3 方法
1.3.1 样品的采集
于2017年11月,从湖北省当阳市草埠湖镇农户家中采集鲊广椒样品5份,采集的样品由大米和二荆条辣椒制作,发酵时间>20 d,无酸臭味且无霉斑。样品采集后置于无菌采样袋中带回实验室于24 h内完成疑似乳酸菌的分离。
1.3.2 乳酸菌的分离鉴定
分离:采用倍比稀释法,将适当梯度的稀释液涂布于含有1%CaCO3的MRS固体培养基上,于DG250厌氧工作站中(N2、H2和CO2的体积分数分别为85%、10%和5%)37 ℃条件下静置培养48 h,根据菌落形态挑取单菌落并分离纯化3次。将革兰氏染色为阳性而过氧化氢酶实验为阴性的菌株初步判定为乳酸菌[13],并采用甘油保藏法冻存于-80 ℃备用。
分子生物学鉴定:使用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法提取乳酸菌基因组DNA[14],并以其为模板进行16S rDNA PCR扩增。PCR扩增体系为10×PCR buffer 2.5 μL、dNTP(2.5 mol/L)2.0 μL、27F/1495R引物各0.5μL、rTaq酶(5U/μL)0.2μL、模板0.5μL、无菌水18.8 μL。PCR扩增条件为94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min 30 s,重复30个循环;72 ℃再延伸10 min。PCR产物经过清洁、连接和转化后,挑取阳性克隆子送至南京金丝瑞生物科技公司进行测序。测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)上进行Blast比对,选取同源性≥99%的模式菌株的16S rDNA基因序列,采用MEGA 5.0软件中的邻接法(neighbor joining,NJ)构建系统发育树。
1.3.3 植物乳杆菌强化发酵鲊广椒的制作
原料搅拌均匀→接菌→装坛→密封→发酵→成品
操作要点:每2 L玻璃泡菜坛中大米粉、辣椒、花椒、胡椒和盐的添加量分别为750 g、225 g、3.15 g、3.15 g和75 g;L.plantarum接种量为5×106CFU/g鲊广椒,其中鲊广椒的质量为原辅料质量的总和;白酒喷洒量为3 mL,添加方式为坛口喷洒;发酵温度为30 ℃,发酵周期为20 d。分别使用分离的L.plantarum对鲊广椒样品进行强化发酵,以不添加乳酸菌进行自然发酵的鲊广椒为对照组。1.3.4 植物乳杆菌强化发酵鲊广椒风味品质的评价
参照钱琴莲等[15]的方法,使用电子鼻对鲊广椒风味品质进行评价。称取10 g鲊广椒于样品瓶中室温平衡10 min,60 ℃水浴保温20 min,设定进样吸气流量为200 mL/min,传感器清洁时间为90 s,调零时间为5 s,测定时间为60 s,选取测定时间为49 s、50 s和51 s的响应值求平均值后进行分析。测定时先清洗仪器3 min,再测定样品,每个样品的测定时间间隔为1.5 min。
1.3.5 植物乳杆菌强化发酵鲊广椒滋味品质的评价
参照王玉荣等[16]的方法,使用电子舌对鲊广椒滋味品质进行评价。称取50 g鲊广椒样品加入150 mL蒸馏水中浸泡30 min,8 000 r/min离心10 min后取上清液,测定各鲊广椒样品的酸味、苦味、涩味、鲜味和咸味5个基本味及后味A(涩味的回味)、后味B(苦味的回味)和丰度(鲜味的回味)3个基本味的回味,每个样品测定4次,取后3次测定数据进行分析。每10个样品为一批次进行测定,测定时均将对照组样品设置为1号位,同时在数据处理时将其各滋味指标强度设置为0。
1.3.6 植物乳杆菌强化发酵鲊广椒有机酸种类及含量的分析
参照杨成聪等[17]的方法,使用HPLC法对鲊广椒样品中的有机酸种类及含量进行测定。称取20 g鲊广椒样品,加入0.01 mol/L的磷酸二氢钾溶液定容至100 mL,浸泡30 min后,8 000 r/min离心10 min,上清液过0.45 μm的滤膜,滤液装于样品瓶中待测。绘制草酸、琥珀酸、乳酸、乙酸、苹果酸、酒石酸和柠檬酸7种有机酸的标准曲线,并对线性回归方程进行拟合。HPLC条件:流动相为0.01 mol/L的磷酸二氢钾溶液(pH值=2.30),柱温为25 ℃,检测波长为215 nm,进样体积为20 μL,流速为1.0 mL/min。
1.3.7 数据处理与统计分析
使用PCA法对L.plantarum强化发酵的鲊广椒品质进行分析,使用MEGA 5.0软件绘制系统发育树,其他图使用Origin 2017绘制。
2 结果与分析
2.1 当阳地区鲊广椒中乳酸菌的分离与鉴定
采用传统培养分离方法从5份当阳地区鲊广椒样品中分离得到18株疑似乳酸菌,编号为HBUAS52005~52010、HBUAS52015~52026。所有菌株在含有1%CaCO3的MRS固体培养基上均有透明圈,过氧化氢酶实验均呈阴性,革兰氏染色均呈阳性且细胞形态均为杆状。提取18株疑似乳酸菌菌株的基因组DNA并进行16S rDNA基因的PCR扩增,PCR扩增电泳结果如图1所示。
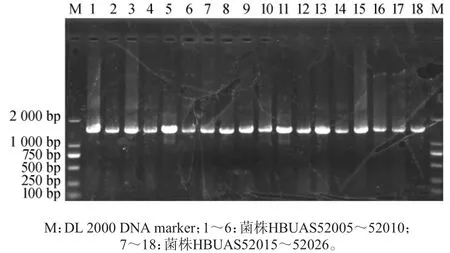
图1 18株乳酸菌的16S rDNA基因PCR扩增电泳结果Fig. 1 Electrophoretic results of PCR amplification of 16S rDNA gene of 18 lactic acid bacteria
由图1可知,18株疑似乳酸菌的PCR扩增产物碱基长度均为1 500 bp左右,条带清晰且无明显非特异性扩增条带。PCR扩增产物经进一步清洁、连接和转化后,挑选阳性克隆子送往测序公司进行测序。16S rDNA基因序列经比对分析后,选取同源性≥99%的乳酸菌模式种的16S rDNA基因序列构建系统发育树,结果如图2所示。
由 图2 可 知,菌 株HBUAS52005、HBUAS52006、HBUAS52007、HBUAS52008、HBUAS52010、HBUAS52015、HBUAS52016、HBUAS52017、HBUAS52018、HBUAS52019和HBUAS52020与植物乳杆菌(Lactobacillus plantarum)JCM1149聚于一个分支且同源性为99%,因而被鉴定为L.plantarum;菌株HBUAS52009与Lactobacillus futsaii YM0097同源性为100%,故被鉴定为L.futsaii;菌株HBUAS52024和HBUAS52026与营养乳杆菌(Lactobacillus alimentarius)DSM20249的同源性为99%,因而被鉴定为L.alimentarius;菌株HBUAS52021、HBUAS52022、HBUAS52023和HBUAS 52025与泰国魏斯氏菌(Weissella thailandensis)FS61-1聚于一个分支,故被鉴定为W.thailandensis。结果表明,从5份当阳鲊广椒中共分离到的18株疑似乳酸菌经16S rDNA序列分析后鉴定为2个属和4个种,其中L.plantarum有11株,占总数的61.11%,因而是当阳地区鲊广椒中的优势乳酸菌。

图2 基于16S rDNA基因序列构建的系统发育树Fig. 2 Phylogenetic tree based on 16S rDNA gene sequences
2.2 植物乳杆菌强化发酵对鲊广椒风味品质的影响
在对当阳地区鲊广椒中乳酸菌分离、鉴定的基础上,挑选其中11株L.plantarum分别进行鲊广椒的强化发酵,同时以未添加乳酸菌自然发酵的鲊广椒样品为对照。各传感器对不同处理鲊广椒风味品质的分析如表1所示。
由表1可知,较自然发酵的鲊广椒,传感器W1C、W3C和W5C对L.plantarum强化发酵制备的鲊广椒响应值的平均值均大于对照组,而传感器W5S、W1S、W1W、W2S、W2W和W3S呈现出相反的趋势。因传感器W1C、W3C和W5C主要对鲊广椒挥发性风味物质中的芳香类物质灵敏,而W5S、W1S、W1W、W2S、W2W和W3S主要对挥发性风味物质中的氢氧化物、甲烷、有机硫化物、萜类物质、乙醇或烷烃类物质灵敏,由此可见,添加L.plantarum进行强化发酵时多数鲊广椒的芳香类物质含量得到了提升。
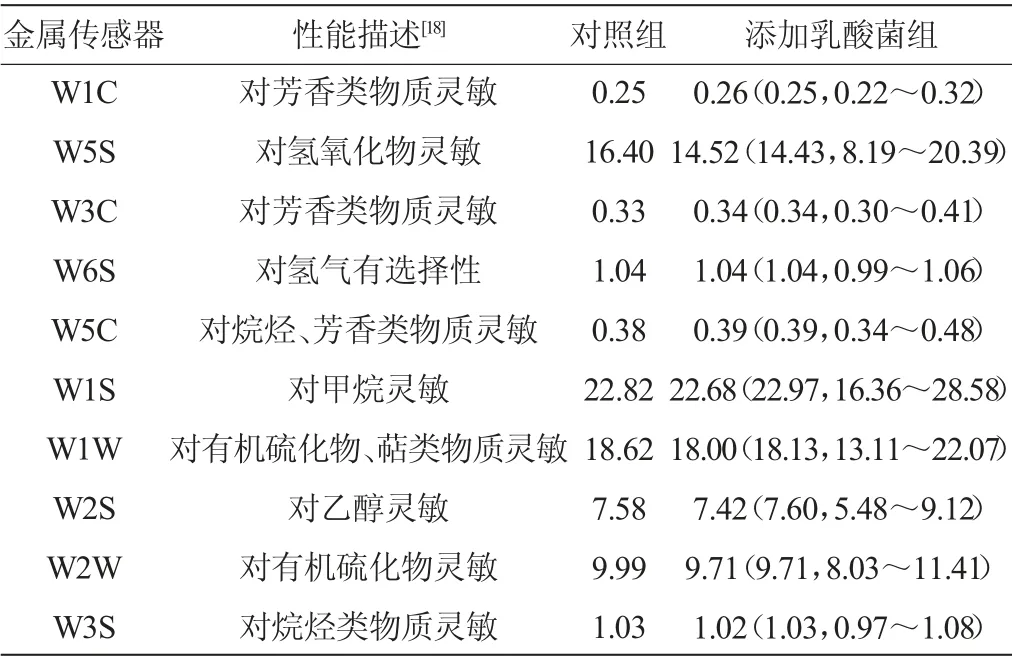
表1 各传感器对鲊广椒样品风味品质的分析Table 1 Flavor quality analysis of Zhaguangjiao samples by each sensors
2.3 植物乳杆菌强化发酵对鲊广椒滋味品质的影响
在对鲊广椒风味品质评价的基础上,进一步采用电子舌对鲊广椒的滋味品质进行评价,各滋味指标相对强度的箱型图如图3所示。
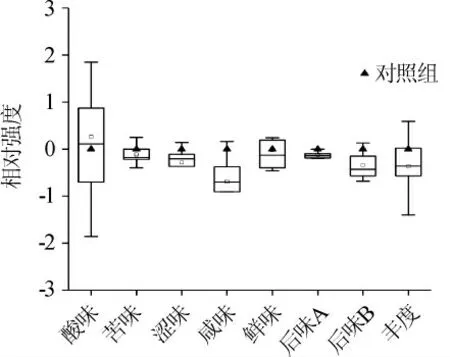
图3 不同处理鲊广椒各滋味指标相对强度值的箱型图Fig. 3 Box plot of relative intensity value of each taste indexes of Zhaguangjiao samples with different treatments
由图3可知,不同处理鲊广椒在酸味、鲜味和丰度(鲜味的回味)指标上存在较大的差异,其极差值分别为3.71、1.65和1.99,而在后味B(苦味的回味)、苦味、涩味、后味A(涩味的回味)和咸味上的极差值较小,分别为0.81、0.65、0.51、0.27和0.97。有文献报道[19-20],在使用SA402B电子舌系统对食品滋味品质进行评价时,若两个样品在某一指标上的相对强度值差异>1.0,则其差异可对消费者喜好性产生影响,否则无影响。由此可见,添加植物乳杆菌发酵对鲊广椒的影响主要体现在酸味、丰度(鲜味的回味)和鲜味上,且添加L.plantarum进行强化发酵时,鲊广椒的酸味强度得以提升,而其鲜味和丰度(鲜味的回味)强度呈现出相反的趋势。因此,进一步采用HPLC对不同处理鲊广椒中有机酸的种类及含量进行了测定,其结果如表2所示。

表2 不同处理鲊广椒中有机酸含量的比较Table 2 Comparison of the organic acid contents in Zhaguangjiao samples with different treatments
由表2可知,7种有机酸回归方程的相关系数均>0.99,呈现出良好的线性相关,说明拟合的回归方程具有较高的可信性。乳酸和乙酸为鲊广椒中的主要有机酸,含量分别在4.96~6.20 mg/g和1.15~8.92 mg/g范围内。较自然发酵鲊广椒,添加L.plantarum进行强化发酵时,多数鲊广椒的乳酸、乙酸、苹果酸、酒石酸和柠檬酸的含量明显上升,而草酸和琥珀酸含量下降。
2.4 基于PCA植物乳杆菌强化发酵对鲊广椒品质影响
为深入评价L.plantarum强化发酵对鲊广椒品质的影响,进一步结合电子舌和电子鼻数据进行PCA,基于PCA鲊广椒品质的因子载荷图如图4所示。
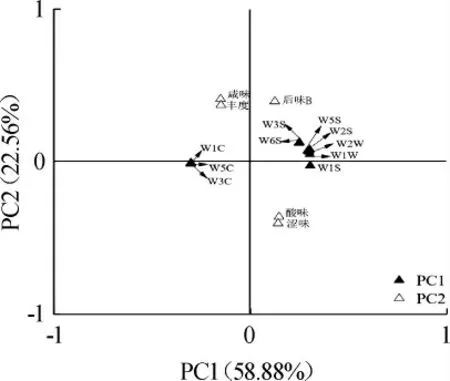
图4 基于PCA鲊广椒品质的因子载荷图Fig. 4 Factor loading diagram of quality of Zhaguangjiao samples based on PCA
由图4可知,第一主成分由10个电子鼻传感器(W1C、W2S、W3C、W1S、W6S、W5C、W3S、W2W、W5S和W1W)构成,其贡献率为58.88%。第二主成分由4个基本滋味指标(酸味、涩味、咸味、丰度)和1个回味指标(后味B)构成,其贡献率为22.56%。PC1中W1C、W3C和W5C位于X轴负方向,而PC2中酸味偏于Y轴负方向,传感器W1C、W3C和W5C对鲊广椒中芳香性风味物质敏感,酸味亦为鲊广椒的特征性指标,因而在空间排布上越偏向于左下方的鲊广椒样品其品质越好。基于PCA鲊广椒品质的因子得分图如图5所示。
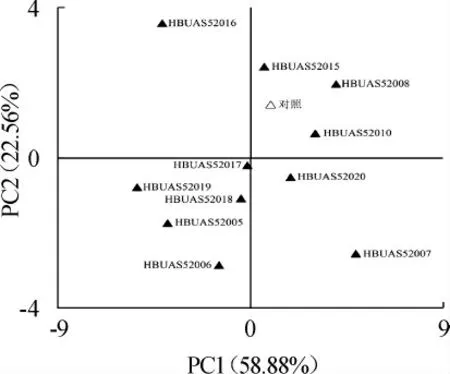
图5 基于PCA鲊广椒品质的因子得分图Fig. 5 Factor score diagram of quality of Zhaguangjiao samples based on PCA
由图5可知,除L. plantarum HBUAS52008外,其他L.plantarum强化发酵的鲊广椒样品在空间排布上均较自然发酵的样品偏下或偏左。由此可见,多数L.plantarum强化发酵可提升鲊广椒的品质。其中L.plantarum HBUAS52019强化发酵的样品在空间上的排布最偏向X轴负方向,因而其制备的鲊广椒风味最好,而L. plantarum HBUAS52006强化发酵的样品最偏向Y轴负方向,因而其制备的鲊广椒酸味最为浓郁。由此可见,L. plantarum HBUAS52019和L.plantarum HBUAS52006可作为潜在菌株用于后续鲊广椒产业化乳酸菌菌株的筛选研究。
3 结论
本研究采用传统培养分离方法和分子生物学技术从5份湖北省当阳地区鲊广椒中分离鉴定得到11株植物乳杆菌(L.plantarum),采用分离得到的11株L.plantarum强化发酵鲊广椒,结果表明,添加L.plantarum进行强化发酵时多数鲊广椒风味物质中的芳香类物质含量明显提升,滋味中酸味明显提升,而鲜味和丰度(鲜味的回味)明显下降,其中L.plantarum HBUAS52019和L.plantarum HBUAS52006可作为具有优良鲊广椒发酵特性的菌株用于后续的筛选。
——以“收”为主 多酸少辛

