膳食纤维经肠道微生态途径调节脂质代谢作用的研究进展
王 晨,钟赛意,邹宇晓*
(1.广东海洋大学食品科技学院,广东 湛江 524000;2.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610)
21世纪以来,随着全球经济的快速发展,人们饮食和生活方式发生了巨大的改变,以脂质代谢紊乱为共同特征的肥胖、2型糖尿病和高脂血症等慢性疾病的发病率急剧上升,成为现代社会公共卫生面临的严峻考验。据世界卫生组织报道,全球多个地区的超重/肥胖(身体质量指数(body mass index,BMI)≥25 kg/m2)发生率占比接近或超过50%,如美洲(61.1%)、欧洲(54.8%)和东地中海地区(46.0%)[1],据统计,2010ü2012年,中国15~17 岁青少年超过1/10的人超重或肥胖,近1/3的成年人超重或肥胖[2]。与肥胖密切相关的糖尿病发病状况也令人担忧,2014年全球有3.77亿 人患有糖尿病,其中中国糖尿病患者达9 630万[3]。
基因和高能量饮食被公认为是造成人体脂质代谢紊乱的两大诱因,由于饮食结构与人体健康的密切相关性,近年来关于健康膳食及其功能因子和活性机制等的研究已成为现代食品科学研究领域的重点方向,其中量大、面广的第七营养素——膳食纤维,对人体脂质代谢的调节作用尤其引人关注。膳食纤维在防治脂质代谢紊乱相关疾病方面的生物活性已被大量研究所证实[4],基于膳食纤维、肠道菌群和人体健康三者之间的密切关联性,从肠道微生态途径研究膳食纤维对脂质代谢的调节作用及相关机制日益深入,本文在查阅相关文献的基础上,重点综述了膳食纤维经肠道微生态途径调节脂质代谢的活性作用及其机制等内容,为利用膳食纤维研发减肥、辅助降血脂和降血糖等保健食品提供思路和参考。
1 膳食纤维的脂质代谢调节作用
1.1 膳食纤维的分类
膳食纤维是指聚合度为3~10范围内的一类碳水化合物聚合物,包括多糖、寡糖、纤维素、果胶和木质素等[5],它们在小肠中不能被消化吸收,但在到达大肠后可部分或全部发酵,生成短链脂肪酸(short chain fatty acids,SCFA)、CO2、H2、CH4等小分子化合物。膳食纤维可分为果胶、树脂等水溶性膳食纤维和纤维素、木质素等不溶性膳食纤维两大类,它们在肠道发挥不同的生物活性功能。
1.2 膳食纤维的脂质代谢调节作用
膳食纤维对人体具有多重健康效应[6-7],其中在预防肥胖[8]、辅助降血脂[9]、抗动脉粥样硬化[10]等方面表现出来的生理活性尤其引人关注,并取得了较好的研究进展。
为明确膳食纤维的摄入对脂质代谢的影响,Wang Jing等[11]发现摄入质量分数5%麦麸低聚木糖能够显著改善高脂饮食诱导大鼠体质量、改善血糖和血脂水平。Lee等[12]评估了不同纤维含量的水稻对韩国11 名健康受试者和10 名肥胖受试者的体质量、脂肪因子浓度和糖脂代谢的影响,6 周实验结束后,发现健康和肥胖受试者的体质量均发生高度显著下降(P<0.001),肥胖受试者BMI由(26.9f0.5)kg/m2高度显著降低至(26.0f0.6)kg/m2(P<0.001),血清三酰基甘油、总胆固醇、低密度脂蛋白胆固醇和C肽浓度与初始值相比均发生显著或极显著水平下降(P<0.01或P<0.05)。白钰等[13]观察了高膳食纤维低血糖生成指数(glycemic index,GI)的饮食对糖尿病患者血糖和血脂的影响,结果发现GI饮食干预可显著降低患者的总胆固醇、甘油三酯、空腹血糖、糖化血红蛋白、空腹胰岛素水平(P<0.05)。Araki等[14]对40~64 岁的糖尿病合并脂质代谢紊乱患者进行12 周的膳食干预实验,发现摄食富含膳食纤维的研磨糙米的患者体质量和腰围分别平均降低2.4 kg和3.1 cm,其低密度脂蛋白、甘油三酯水平均极显著降低(P<0.01);证实了增加膳食纤维的摄入比例可有效改善糖尿病患者脂质代谢。因此,提高膳食纤维的摄入水平,不仅能够改善糖尿病、肥胖和高脂血症等慢性疾病所引发的脂质代谢紊乱,还有利于健康机体保持脂质代谢稳态,对于脂质代谢紊乱的预防和治疗具有重要意义。
2 肠道菌群与脂质代谢
2.1 肠道菌群的分类与功能
肠道微生态系统是人体最复杂、最主要的微生态系统,人体肠道微生物的总数目约为1014个,是人体细胞总数的10 倍,其编码的基因总数至少是人类基因组的100 倍[15]。尽管人类肠道共生菌群组成复杂、种类繁多,但占据了整个肠道菌群总量99%的仅有30~40 种细菌,它们主要来自拟杆菌门(Bacteroidetes)(如拟杆菌属(Bacteroides)、普氏菌属(Prevotella)等)、厚壁菌门(Firmicutes)(如肠球菌属(Enterococcus)、梭菌属(Clostridium))、变形菌门(Proteobacteria)(如埃希氏菌属(Escherichia))和放线菌门(Actinobacteria)(如双歧杆菌(Bifidobacterium))四大门类[16],其中厚壁菌门和拟杆菌门占总菌群数量的90%。根据肠道菌群对人体的作用可将其分为益生菌和有害菌两大类,它们均来自拟杆菌门和厚壁菌门等门类。益生菌是指有益于人体健康的菌群,如双歧杆菌、乳酸杆菌等,这些益生菌不仅能够促进营养物质的代谢,同时还能提高人体对多种维生素、矿物质的吸收利用,表现出促进消化和预防便秘等多种功能[17]。有害菌既包括肠道固有菌如大肠埃希氏菌、金黄色葡萄球菌等,也包括外来细菌如痢疾杆菌等。正常情况下人体肠道菌群处于平衡状态,但不当的膳食结构如高能量或低纤维饮食会造成肠道菌群失衡,进而导致各种疾病的发生,如肥胖[18]、2型糖尿病[19]、动脉粥样硬化[20]和结肠癌[21]等。
2.2 肠道菌群与脂质代谢的相关性
肠道菌群与人体的互利共生关系对机体健康有着十分重要的意义[22]。近年来,越来越多研究发现肠道菌群作为影响宿主代谢的重要因子,与肥胖、2型糖尿病和高脂血症等脂质代谢紊乱等慢性疾病的发生发展密切相关[23-24]。
2.2.1 厚壁菌门/拟杆菌门相对比例与肥胖的相关性
厚壁菌门细菌(Firmicutes)和拟杆菌门细菌(Bacteroidetes)是肠道细菌的主要门类,厚壁菌门也被称为“胖菌”,拟杆菌门也被称为“瘦菌”,二者间的比例与肥胖的相关性目前尚无定论。部分研究结果显示肥胖人群体内的厚壁菌门/拟杆菌门比例高于瘦弱人群[25-27]。Bervoets等[28]通过实时定量基因扩增荧光检测系统分析了6~16 岁26 名肥胖和27 名瘦弱儿童的肠道菌群组成,研究发现肥胖儿童体内厚壁菌门/拟杆菌门极显著高于瘦弱儿童(P=0.007)。Ferrer等[29]比较了肥胖和瘦弱青少年粪便样本中肠道微生物的组成,结果发现肥胖者肠道中的厚壁菌门细菌占总菌群数量的94.6%,而拟杆菌门仅占3.2%。也有观点认为,厚壁菌门/拟杆菌门比例与机体的肥胖状态无直接关系。在鱼类的相关研究中,Duncan等[30]比较了肥胖和瘦弱鱼类粪便细菌,并没有发现拟杆菌门比例的差异,但同时证实了肥胖个体饮食中碳水化合物的含量减少,粪便中厚壁菌门的数量也减少。Schwiertz等[31]研究也得出了相似的结论,他们发现肥胖者体内厚壁菌门/拟杆菌门的比例更低,并且肥胖者在质量减轻的过程拟杆菌门数量并没有变化,推测SCFA是通过改变丙酸酯的比例从而影响能量代谢。Riva等[32]的研究通过16S rRNA基因靶向测序分析了6~16 岁42 名肥胖和36 名正常体质量儿童的肠道菌群组成,结果表明肥胖儿童和正常体质量儿童肠道中厚壁菌门的含量分别为(72.1f12.1)%和(60.9f14.1)%,拟杆菌门的含量分别为(16.6f11.8)%和(3.0f12.6)%,虽然肥胖儿童肠道细菌中厚壁菌门的含量明显高于拟杆菌门,但是不同个体的比例变化很大,作者推测可能厚壁菌门/拟杆菌门的比例并不是确定肥胖的一个确切指标。总之,关于肥胖者肠道厚壁菌门/拟杆菌门的比例变化仍然是个有争议的问题,原因可能是由于不同类别群体肠道菌群变化的差异,或者是由于不同研究人员采用的方法论不同,而且肠道菌群可能并非依赖于肥胖状态,而是与饮食有更为密切的关系。
2.2.2 益生菌与脂质代谢、肥胖的相互关系
关于益生菌的调节脂质代谢的作用已有大量文献报道,但不同种类的益生菌对脂质代谢和肥胖各相关生理生化指标的影响不尽相同,具体见表1。张勇等[33]发现益生菌Lactobacillus casei Zhang能够显著或极显著降低高血脂大鼠的肝脏总胆固醇、甘油三酯、血清载脂蛋白ApoB水平(P<0.05或P<0.01),显著增加粪便总胆汁酸水平和血清载脂蛋白ApoAⅠ水平;认为益生菌L. casei Zhang能通过增加总胆汁酸的排出和调节载脂蛋白水平来改善高血脂大鼠肝脏脂质水平。Yin Yayi等[34]观察了源自小鼠粪便的4 种双歧杆菌对高脂饮食诱导小鼠的影响,结果发现这4 种细菌均能够显著降低小鼠血清和肝脏甘油三酯、胆固醇含量,并缓解肝脏脂质沉积(P<0.05),然而4 种菌株对体质量的影响却有巨大差异,其中一种菌株能显著增加体质量,一种菌株显著减少体质量,剩余两种菌株对体质量无明显影响;提示双歧杆菌的抗肥胖作用可能具有菌株特异性。Kadooka等[35]对87 名肥胖患者每天分别给予200 g含有或不含加氏乳杆菌SBT2055的发酵酸奶,干预12 周后,与初始值相比,发现其腹部内脏脂肪面积、体质量、BMI、腰围、臀围分别极显著降低4.6%、1.4%、1.5%、1.8%、1.5%(P<0.01)。Cho等[36]将1 624 名参与者分成两组(益生菌产品(不含益生元和其他活性成分)干预组和对照组),进行30 次随机对照实验,结果显示与对照组相比,接受益生菌产品治疗的受试者其总胆固醇和低密度脂蛋白胆固醇水平分别降低了7.8 μg/dL(95%置信区间为(-10.4,-5.2))和7.3 μg/dL(95%置信区间为(-10.1,-4.4)),而高密度脂蛋白胆固醇与甘油三酯水平没有显著变化;表明益生菌膳食干预可通过降低总胆固醇和低密度脂蛋白胆固醇水平来改善脂质代谢。为了解孕期肥胖状况对下一代肠道菌群构成的影响,Collado等[37]选择BMI大于25 kg/m2和BMI小于25 kg/m2的怀孕母亲进行前瞻性随访研究,跟踪比较其婴儿0~6 个月的粪便样品肠道菌群组成,结果发现,与怀孕期间母亲体质量正常的婴儿相比,怀孕期间母亲体质量超重的婴儿粪便中拟杆菌属、梭菌属、葡萄球菌属含量明显增多,而双歧杆菌含量则显著减少。这证明了肠道菌群具有“可遗传的”特征,也证明了益生菌与脂质代谢的密切联系,但是到底是肥胖导致肠道菌群的改变还是肠道菌群的变化导致肥胖依然是个值得探索的问题,Kalliomäki等[38]分析25 名7 岁儿童的早期粪便微生物群组成,结果表明正常体质量的儿童在婴儿期粪便样品中的双歧杆菌数量更高,超重的儿童在婴儿期双歧杆菌的含量更低,并且金黄色葡萄球菌的数量更高,这表明肠道微生物群的异常组成发展先于超重。
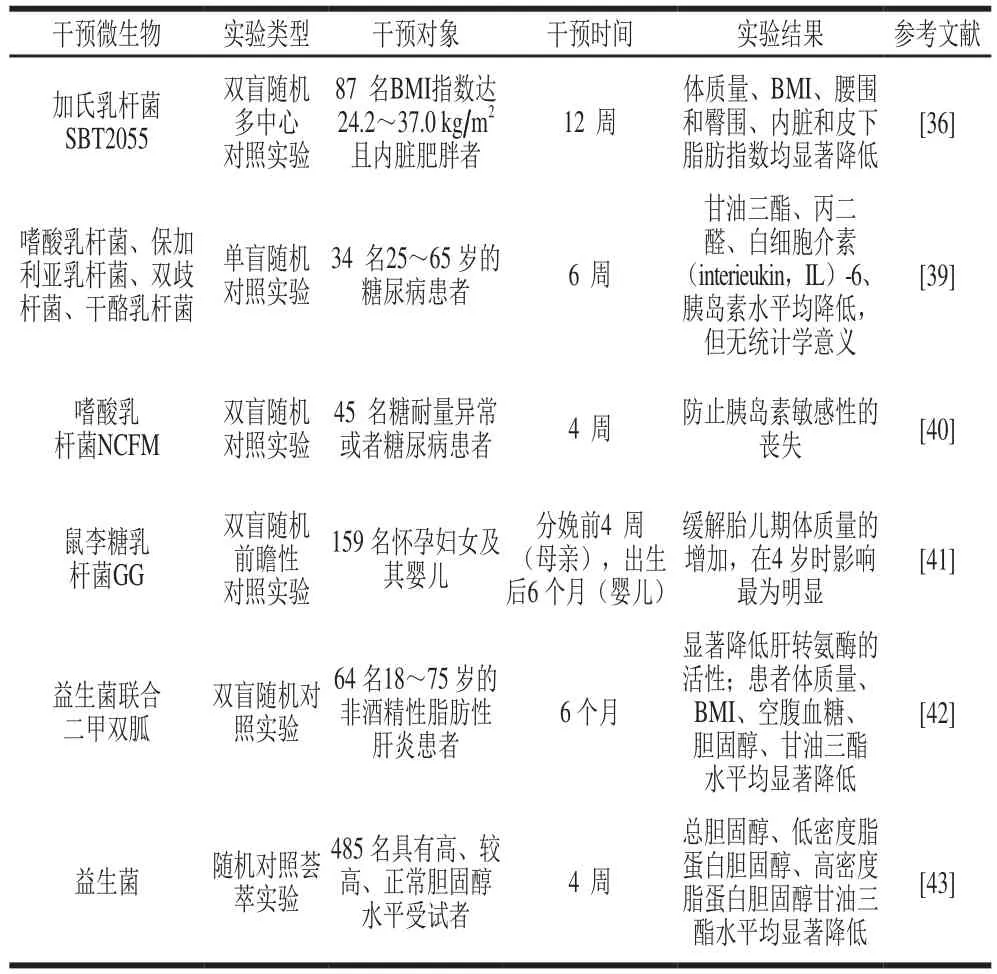
表1 益生菌对脂质代谢等相关疾病生理生化指标的影响(人群实验)Table1 Effects of probiotics on physiological and biochemical indexes of lipid metabolism and other related diseases in populations
2.2.3 肠道菌群的丰富度影响脂质代谢
除了肠道菌群的种类影响脂质代谢,肠道菌群的丰富度也与脂质代谢密切相关,肥胖会减少肠道菌群的多样性并且改变细菌的表达和代谢途径[44]。肠道菌群多样性降低导致微生物群落的稳定性降低,这是生态系统功能失调的征兆,与肥胖和炎症性肠病等息息相关。Shen Jian等[45]采用454高通量测序平台对胖瘦不同个体的肠道微生物进行了研究,也发现肥胖者的肠道微生物多样性明显降低,拟杆菌门所占比例较低,而放线菌门所占比例较高。Le Chatelier等[46]比较了169 名肥胖和123 名非肥胖的丹麦人的肠道微生物,结果发现两组人群肠道菌群的数量和丰富度不同,细菌丰富度低的个体与细菌丰富度高的个体相比表现出显著肥胖、胰岛素抵抗、血脂异常和炎症等症状,并且随着时间的推移,细菌丰富度低的肥胖个体体质量继续增长;此实验还发现,少数细菌物种足以区分具有高和低细菌丰富度的个体,因此某些细菌种类可以作为识别个体是否患有脂质代谢等相关疾病的标志物,这对医学领域具有重要意义。
3 膳食纤维通过肠道微生态途径影响脂质代谢的机制
3.1 膳食纤维通过改变肠道菌群组成调节脂质代谢
3.1.1 促进益生菌生长,抑制有害菌生长
研究表明不同食物、不同形态的膳食纤维均具有改善肠道菌群的功能,而且膳食纤维的理化特性和含量可以对肠道菌群的构成及其代谢产物产生重大的影响[47]。动物实验证明,谷物[48-49]、豆渣[50]、红枣[51]、香蕉[52]等食物中的膳食纤维均能够促进双歧杆菌和乳杆菌的增殖,抑制肠杆菌、肠球菌、产气荚膜梭菌等有害菌的增殖,并且抑制有害菌和促进有益菌生长的效果均随着膳食纤维浓度的增加而增强[53]。膳食纤维的溶解性与其功能密切相关。Li Ti等[54]研究发现湿法微粒法比干磨法制成的豆渣膳食纤维能够更加有效地促进有益菌增长,表明水溶性膳食纤维促进益生菌生长的效果更好。这是因为水溶性膳食纤维如果胶、树脂等能够被肠道内微生物分解利用,产生乙酸、丙酸、丁酸等挥发性脂肪酸及CH4等气体,降低肠道pH值,从而抑制沙门氏菌、埃希氏菌等革兰氏阴性菌的增长,促进双歧杆菌、乳酸杆菌等有益菌的生长;而不溶性膳食纤维主要是通过吸水膨胀加速粪便的排出,缩短其在肠道内的停留时间,同时排出大量的细菌及其发酵产物,从而协调菌系平衡和微环境的健康。在影响糖类和脂质代谢方面,水溶性膳食纤维具有更强的生理功能,它们既能溶解于水,又能吸水膨胀,延缓机体对糖类的消化吸收,从而抑制了餐后血糖值和胰岛素升高的反应,同时水溶性膳食纤维能够螯合胆固醇,将血液低密度脂蛋白胆固醇水平降低5%~10%[55]。
3.1.2 改变肠道拟杆菌门和厚壁菌门细菌比例
厚壁菌门细菌和拟杆菌门细菌是肠道细菌的主要门类,国内外大量人群实验和动物实验证明膳食纤维的摄入能够改变肠道厚壁菌门/拟杆菌门的比例,进而影响机体的脂质代谢。张素珍等[56]比较了高纤维膳食对高脂高糖诱导的小鼠肠道菌群的影响,结果显示不添加纤维的对照组拟杆菌门、变形菌门细菌的数量缓慢减少,厚壁菌门细菌数量增加;而添加纤维的处理组中,拟杆菌门和厚壁菌门细菌有所增加,变形菌门细菌没有明显变化。
Filippo等[57]的经典实验是对比非洲农村儿童(膳食特点为低脂低蛋白高纤维)和欧洲儿童(膳食特点为高脂高蛋白低纤维)的肠道菌群组成;结果显示,非洲儿童粪便中放线菌门和拟杆菌门含量丰富,厚壁菌门则含量很低;与之相反,欧洲儿童粪便中变形菌门含量丰富,厚壁菌门的含量接近于拟杆菌门含量的2 倍(图1、表2)。Wu等[61]研究了短期和长期膳食干预对98 名健康成年人粪便中肠道菌群组成的影响,结果表明高纤维膳食可以增加拟杆菌门和放线菌门的数量,高脂膳食可以增加厚壁菌门和变形菌门的数量。总之,宿主的饮食结构,尤其是膳食纤维的摄入比例,与肠道菌群中厚壁菌与拟杆菌的比值密切相关,但是目前影响这种关系的机制尚不明确。
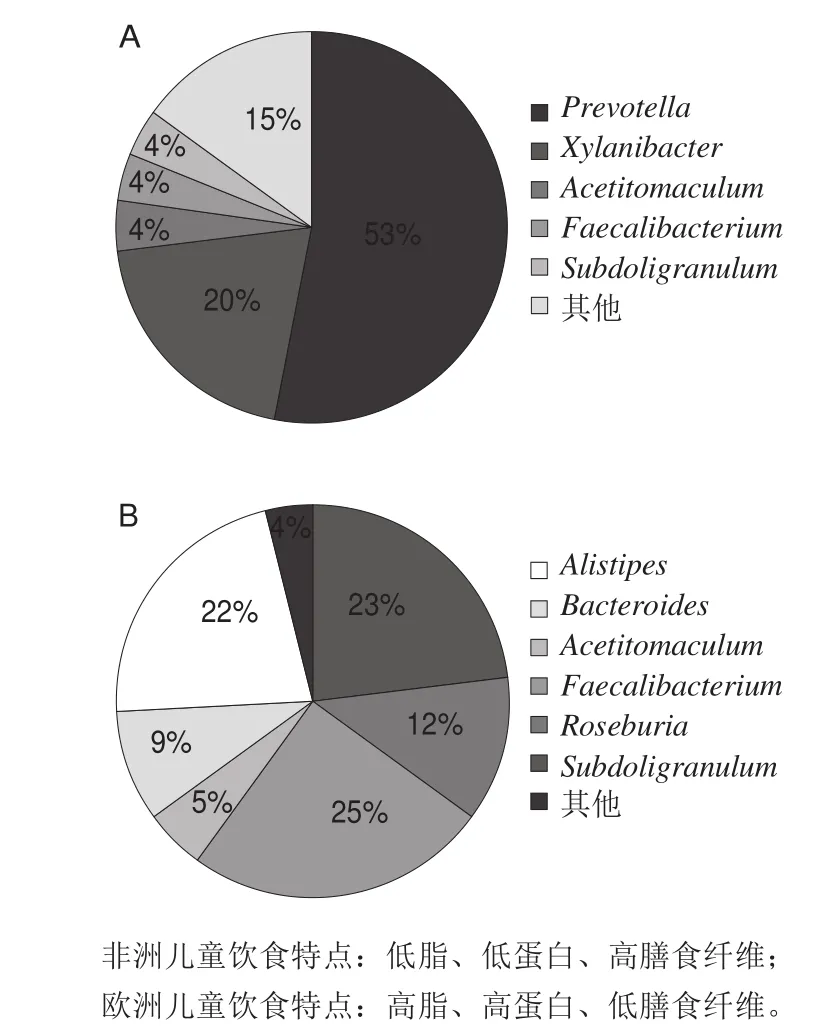
图1 非洲(A)和欧洲(B)不同饮食对儿童肠道菌群组成的影响[57]Fig.1 Effects of different diets on intestinal microf l oral composition in children from Africa (A) and Europe (B)[57]

表2 地域饮食差异(或习惯)对肠道菌群的影响(人群实验)Table2 Effect of regional difference in diet (or habit) on intestinal microf l ora in populations
3.1.3 增加肠道菌群多样性
肠道微生物的多样性有助于动物的总体发育和代谢需求,并为宿主提供许多有益的功能,包括产生SCFA和VK、胆汁盐的再循环、消化膳食纤维和发展免疫系统等[62]。不同的肠道菌群有其特定的功能,肠道菌群的种类越多,其能发挥的功效越多。大量研究证实膳食纤维与肠道菌群的多样性密切相关。Paul等[63]研究发现西方饮食(高脂肪低膳食纤维)能够显著降低肠道菌群的多样性,并且这种变化在一代人中是可以通过补充膳食纤维恢复的,而在几代人中膳食纤维的低丰度被转移到下一代,并不能通过补充膳食纤维而恢复。Filippo等[57]研究发现非洲儿童粪便中含有欧洲儿童粪便中未检测到的两个细菌种属(Prevotella和Xylanibacter),这两类细菌种属能够分解木聚糖和其他植物纤维产生SCFA。Ley等[64]发现草食性动物肠道菌群多样性最高,其次为杂食性动物,多样性最低的是肉食性动物的肠道菌群。Dominianni等[65]的人群实验证明了来自大豆、蔬菜、水果的膳食纤维能够增加放线菌的丰富度,对胃肠道乃至整个机体的健康有重要意义。Tap等[66]将19 名健康成年人分成两组,分别给予10 g和40 g的膳食纤维,5 d后测定粪便中的肠道微生物,结果发现摄食更多膳食纤维的组别其体内肠道微生物丰富度更高,肠道菌群的稳定性更高。上述实验均证实了膳食纤维能够提高肠道菌群的多样性。
3.2 膳食纤维通过肠道菌群提高肠道SCFA水平调节脂质代谢
肠道细菌具有人体不具备的多种酶系,能够将食物中不能被消化的大型多糖、寡聚糖和蛋白质等酵解成SCFA。SCFA都是弱酸,大部分以游离阴离子(SCFA-)形式存在于肠腔内,可迅速地被肠黏膜吸收。其转运吸收与MCT和SMCT1这两种转运蛋白密切相关,MCT是肠上皮的基底外侧型转运蛋白,SMCT1是在肠细胞刷状缘中表达的一种钠偶联的单羧酸盐转运蛋白,SCFA的吸收主要有两种途径:1)大部分SCFA是以离子形式通过转运蛋白MCT1或者SMCT1与HCO3-交换[67];2)SCFA-和H+结合后经细胞膜直接吸收,通过SMCT1和MCT与Na+、H+交换偶联[68]。绝大部分SCFA通过这两种途径被吸收,约各占50%,还有极少部分SCFA通过细胞间隙被吸收。
SCFA一旦被结肠黏膜上皮细胞吸收就能被转运至肝脏和脂肪组织,通过参与胆固醇、三酰甘油及脂肪酸的关键代谢过程,在维持机体糖脂代谢稳态方面发挥着重要作用。研究表明SCFA主要作为一种信号分子,经肠道上皮细胞吸收后,与两种G蛋白偶联受体(游离脂肪酸受体(free fatty acid receptor,FFAR)2和FFAR3)结合,可以迅速刺激5-羟色胺(5-hydroxytryptamine,5-HT)、胰高血糖素样肽(glucagon-like peptide,GLP)-1和酪酪肽(peptide YY,PYY)等肠道激素的分泌,5-HT是参与调节胃肠道运动和分泌功能的重要神经递质,可以调节肠道通透性,促进肠道蠕动,减少食物能量物质肠道吸收时间;GLP-1可以促进机体胰岛素分泌,直接调节血糖代谢;GLP-1和PYY都可以减慢胃排空,提升饱腹感,从减少食物摄入量来间接改善机体代谢[69-70]。SCFA还可随血液循环系统到达肝脏、脂肪和肌肉等组织,在机体的脂质代谢调节方面发挥重要作用。Olli等[71]对18 名非糖尿病肥胖成年人给予添加了聚葡萄糖的高脂饮食,结果发现经膳食纤维干预的实验组中肥胖者血清SCFA的含量和GLP-1的含量显著升高,并且能够降低40%的饥饿感,增加饱腹感,间接减少食物摄入量。
SCFA与FFAR2或FFAR3结合后,还可以刺激肝脏和肌肉组织中一磷酸腺苷活化蛋白激酶(adenosine 5’-monophosphate (adenosine monophosphate)-activated protein kinase,AMPK)的活性,进而激活下游的过氧化物酶体增殖物激活受体γ辅助激活因子-1α(peroxisomal proliferators-activated receptor γ-coactivator-1α,PGC-1α),P G C-1 α能够控制过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors,PPAR)、肝X受体等转录因子的表达,促进脂肪酸的氧化,从而改善脂质代谢[72]。Wang等[73]研究发现在喂养高脂饲料的同时给予小鼠甘蔗膳食纤维能够显著增加SCFAs的含量,增强肝脏中AMPK的活性,增加PGC-1α的表达水平,小鼠体内甘油三酯和胆固醇的含量和肝脏脂质含量均显著降低。
瘦素是一典型代谢激素,能够促使机体减少摄食,增加能量释放,抑制脂肪细胞的合成,进而达到控制体质量的目的。SCFA还可以通过促进脂肪细胞分泌瘦素而直接影响脂质代谢,Zhang Ru等[74]研究发现燕麦纤维和麦麸纤维能够显著增加小鼠脂肪组织中瘦素受体的蛋白表达,并且促进瘦素信号表达的Janus激酶2(Janus kinase 2,JAK2)和信号转导及转录活化因子3(signal transducers and activators of transcription 3,STAT3)的蛋白表达水平升高,抑制瘦素信号传导的细胞因子SOCS3的表达水平降低;实验表明谷物纤维可以通过JAK2/STAT3途径改善高脂饮食诱导小鼠的瘦素抵抗和敏感性,从而调节机体脂质代谢平衡状态。Huazano-García等[75]对高脂饮食诱导的超重小鼠给予5 周的果聚糖和菊粉摄入,结果表明,摄入果聚糖和菊粉的超重小鼠的体质量、体内甘油三酯和胆固醇浓度均显著降低,与对照组无显著性差异,并且小鼠体内SCFA的含量升高、GLP-1和瘦素的表达均显著提高;实验表明果聚糖、菊粉等膳食纤维能够改善由高脂饮食导致的脂质代谢紊乱症状,对机体健康具有重要的意义。
3.3 膳食纤维通过肠道菌群降低炎性因子调节脂质代谢
研究发现,肥胖、糖尿病等脂质代谢紊乱相关疾病是一种慢性低度炎症反应,这种炎症状态能够诱导并促进疾病的发生和发展[76]。高脂饮食与炎症因子表达水平密切相关。高脂饮食直接影响肠道菌群组成,一方面革兰氏阴性细菌占比增多,细胞裂解产生的脂多糖(lipopolysaccharide,LPS)含量增加;另一方面肠道屏障保护菌数量下降,肠道黏膜紧密连接蛋白和ZO-1表达水平降低,导致肠道通透性增强,促使更多LPS吸收入血,血液中过量的LPS与其受体Toll样受体4(Toll like receptor 4,TLR4)和LPS产生免疫反应的免疫蛋白CD14结合后可以共同激活免疫细胞释放C-反应蛋白(C-reactive protein,CRP)、肿瘤坏死因子-O(tumor necrosis factor-O,TNF-O)和IL-6等炎症因子,它们进一步通过核因子κB(nuclear factor-κB,NF-κB)等信号通路促进胰岛素受体底物1(insulin receptor substrate 1,IRS-1)磷酸化,导致机体发生胰岛素抵抗,诱发一系列炎症反应[77-79]。还有研究认为高脂饮食诱导肥胖小鼠迷走神经传入出现瘦素抵抗,LPS被认为在这种抵抗中起作用。瘦素抵抗可以引起食欲旺盛和体质量增加,并可能进而增加脂肪摄入和LPS浓度,诱导炎症反应[80]。
膳食纤维饮食则能够调节肠道菌群紊乱,缓解炎症反应。Jesenak等[81]实验证明燕麦β-葡聚糖能抑制小鼠腹腔注射LPS引起的非酒精性肝炎,其可能的机制是:燕麦β-葡聚糖能增加小鼠血浆中GLP-2的含量,而GLP-2能增强肠道上皮的增殖,降低肠道的通透性,从而减少脂多糖的吸收。Fei Na等[82]通过对123 名中心性肥胖志愿者给予WTP饮食(全谷物、传统中药材和益生元),23 周后发现,患者肠道菌群结构得到显著改善,产LPS的肠杆菌数量从最初的35%降至不可检测,体质量降低了51.4 kg,炎症水平降低,并且患者的高血压和高血糖症状得到显著缓解。膳食纤维发酵产生的SCFA在炎症反应的发生过程中起着重要的调节作用,SCFA能够通过弱化组蛋白脱乙酰基酶(histone deacetylase,HDAC)从而干预炎性因子的产生,一方面SCFA能够抑制LPS以及TNF-α、IL-6、NO等促炎因子的产生;另一方面它能够促进抗炎因子IL-10的释放[83]。许多表达在炎性细胞表面的G蛋白偶联受体(G protein-coupled receptors,GPRs)还能够调节转录因子的活性,从而影响炎性因子的合成和分泌,当SCFA作用于GPRs时,能迅速激活包括有丝分裂原激活蛋白激酶、蛋白激酶c和转录因子(如ATF-2)等的细胞内途径,使其在中性白细胞、单核细胞以及脂肪细胞中得到大量表达,从而减少促炎因子、活性氧簇、环氧合酶-2等的合成和分泌,最终达到抑制炎症反应的作用[84]。并且,SCFA还可以通过HDAC抑制NF-κB信号通路家族中的多种蛋白质的乙酰化作用,减弱机体LPS应答机制、抑制IKB的磷酸化从而抑制NF-κB通路的活性[85]。因此膳食纤维及其肠道代谢产物SCFA能够通过改善肠道菌群、增强肠屏障细胞的完整性、干预炎性因子的产生等多种途径降低高脂饮食诱发的炎症反应,对机体的脂质代谢稳态起到积极的调节作用。
3.4 膳食纤维通过肠道菌群影响FIAF表达调节脂质代谢
饥饿诱导脂肪因子(fasting-induced adipose factor,FIAF)也被称为“血管生成素样蛋白4”,是由脂肪组织、肝和肠分泌的一种蛋白质,可抑制脂蛋白脂肪酶(lipoprotein lipase,LPL)的活性,进而抑制细胞中脂肪酸的生成、转运及脂肪储存。Bäckhed等[86]研究发现在摄食量相同的情况下,无菌小鼠与常规小鼠相比,血清甘油三酯、乳糜微粒、脂肪酸和胆固醇的水平均升高,并且附睾脂肪组织中LPL活力增加了122%;表明肠道菌群通过调控FIAF的表达而影响LPL的活性,进一步影响甘油三酯在脂肪细胞的存储;摄入高脂饮食时,肠道FIAF的表达受到抑制,会增加肠道中脂蛋白脂酶活力,促进甘油三酯在脂肪组织中的积累,从而引起肥胖;当摄入膳食纤维时,膳食纤维改变肠道菌群的组成进而影响FIAF的表达,从而抑制脂肪积累。但Kim等[87]实验证明FIAF调节体质量的作用并不是由于肠道菌群,而是通过FIAF抑制下丘脑AMPK的活性从而抑制食物的摄入和体质量的增加。Fleissner等[88]研究不同饮食对无菌小鼠和常规小鼠的影响,结果发现高脂饮食和低脂饮食都会导致无菌小鼠体内FIAF mRNA表达增加,但常规小鼠体内FIAF mRNA表达水平还要略低于无菌小鼠;因此作者推测FIAF与高脂饮食和脂肪积累并没有直接相关。总之,FIAF对脂肪代谢是否起作用、是否通过肠道菌群来起作用仍然还存在争议,有待进一步探索。
4 结 语
膳食纤维、肠道菌群与脂质代谢三者关联密切,膳食纤维经肠道微生态途径维持人体脂质代谢稳态的健康效应业已得到大量科学研究的证实。膳食纤维及其代谢产物的多样性决定了其对肠道微生态环境影响的复杂性和多样性。通过膳食纤维的摄入调整肠道菌群的结构,进而预防和治疗脂质代谢紊乱等相关疾病,这将成为未来生物医学领域新的发展方向。综合目前的研究进展而言,尚有一些未知或有争论的问题有待进一步的深入研究:1)国内外关于肥胖者肠道菌群中厚壁菌门、拟杆菌门的变化,FIAF是否通过肠道菌群影响脂质代谢仍然存在争议,有待进一步探索;2)膳食纤维对肠道菌群有显著调节作用,但是其作用机理还不是很清楚,大部分研究仅来源于动物或细胞模型的基础实验,缺乏临床随机实验数据的支持;3)目前虽已发现许多调节肠道微生态的药物和食物,但是脂质代谢紊乱等疾病的前微生物标志物仍未确定,因此真正实现通过针对性膳食干预实现肠道菌群的调控,进而预防脂质代谢紊乱等慢性疾病将是未来生物医学领域的重点和难点。因此,研究人员应致力探索肥胖等代谢性疾病的前微生物标志物及对应的改善相应肠道微生物的食物和药物,深入开展对膳食纤维等生物活性物质调节肠道菌群的机理研究,开发以肠道菌群为靶点的膳食纤维药物和功能性食品,改善肠道菌群微生态环境,为预防脂质代谢紊乱等疾病做贡献。

