电子束辐照对中华管鞭虾原肌球蛋白免疫原性及其构象的影响
官爱艳,罗华彬,梅卡琳,张进杰,徐大伦,楼乔明,杨文鸽*,陆彤霞
(宁波大学食品与药学学院,浙江省动物蛋白食品精深加工技术重点实验室,浙江 宁波 315211)
作为联合国粮食及农业组织所确定的八大类主要食物过敏源之一,虾、蟹等甲壳类引起的过敏反应极为频繁,且发病率呈逐年上升趋势,过敏患者食用后往往会引起呕吐、腹泻和皮疹等不良反应,严重者可能导致荨麻疹、血管性水肿、哮喘等,给消费者健康带来严重威胁[1-2]。因此,采用合适的处理手段降低虾蟹类产品的致敏性十分重要。
中华管鞭虾(Solenocera melantho)又称红虾,资源丰富,是我国重要的海捕虾之一,因其营养丰富、味甜鲜美而深受人们喜爱,但中华管鞭虾也属于易引起过敏反应的较常见食用虾[3]。虾类等甲壳动物的主要过敏原是原肌球蛋白(tropomyosin,TM),其是一种热稳定性蛋白,经过一般的热加工致敏性不会完全丧失[4-5]。研究表明,TM的致敏性与其结构密切相关,改变TM的结构会导致其致敏性的降低[6-7]。改变TM结构的方法包括超高压、超声波、辐照等物理法[8-10]及美拉德反应、酶水解等化学、生物法[11-12],主要通过破坏蛋白质的非共价键、使蛋白质的肽链发生断裂或者改变其活性基团促进TM的降解、交联,从而破坏过敏原蛋白的空间结构。但由于影响到食品的外观、口感、营养品质或安全性等原因,在实际生产中这些消减食品致敏性的方法未能得到广泛的应用。
作为一种非热加工技术,辐照在食品保鲜、质量与安全控制等方面已有广泛研究和应用[13]。在杀菌的同时,电子束辐照对食品蛋白等生物大分子具有独特的改性作用,可能通过导致过敏蛋白解聚、交联、裂解以及结构的改变,继而破坏其抗原决定簇,影响过敏蛋白的免疫原性。顾可飞等[14]认为辐照会促进食品中的水分产生自由基,并引发一系列的化学反应,破坏蛋白质等生物大分子的构象,且破坏程度与辐照剂量成正相关;哈益明[15]分析了电离辐射对蛋白质分子的作用,认为辐照在生物体内产生的大量自由基可修饰氨基酸残基,以填隙或替代方式部分破坏蛋白质分子有序、均匀的自组织特性,从而导致蛋白质结构和构象的改变,发生肽链的断裂、聚合和交联,使蛋白质变性;Kume等[16]通过电子束辐照降低了卵清蛋白的致敏性,发现辐照能引起蛋白聚集、降解及疏水性变化,在一定程度上改变过敏原蛋白的抗原性;许舒婷等[17]利用电子束辐照花生,导致花生过敏原的生化性质发生改变并降低其免疫原性;Li Zhenxing等[18]的研究发现电子束辐照能引发小清蛋白羰基化而降低大菱鲆鱼肉的致敏性。但目前鲜见利用电子束辐照降低中华管鞭虾TM致敏性的研究。本实验以中华管鞭虾为原料,提取其中的过敏原TM,利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析TM组成及其含量变化,免疫印记法和间接酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测TM的免疫球蛋白(immunoglobulin,Ig)G结合能力变化,圆二色光谱(circular dichroism,CD)法和荧光光谱法检测辐照对TM二级结构及其表面疏水性的影响,探究电子束辐照对TM免疫原性及其结构的影响,旨在为利用电子束辐照消减虾类食品过敏提供参考。
1 材料与方法
1.1 材料与试剂
新鲜中华管鞭虾(Solenocera melantho)购自宁波水产交易市场,每只质量(13f2)g。
辣根过氧化物酶(hydrogen peroxide,HRP)标记的羊抗兔IgG抗体 北京全式金生物技术有限公司;兔抗中华管鞭虾TM-IgG抗体 杭州华安生物有限公司;牛血清白蛋白(bovine serum albumin,BSA)、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB) 美国Sigma公司;8-苯胺基-1-萘磺酸铵盐(1-anilino-8-naphthalene-sulfonate,ANS)、标准蛋白Marker(11~180 kDa)、考马斯亮蓝R-250、0.45 µm聚偏二氟乙烯(polyvinylidene fluoride,PVDF)北京Solarbio科技公司;增强型化学发光底物(enhanced chemiluminescence,ECL)、TBST缓冲液(20 mmol/L Tris-HCl、137 mmol/L NaCl、质量分数0.05%吐温20,pH 7.6) 美国Thermo Fisher公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Biofuge Stratos型台式高速冷冻离心机 德国Thermo Scientific SORVALL公司;XF-D型内切式匀浆机宁波新芝生物科技有限公司;DYCZ-40D型电泳仪北京六一仪器厂;Tanon-5200凝胶成像系统 上海天能公司;Inf i nite M 200 PRO型多功能酶标仪 瑞士TECAN公司;J-1500型CD仪 日本JASCO公司。
1.3 方法
1.3.1 中华管鞭虾TM的分离纯化及其抗体制备
参照傅玲琳等[19]的方法纯化,并用10 mmol/L pH 7.5磷酸盐缓冲液(phosphate buffered saline,PBS)透析,冷冻干燥得到TM干粉。ELISA检测纯化后的兔抗中华管鞭虾TM-IgG抗体效价达到1∶60 000。
1.3.2 TM的电子束辐照处理
用10 mmol/L PBS(pH 7.5)溶解TM干粉,配制成2 mg/mL TM溶液,分装于聚乙烯袋中,真空密封。采用NBL-1010型电子直线加速器(能量10 MeV)在不同辐照剂量(1、3、5、7、9 kGy)下处理,剂量率1 kGy/s,平均电流强度1 128 μA。吸收剂量通过分光光度法检测,采用FWT-60薄膜剂量计标定,该剂量计经中国计量科学院比对,剂量测量误差小于3%。共6 组TM溶液用于指标分析,以未经辐照处理(0 kGy)的TM溶液为对照组。
1.3.3 SDS-PAGE分离TM溶液
参考Wang Xiudan等[20]的方法并略作修改。分离胶和浓缩胶体积分数分别为15%和5%,每孔TM溶液上样量为5 μL。起始电压100 V,待溴酚蓝移至浓缩胶与分离胶的交界处改为80 V,考马斯亮蓝R-250染色,脱色后使用凝胶成像仪拍照。
1.3.4 免疫印迹法测定TM溶液与IgG的结合能力
SDS-PAGE分离各组TM溶液,将蛋白条带转到PVDF膜上,25 ℃用TBST缓冲液(含5%(质量分数,下同)脱脂奶粉)封闭,1 h后改用兔抗中华管鞭虾TM-IgG抗体(用含0.5%脱脂奶粉的TBST缓冲液以体积比1∶10 000稀释)封闭过夜(25 ℃、10 h),TBST缓冲液洗3 次,10 min/次。PVDF膜用HRP标记的羊抗兔IgG抗体(用含0.5%脱脂奶粉的TBST缓冲液以体积比1∶5 000稀释)在25 ℃下孵育40 min,TBST缓冲液洗3 次,10 min/次。最后采用ECL显色,凝胶成像系统拍照。
1.3.5 ELISA法检测TM与IgG的结合能力
参考Tong Ping等[21]的方法并略作修改。通过BCA法将各组TM溶液用pH 9.6的Na2CO3/NaHCO3缓冲液稀释到0.5 mg/mL并加至酶标板,每孔50 μL,包被过夜(4 ℃、10 h)。用180 μL TBST缓冲液洗板3 次,拍干后每孔加入封闭液(含5%脱脂奶粉的TBST缓冲液)200 μL,37 ℃下包被1 h。弃封闭液,用TBST缓冲液洗板,拍干。每孔加入50 μL兔抗中华管鞭虾TM-IgG抗体(用封闭液以体积比1∶2 500稀释),37 ℃下孵育1 h。用TBST缓冲液洗板,拍干后每孔加入50 μL HRP标记的羊抗兔IgG二抗溶液(用封闭液以体积比1∶10 000稀释),37 ℃下孵育45 min。用TBST洗板3 次,拍干。每孔加入100 μL TMB底物溶液显色,37 ℃放置5 min,每孔加入90 μL 2 mol/L H2SO4终止液,酶标仪检测各孔OD450nm值。
1.3.6 CD法分析TM的二级结构
各组TM溶液(1 mg/mL)分别加入0.2 mm色谱池,CD扫描波长为190~250 nm,扫描速率50 nm/min,带宽1.0 nm,响应时间2 s,连续扫描3 次,取平均值,以20 mmol/L PBS作为空白。结果使用系统自带软件进行分析,用Yang等[22]的方法估算二级结构含量。
1.3.7 荧光光谱法检测TM的表面疏水性
参考Kato等[23]的方法并略作修改。用20 mmol/L PBS(pH 7.5)稀释TM溶液,使蛋白质量浓度在0.1~1.0 mg/mL之间。取不同质量浓度的样品1 mL,加ANS溶液10 μL,振荡后静置3 min,设定激发波长λex为370 nm,发射波长λem为490 nm,检测荧光强度,以荧光强度对蛋白质量浓度作图并外推至蛋白质量浓度为0 mg/mL,曲线初始阶段斜率即为TM样品的表面疏水性指数。
1.4 数据统计与分析
实验平行次数为3 次,数据采用SPSS 19.0软件进行单因素方差分析,差异水平为0.05,使用Origin 9.0软件制作图表。
2 结果与分析
2.1 电子束辐照剂量对TM含量的影响
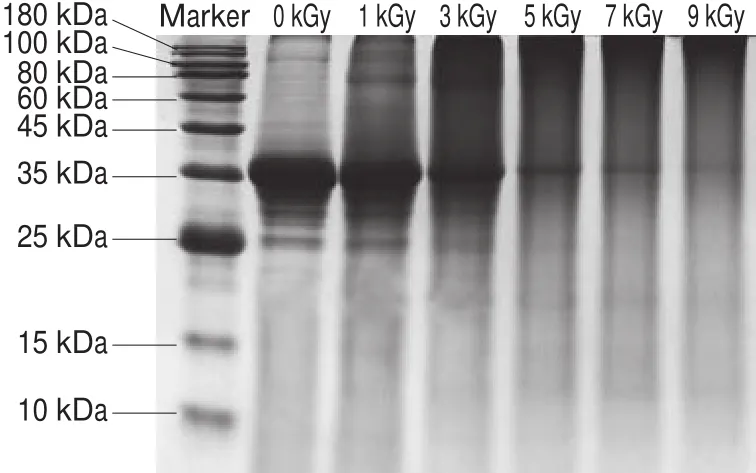
图1 不同辐照剂量条件下TM溶液的SDS-PAGE图谱Fig.1 SDS-PAGE patterns of TM irradiated with different EB doses
TM的分子质量约为36 kDa,由图1可见,电子束辐照导致TM溶液中的TM含量降低,且随辐照剂量的增加,TM含量的下降更明显,原因可能是辐照使TM发生降解或聚集。
2.2 电子束辐照剂量对TM溶液免疫原性的影响

图2 不同辐照剂量条件下TM溶液的免疫印迹检测图谱Fig.2 Western blot patterns of TM irradiated with different EB doses
利用免疫印迹法进一步确定电子束辐照对TM溶液免疫原性的影响。由图2可知,对照组TM溶液的IgG结合能力最强,随辐照剂量的增加,所测TM溶液的IgG结合能力逐渐降低,尤其是经5 kGy及以上剂量辐照处理后,TM与IgG的结合能力显著降低,至9 kGy辐照处理时TM溶液已基本丧失IgG结合能力。这主要是由于辐照使TM含量下降;另一个原因可能是辐照导致TM结构变化使其IgG结合能力下降。免疫印迹检测结果表明,对TM溶液进行电子束辐照处理可使TM免疫原性降低,且电子束辐照剂量越高,降低效果越明显。
2.3 电子束辐照剂量对TM与IgG结合能力的影响
在将辐照后的TM溶液调至同一质量浓度的基础上,由图3可知,与对照组相比,电子束辐照处理能显著降低TM的IgG结合能力,且随辐照剂量的增加降低效果更明显。经1 kGy电子束辐照处理后,TM的IgG结合能力下降了34.45%,1 kGy和3 kGy组差异不显著,但与高剂量组相比差异显著。当电子束辐照剂量超过5 kGy时TM的IgG结合能力显著下降,尤其经9 kGy电子束辐照处理后TM的IgG结合能力显著下降了50.53%。这可能是因为辐照使TM结构发生了变化;另一个原因可能是辐照使TM发生部分降解。
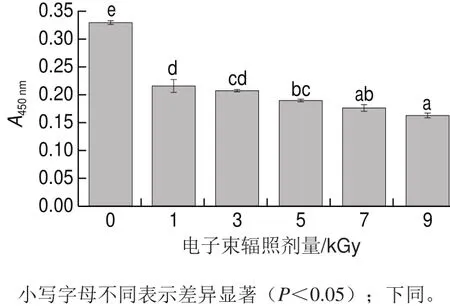
图3 不同辐照剂量条件下TM与IgG的结合能力Fig.3 IgG-binding capability of TM irradiated with different EB doses
2.4 电子束辐照剂量对TM二级结构的影响
TM由两个结构相同的亚基组成,利用不同方法在不同处理条件下分别进行解谱分析,所得到的各种TM的二级结构含量不同,但在天然TM中均以α-螺旋含量最高[24]。各组TM的CD图谱见图4,根据图4通过软件估算TM各二级结构含量,结果如图5所示。

图4 不同辐照剂量条件下TM的CD图谱Fig.4 CD patterns of TM irradiated with different EB doses
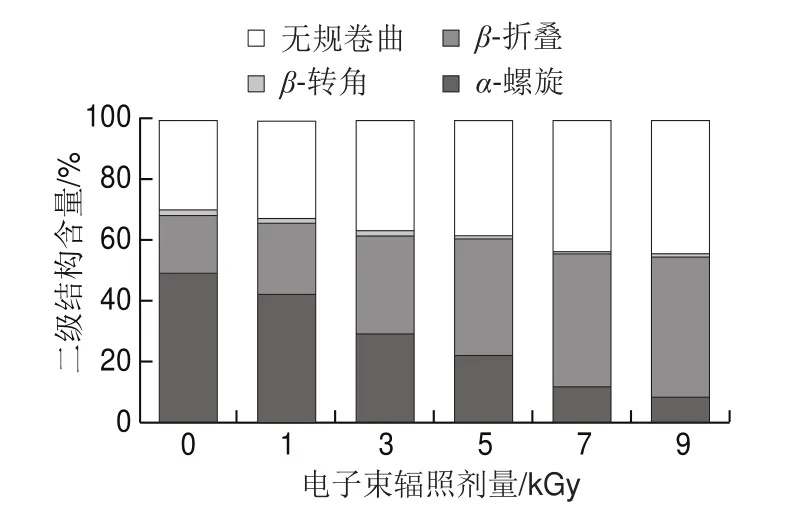
图5 不同辐照剂量条件下TM的二级结构含量Fig.5 Secondary structural composition of TM irradiated with different EB doses
由图5可知,天然TM的二级结构中α-螺旋含量最高,其次为无规卷曲。经电子束辐照,TM中的α-螺旋含量降低,而β-折叠和无规卷曲含量有所增加,且呈剂量-效应关系。与对照组相比,5 kGy组α-螺旋含量下降了55.38%,β-折叠和无规卷曲含量分别增加了102.08%和28.62%,β-转角含量基本不变。电子束辐照使TM结构中的α-螺旋遭到严重破坏,部分解旋为β-折叠或无规卷曲,分子无序结构比例上升,表明电子束辐照会破坏TM的空间结构,导致TM免疫原性的变化。
2.5 电子束辐照剂量对TM表面疏水性的影响

图6 不同辐照剂量条件下TM的表面疏水性Fig.6 Surface hydrophobicity of TM irradiated with different EB doses
由图6可知,经电子束辐照处理后,中华管鞭虾TM的表面疏水性指数显著升高,且随着辐照剂量的增加逐渐升高。与对照组相比,经1、3、5、7、9 kGy电子束辐照处理,TM的表面疏水性指数分别增加了33.22%、100.31%、123.87%、167.94%和170.56%,7 kGy和9 kGy组TM的表面疏水性指数无显著差异(P>0.05)。表明电子束辐照处理使TM的空间构象发生变化,其表面疏水性增强。
3 讨 论
由SDS-PAGE结果可知,随电子束辐照剂量的增加,尤其是达到5 kGy及以上时,中华管鞭虾TM溶液中的TM含量明显降低,表明电子束辐照对TM具有降解或聚集作用,这与前人的研究结果类似。刘光明等[25]发现高剂量电子束辐照能降解蟹类过敏蛋白;Kume等[16]认为电子束辐照能引起卵清蛋白聚集、降解及疏水性改变;张立敏[26]研究了电子束辐照对大菱鲆TM的影响,显示TM组分没有明显变化,含量随辐照剂量的增加而降低,辐照剂量达5 kGy以上能有效降低大菱鲆蛋白过敏原的免疫原性。由SDS-PAGE、免疫印迹和ELISA结果可知,电子束辐照降低了中华管鞭虾TM与IgG结合能力,这一方面是因为辐照使TM含量有所降低;另一方面可能是因为辐照导致TM结构变化使其免疫原性降低。且由同一质量浓度下的ELISA结果可知,随辐照剂量的升高,电子束辐照对TM免疫原性的降低效果越明显。廖涛等[27]研究辐照对TM生化特性的影响,发现TM的免疫原性也随着辐照剂量的增加而降低;Li Zhenxing等[28-29]分别研究了g射线辐照和热处理对虾抗原性的影响,发现随辐照剂量的增加,虾过敏原的免疫原性逐渐降低;Byun等[9]研究了g射线辐照对棕虾主要过敏原的构象及抗原性的影响,发现棕虾过敏原对病人IgE的结合能力呈剂量依赖性减少。
过敏蛋白结构的变化会导致其免疫原性的改变[30-31],电子束辐照后TM潜在致敏性的降低与辐照对其蛋白质结构上的影响息息相关。蛋白分子中的α-螺旋依赖—CO和—NH之间的氢键而形成稳定的螺旋构象,辐照后中华管鞭虾TM所含的α-螺旋含量减少,β-折叠和无规卷曲含量增加,表明电子束辐照引起TM解螺旋,TM的α-螺旋结构遭到破坏,紧密而规则的构象单元部分转变为较无规则的构象,同时大量疏水基团暴露在分子表面,导致表面疏水性升高,表明电子束辐照改变了中华管鞭虾TM的空间构象。Long Fangyu等[8]研究了高压和热处理对虾TM潜在致敏性的影响,发现超高压可破坏蛋白质分子中的非共价键,使蛋白多肽链发生去折叠甚至降解,破坏或修饰过敏蛋白的抗原表位,改变了蛋白结构和物理特性,进而影响到蛋白质的功能;Lü Liangtao等[32]研究丙二醛对虾TM的氧化修饰对其致敏性的影响,发现带活性基团的丙二醛可以和TM的氨基酸侧链发生反应,导致TM结构及其致敏性发生变化。可见TM的致敏性降低与其结构的变化相关。Li Zhenxing等[18]研究辐照和热处理对虾致敏性的影响,认为其致敏性的降低可能是由于辐照和热处理过程中产生的自由基作用于过敏原,导致过敏原蛋白二级结构去折叠,使暴露在蛋白表面的抗原表位遭到破坏,导致了虾致敏性的显著下降。
电子束辐照消减中华管鞭虾TM的免疫原性,原因可能在于辐照导致TM溶液中产生大量自由基,这些自由基攻击TM抗原决定簇的活性基团,破坏其构象单元结构,使TM分子的α-螺旋含量下降,β-折叠和无规卷曲含量增加,使TM分子有序、均匀的空间构象遭到破坏,大量疏水性残基暴露于分子表面;同时发生蛋白肽链的裂解或聚集,使TM结合IgG的能力降低,尤其是当辐照剂量高达5、7、9 kGy时,TM免疫原性的降低更为显著。电子束辐照有望用于降低中华管鞭虾及其制品的潜在致敏性。

