虾青素对肝脂代谢与昼夜节律的调节作用
左正宇,邵 洋,刘 杨,卜怡然,王华林,李 娜,刘志国*
(武汉轻工大学生物与制药工程学院,湖北 武汉 430023)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是最常见的慢性肝病,病程上可从单纯性的脂肪性变性发展到非酒精性脂肪性肝炎,甚至肝硬化、肝癌[1]。NAFLD与肥胖、高脂血症、II型糖尿病密切相关,被认为是代谢综合征在肝脏中的表征[2-3],已经成为一个严重的社会健康问题[4]。目前普遍被接受的NAFLD的发病机制是“二次打击”学说[5],其中细胞内以氧化应激为主的各种应激被认为是导致疾病发展的重要因素[6]。
虾青素(astaxanthin,AX)是存在于微藻、真菌和甲壳类动物体内的一种脂溶性类胡萝卜素[7-8],它是一种天然的抗氧化剂,能够猝灭活性氧并清除自由基[9],具有抗炎、抗肿瘤、抗糖尿病及心血管和神经保护等多种有益作用[10-11]。近年来,研究发现虾青素可以改善高脂饮食诱导的肝功能障碍以及血脂升高,并能抑制炎症因子的释放,有效防止肝脏内质网应激、炎症和脂肪沉积[7,12],从而对改善NAFLD有积极作用。但虾青素改善肝脂代谢的具体机制尚不十分清楚。特别是近年的研究发现高脂负荷可导致脂质吸收与代谢异常,同时也伴随昼夜节律的紊乱,两者的关系广受关注[13]。
生物节律也称生物钟,是生物(尤其是哺乳动物)体内影响动物行为及各种生理生化活动,随日落日出而呈现昼夜变化的自主性分子机制,它会随外界环境(如光/暗、温度等)变化而对节律作相应调整和修正[14]。对哺乳动物来说,生物钟包括中枢时钟系统与外周时钟系统。中枢节律位于下丘脑的视交叉神经核,受外界环境改变和内源性物质的影响。外周节律存在于外周组织的肝、肠、心脏等器官中,调控外周组织的代谢活动,它一方面受中枢节律的控制,另一方面又受进食及营养因素的影响[15-16]。尤其对于肝脏来说,其既是全身营养代谢的中心,又是外周时钟系统中的核心器官,通过昼夜节律调控体内能量代谢限速酶的表达以调节代谢的方向和速度[17]。高脂所致的代谢异常同时伴随昼夜节律的紊乱,虾青素通过改善氧化应激,缓解NAFLD的进展,这一作用是否与改善节律调节相关,或是否对代谢基因表达存在节律性的调节作用目前尚属未知。
本研究通过高脂/高胆固醇饲喂建立NAFLD小鼠模型及添加虾青素的干预模型,研究虾青素对NAFLD代谢异常的改善作用以及对高脂所致的生物节律絮乱的干预作用。对研究虾青素干预对昼夜节律的影响以及针对性地开展虾青素营养干预具有一定意义。
1 材料与方法
1.1 动物、材料与试剂
SPF级C57BL/6雄性小鼠60 只(许可证号:SCXK(鄂)2015-0018) 湖北省疾病预防控制中心湖北省实验动物研究中心;虾青素(质量分数5%) 中国科学院水生生物研究所;动物饲料 南通特洛菲饲料科技有限公司。
TRIzol(生化试剂)、逆转录酶、寡核苷酸(18 nt Oligo(dT)) 宝生生物工程有限公司;dNTPs、异丙醇(分析纯)、SYBR Green荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,qPCR)Mix 北京艾德莱生物科技有限公司;氯仿(分析纯)天津市天力化学试剂有限公司;反转录试剂盒 宝日医生物技术(北京)有限公司;引物由上海生工生物工程有限公司合成;总胆固醇(total cholesterol,TC)测定试剂盒、甘油三酯(triglyceride,TG)测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)测定试剂盒、谷丙转氨酶(alanine aminotransferase,ALT)测定试剂盒、谷草转氨酶(aspartate transaminase,AST)测定试剂盒南京建成科技有限公司。
1.2 仪器与设备
专业型梯度PCR仪 德国Biometra公司;超微量紫外分光光计 美国Thermo Fisher Scientif i c公司;酶标仪瑞士TECAN公司;qPCR仪 美国ABI公司;高速冷冻离心机 德国Sigma公司;正置光学显微镜、凝胶成像系统 日本NIKON公司;可见分光光度计 上海尤尼柯仪器公司。
1.3 方法
1.3.1 实验动物及饲料配方
参考前期实验建立动物模型[18],选用SPF级C57BL/6雄性小鼠60 只,7~8 周龄,体质量(20f1)g,饲料参照Hayek西方饮食模型饲料配比,分为对照组(CON组)、高脂模型组(HFD组)、高脂添加虾青素组(AX组)。饲料配方见表1,能量构成见表2。
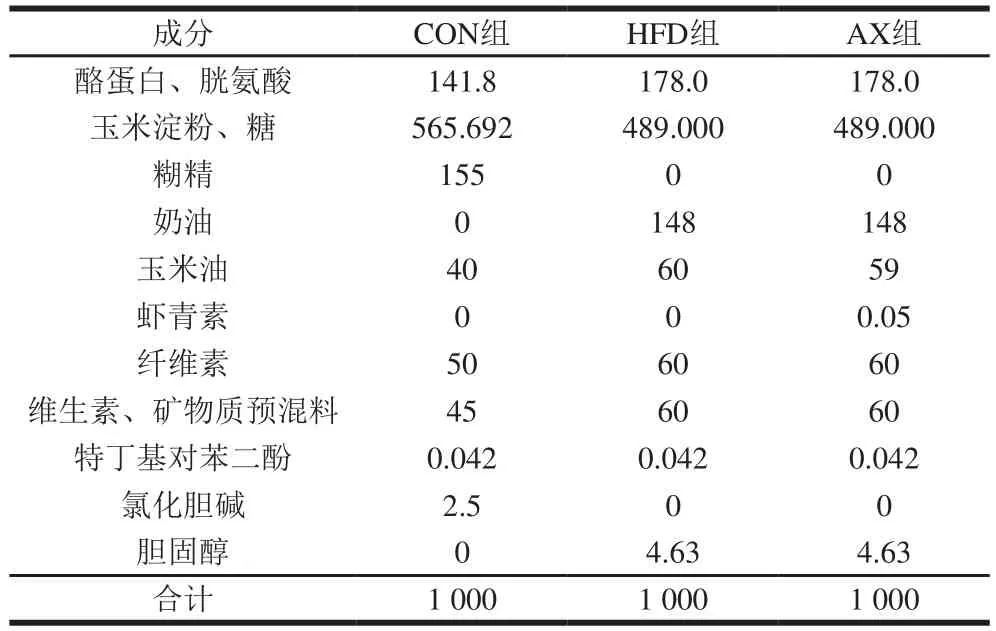
表1 实验动物的饲料配方Table1 Nutrient composition of diets g
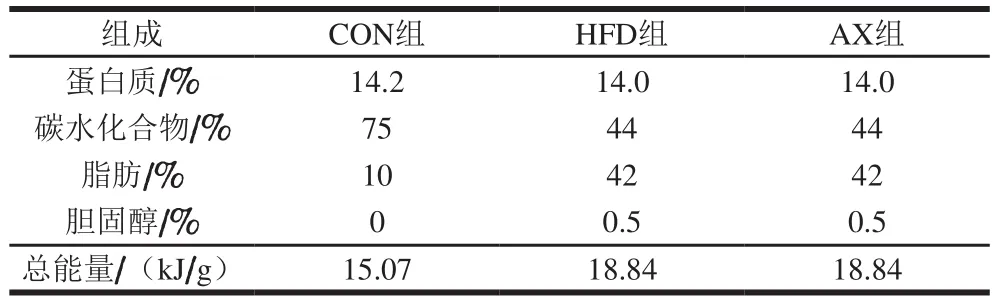
表2 实验动物的饲料能量构成Table2 Feed energy constituents
1.3.2 动物分组及造模
60 只小鼠均饲养于清洁级环境中,实验条件设置为:温度(23f2)℃,相对湿度55%~65%,12 h光照/12 h黑暗环境,即7:00开灯、19:00关灯。光暗环境中的时间用授时时间表示,ZT0为光照开始时间,ZT12为光照结束时间。适应性喂养一周后,对实验小鼠按体质量排序随机分成3 组(每组20 只),分别为CON组、HFD组、AX组。自由饮食,喂养11 周后测其糖耐量,12 周后每组各10 只分别在ZT0、ZT12两个时间点处死,小鼠处死前禁食12 h,自由饮水。以5 mg/mL戊巴比妥钠腹腔麻醉小鼠,腹主动脉采血,将血液置于放有肝素钠的EP管中,3 000 r/min离心15 min,取上清液保存于-80 ℃冰箱中待用。分离肝脏,一部分保存于-80 ℃冰箱,一部分固定于体积分数10%甲醛溶液中待用。
1.3.3 小鼠体质量、肝脏指数及脂肪指数的测定
在小鼠处死前,称量每只小鼠的体质量并记录。处死小鼠后,取出小鼠肝脏、肾周脂肪及附睾脂肪垫,用生理盐水去除表面血污,滤纸吸干,称质量记录。小鼠肝脏指数与肥胖指数分别按照式(1)、(2)计算。

1.3.4 血清生化指标测定
在饲喂12 周后,各组小鼠禁食不禁水12 h,腹腔麻醉,腹主动脉采血,分离血清,按照各血液生化指标试剂盒说明书方法分别检测血清TC、TG、HDL-C、LDL-C浓度和ALT、AST活力。
1.3.5 病理学检测
取相同位置肝脏,放入盛有体积分数10%多聚甲醛溶液的标本瓶中固定。24 h后将固定的肝组织脱水,石蜡包埋并切片。切片经二甲苯脱蜡,梯度乙醇水化,先后用伊红、苏木精染色和复染,梯度脱水后用二甲苯透明,中性树胶封片,用显微镜观察肝脏组织病理学变化。
1.3.6 qPCR检测肝组织基因表达
采用TRIzol法提取肝脏总RNA,并按反转录试剂盒说明书进行逆转录操作。20 μL体系如下:总RNA 1 μg,5hgDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,5hPrimeScript Buffer 4.0 μL,PrimeScript RT Enzyme Mix I 1.0 μL,4hRT Primer Mix 1.0 μL,加RNase free dH2O至20 μL。反应程序为:37 ℃ 15 min,85 ℃ 5 s。所得cDNA保存于-80 ℃待用。
采用SYBR Green qPCR方法定量检测相关代谢基因脂肪酸合成酶(fatty acid synthase,FASN)基因、脂肪酸转位酶(fatty acid translocase cluster determinant 36,CD36)基因、羟甲基戊二酸单酰辅酶A还原酶(hydroxymethylglutaryl-CoA reductase,HMGCR)基因、胆固醇7α-羟化酶(cholesterol 7α-hydroxy-lase,CYP7A1)基因以及节律时钟基因时钟昼夜节律调节器(clock circadian regulator,CLOCK)基因、脑和肌肉芳香烃受体核转运体样蛋白1(brain and muscle ARNT-like 1,BMAL1)基因引物序列如表3所示,内参基因为β-Actin。20 μL体系如下:SYBR Green Mix 10 μL,RT-Product 2 μL,正向引物(300 nmol/L)0.6 μL,反向引物(300 nmol/L)0.6 μL,ddH2O 6.8 μL。最后根据qPCR仪给出的Ct值采用相对定量法计算实验中目的基因mRNA的相对表达量。

表3 qPCR引物Table3 qPCR primers
1.4 数据统计分析
实验数据采用Graphpad Prism 6.0软件进行分析,检测结果以fs表示,统计学差异分析方法采用ANOVA的Tukey’s test方法,P<0.05表示有显著性差异。
2 结果与分析
2.1 虾青素干预对小鼠体质量、肝脏指数以及肥胖指数的影响
如图1所示,与CON组相比,HFD组的体质量高度显著增加(P<0.001)。AX组小鼠体质量与HFD组相比无明显差异。HFD组小鼠肝脏指数相较CON组高度显著增加(P<0.001),而AX组与HFD组相比高度显著降低(P<0.001)。HFD组肥胖指数比CON组高度显著增加(P<0.001),添加虾青素干预后,肥胖指数极显著降低(P<0.01)。上述结果表明,高脂饲喂导致了小鼠肥胖及肝脏肥大,使其脂肪沉积增加,而虾青素干预则可显著改善肝脏指数与肥胖指数。


图1 虾青素对小鼠体质量(A)、肝脏指数(B)与肥胖指数(C)的影响Fig.1 Effect of astaxanthin on body mass (A), liver index (B) and obesity index (C) in mice
2.2 虾青素干预对小鼠血脂水平及昼夜节律的影响
从图2可以看出,高脂/高胆固醇饲喂12 周后,小鼠血清主要血脂水平呈现总体升高趋势(HDL-C浓度下降),尤其以TC和LDL-C浓度升高显著,而经过虾青素干预后,高脂所致血脂异常得到显著改善。进一步观察血脂的昼夜节律变化情况,结果显示不同血脂指标在ZT0(早)、ZT12(晚)间呈现不同的变化规律且差异明显。

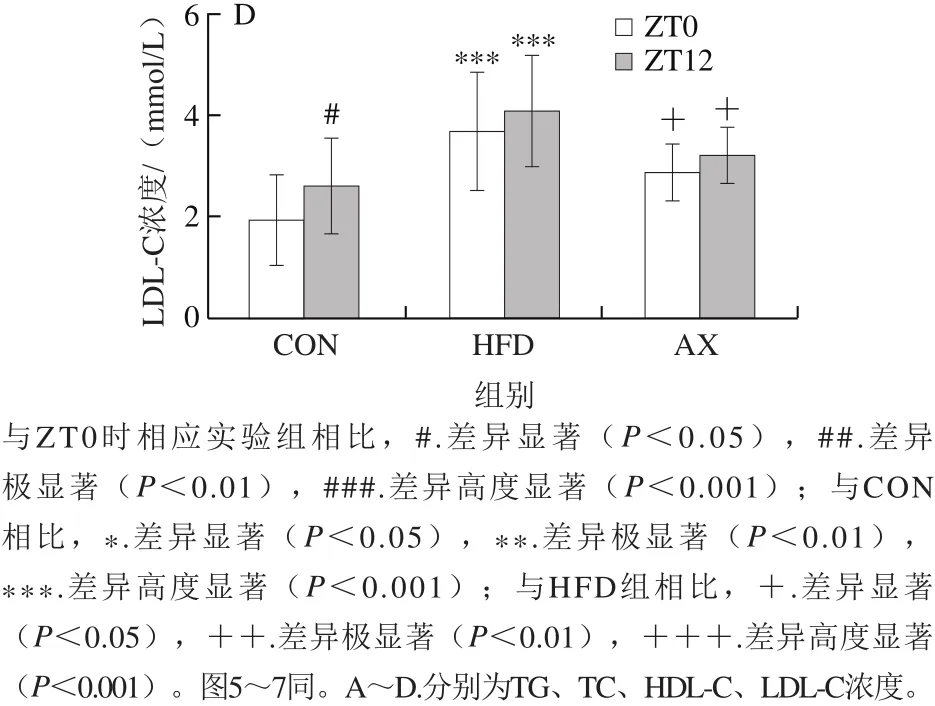
图2 小鼠血脂水平及昼夜节律变化Fig.2 Changes in blood lipid levels and circadian rhythm in mice
小鼠是夜间活动的动物,与人的昼夜节律相反。本实验中,ZT0是光照开始的时间,对应于小鼠夜间活动结束;ZT12是光照结束的时间,对应于小鼠休息结束的时间。图2显示,各组TG浓度在ZT0时均极显著高于ZT12时(P<0.01,P<0.001),呈现显著的早晚差异。ZT12时HFD组TG浓度高于CON组,但差异不显著,而AX组TG浓度均显著低于HFD组(P<0.05)。TC浓度的昼夜节律变化与TG浓度有所不同,各组在ZT0时TC浓度均略低于ZT12时,但无显著性差异。其中HFD组不管在ZT0时还是ZT12时均高度显著高于CON组,而AX组经虾青素干预后TC浓度明显恢复,并在ZT12时显著低于HFD组。LDL-C浓度的变化更为显著,CON组在ZT12时LDL-C浓度显著高于ZT0时(P<0.05),表明正常饲养时小鼠LDL-C浓度呈现典型的昼夜节律变化;在高脂饲养条件下,LDL-C浓度大幅升高,早晚间的差异消失,虾青素干预则显著降低了LDL-C浓度,但尚未恢复到正常水平和昼夜节律。HDL-C浓度的变化与LDL-C浓度相反,CON组在ZT0时高于ZT12时,HFD组在ZT0时高度显著降低,且昼夜节律消失,而虾青素干预可大幅提高HDL-C浓度。
总地来说,高脂饲喂导致小鼠肝脏血脂水平升高(HDL-C浓度除外),尤其是TC浓度升高明显,而虾青素干预可以有效降低TC和LDL-C浓度,升高HDL-C浓度,改善脂质的代谢。血脂的昼夜节律波动是正常的生理现象,反映了机体昼夜代谢活动的差异,高脂饲养条件下,脂代谢的负荷增加,打破了正常的脂质波动规律,呈现异常的血脂昼夜节律变化。推测虾青素干预能改善脂质代谢,部分恢复血脂水平和正常节律。
2.3 虾青素干预对高脂诱导的肝损伤的缓解作用
当肝细胞受到实质性损伤时,胞浆中的ALT与AST会被释放出来,导致其在血清中的活力上升。因此,血清中ALT、AST活力是衡量肝损伤的最佳特征标记。图3结果显示,与CON组相比,HFD组小鼠血清中ALT和AST活力均高度显著升高。AX组ALT、AST活力较HFD组极显著降低,但没有回落到CON组水平。表明HFD组小鼠存在显著的肝受损情况,添加虾青素干预则可显著缓解肝脏的损伤。
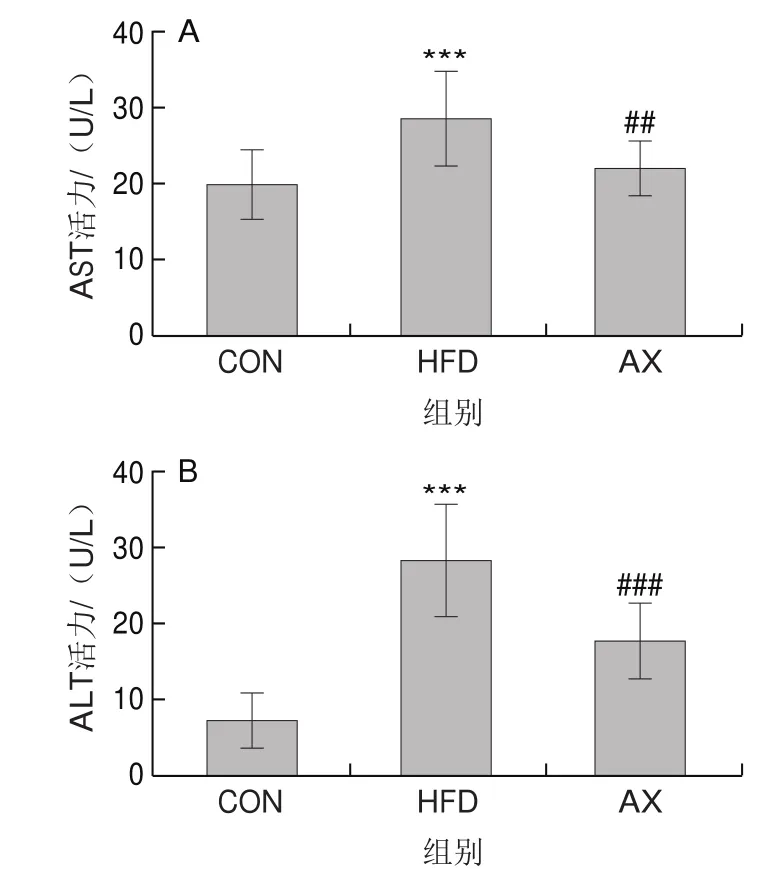
图3 小鼠血清AST(A)、ALT(B)活力Fig.3 Serum AST (A) and ALT (B) activity in mice
2.4 肝脏组织病理学变化分析

图4 小鼠肝脏组织HE染色结果Fig.4 HE staining of liver tissue in mice
如图4所示,HFD组小鼠肝叶细胞肿胀,大小不一的脂滴散布于胞质中,细胞核居边,细胞与细胞之间的界限模糊不清,肝窦狭窄,肝小叶内及汇管区有炎性细胞浸润。AX组脂肪变性与炎性浸润程度较HFD组都有相应减轻。
2.5 虾青素对肝脏脂代谢相关基因mRNA表达情况的影响
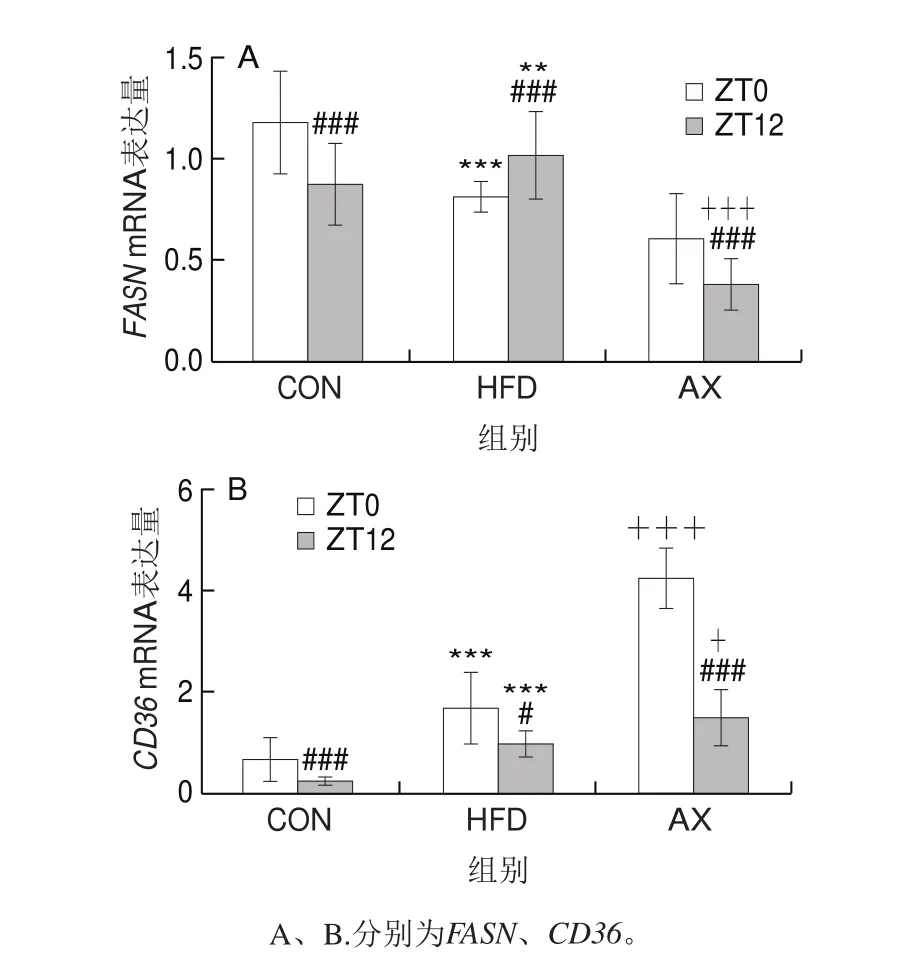
图5 肝脏脂代谢相关基因mRNA表达情况Fig.5 mRNA expression of hepatic lipid metabolism-related genes
如图5所示,FASN是内源性脂肪酸合成的限速酶,在控制脂肪酸合成中具有重要作用。CON组中FASN mRNA的表达存在显著的昼夜节律变化,即ZT0时(反映动物的活动状态)的mRNA表达量高度显著高于ZT12时(反映动物的休息状态)(P<0.001);而在高脂饲养条件下,FASN mRNA表达的节律变化发生显著改变,在ZT0时mRNA表达量极显著低于CON组(P<0.01),而在ZT12时反而高度显著高于CON组,反映了高脂饲养导致FASN mRNA表达及内源性脂肪酸合成节律的絮乱。经虾青素干预后,FASN mRNA的表达量恢复到正常节律特征(ZT0时高、ZT12时低),并均低于CON组的表达水平,表明添加虾青素干预后,FASN mRNA表达及其代表的内源性脂肪酸合成在ZT0和ZT12时同步受到抑制。
CD36是肝细胞上摄取脂肪酸的受体,其mRNA表达也呈现昼夜节律变化,其在ZT0时的表达量高于ZT12时。而HDF组CD36 mRNA的表达显著上调,早晚间的表达量差异缩小。虾青素干预则可同步增加CD36 mRNA在早晚的表达量。
上述结果表明,虾青素对改善高脂条件下内源性脂肪酸的合成和血液中脂肪酸的摄取有显著作用,同时其对高脂所致相关基因表达的节律紊乱有较好的保护作用。
2.6 虾青素干预对肝脏胆固醇代谢相关基因mRNA表达与节律变化的影响
如图6所示,HMGCR是胆固醇合成的关键酶,HMGCR节律表达特征与FASN和CD36完全不同,它主要以ZT12时(小鼠的休息时间)的表达为主。正常小鼠HMGCR mRNA水平在ZT12时高度显著高于ZT0时。HFD组HMGCR mRNA早晚的表达都高度显著降低,但以ZT12时为主,此时,胆固醇的合成受到显著抑制,早晚间的波动差距(幅度)减小。AX组有所恢复,但作用并不明显。

图6 肝脏胆固醇代谢相关基因mRNA表达与节律变化Fig.6 mRNA expression and circadian rhythm of hepatic cholesterol metabolism-related genes
CYP7A1是胆固醇氧化合成胆汁酸的关键酶,其表达的上调可促进肝脏胆固醇从胆汁中排出。CON组在ZT12时的CYP7A1 mRNA表达量极显著低于光照开始(ZT0)时,而HFD组则主要在ZT12时表达量升高,从而表现出与CON组相反的昼夜节律波动,AX组可以纠正这种波动异常,主要上调ZT0时的表达,与CON组相似。
2.7 虾青素对肝脏时钟基因mRNA表达量及昼夜节律的影响
生物钟核心转录因子CLOCK/BMAL1通过结合转录调控元件增强盒(enhancer-box,E-box)调控时钟基因的表达及昼夜节律变化。核心回路中,BMAL1和CLOCK在细胞核内形成异二聚体与PER和CRY基因启动子区的E-box结合,从而激活PER与CRY基因的转录。当PER与CRY在细胞质中的积累达到阈值,PER和CRY蛋白形成二聚体PER/CRY,进入细胞核竞争性抑制CLOCK/BMAL1二聚体与E-box结合从而抑制其转录,通过这种负反馈调节参与生理过程与生物钟的调控。
如图7所示,CON组CLOCK mRNA的表达存在显著的昼夜节律变化,ZT0时高度显著高于ZT12时(P<0.001)。高脂饲养条件下昼夜节律消失,在ZT0时HDF组高度显著低于CON组(P<0.001);而在ZT12时HFD组略低于CON组,但无显著性差异。CLOCK/BMAL1是生物体内相对保守的、以转录-翻译为基础的自身转录调节回路。有研究表明,BMAL1基因的绝对表达量低于CLOCK基因,所以BMAL1基因的mRNA表达调控着CLOCK/BMAL1异二聚体含量[19]。BMAL1基因的表达存在着显著的昼夜节律,光照开始时(ZT0),HFD组极显著低于CON组,经虾青素干预后BMAL1 mRNA表达量得到高度显著恢复(P<0.001);在光照结束时(ZT12)BMAL1 mRNA表达量高度显著低于光照开始(ZT0),且各组间mRNA表达量趋于一致,且无显著差异。高脂饲养条件下,BMAL1 mRNA表达量昼夜节律振幅降低,虾青素干预能改善高脂所致的节律异常。
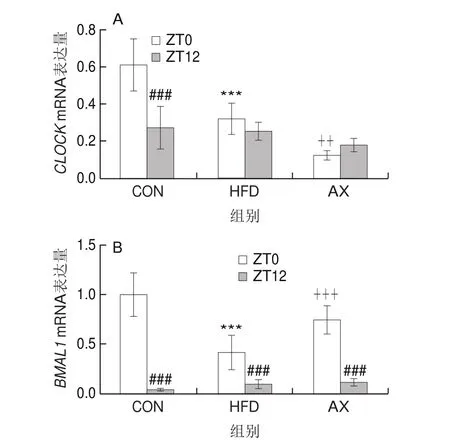
图7 生物钟核心转录因子CLOCK(A)、BMAL1(B)mRNA表达与节律变化Fig.7 mRNA expression and rhythmic changes of biological clock core transcription factor CLOCK (A) and BMAL1 (B)
3 讨 论
目前关于NAFLD发病机制的研究已取得非常大的进展,“二次打击”(肝脂肪变性所形成的“初次打击”及细胞内氧化应激等导致的“二次打击”)学说已被普遍认同[5]。高脂/高胆固醇饮食会引起显著的脂质积累和氧化应激,并可能诱发NAFLD等多种慢性代谢疾病[20-21]。虾青素是天然的抗氧化剂[22],能改善高脂饮食所致的肝脏氧化应激状态和脂质过氧化[23-24],从而打破高脂小鼠的肝脏氧化应激和末端激酶激活的恶性循环[25]。本研究结果显示,饲喂12 周后HFD组小鼠体质量、肝脏指数和肥胖指数均显著增加,虾青素干预能显著抑制高脂/高胆固醇饮食诱导的肝脏指数、肥胖指数的增加。虾青素还能降低小鼠肝脏TC和LDL-C浓度,提高HDL-C浓度,降低ALT、AST活力,从而降低血脂水平,缓解肝脏的损伤。在代谢途径上,检测结果显示虾青素能降低脂肪酸合成限速酶FASN的表达,抑制脂肪酸的合成,此外,虾青素也能降低胆固醇合成关键酶HMGCR在肝脏中的表达,减少内源性胆固醇的合成,同时提高CYP7A1的表达,促进胆固醇氧化生成胆酸,促进胆固醇的分泌与排出[26]。有研究显示,虾青素可诱导肝组织ATP结合盒转运蛋白A1/G1的表达,从而增强了载脂蛋白A-1/HDL介导的肝X受体(liver X receptor,LXR)非依赖性巨噬细胞胆固醇流出[27]。这与本实验观察到AX组小鼠HDL-C浓度显著高于CON组与HFD组相印证。
哺乳动物的代谢活动具有明显的节律特点,肝脏作为外周时钟系统的主要器官控制组织的代谢节律[25,28]。核心节律转录因子CLOCK和BMAL1及其靶基因PER和CRY构成自反馈调节机制,PER和CRY基因表达产物又反馈抑制CLOCK-BMAL1复合物,抑制其自身的表达[29]。核心回路与代谢相关核受体相连接,通过核受体亚家族1 D组成员1(nuclear receptor subfamily 1 group D member 1,REV-ERBα)[19]、维甲酸相关孤核受体α(retinoid-related orphan receptor α,RORα)[30]及过氧化物酶增殖体激活受体α(peroxisome proliferators-activated receptor α,PPARα)[31-32]调节代谢。REV-ERBα和RORα既可以反馈调节核心节律分子的表达,也可以影响胰岛素诱导因子2(insulin-induced gene 2,INSIG2)的表达,促进了固醇调节元件结合蛋白(sterol-regulatory element binding proteins,SREBPs)的激活[30,33]。SREBPs决定着胆固醇和脂肪酸合成中具有关键功能的酶的节奏表达[34]。有研究显示,SREBP2调控HMGCR的循环转录,胆固醇节奏性的产生可以引起LXR核受体的循环激活,其作为CYP7A1转录的关键激活剂催化胆汁酸合成中的限速步骤,受核因子法尼酯X激活受体/小异二聚体伴侣途径的调控,后者也同时受REV-ERBα的调节[35]。因此,节律循环通过核受体介导调节脂肪酸与胆固醇的合成与代谢,从而改善脂质代谢。本研究中,高脂/高胆固醇饲喂导致小鼠脂代谢负荷增加的同时,也破坏了正常的脂质波动规律,虾青素干预能够缓解或修正由高脂导致的生物钟节律相关基因CLOCK和BMAL1以及肝脏早晚脂质和胆固醇代谢相关基因昼夜节律表达的紊乱。文献[36]报道,虾青素是PPARα的激动剂,PPARα可以通过与BMAL1和REV-ERBα的启动子区域PPAR反应元件结合,调节BMAL1与REV-ERBα的转录[37],此外,PPARα通过促进INSIG2的表达抑制SREBPs的活化[38]。这与本实验中观察到的HFD组BMAL1 mRNA表达量显著低于CON组,虾青素干预后极显著恢复相似。通过这一证据可以推测,虾青素对生物钟的调节作用也许与虾青素能增强PPARα的活力有关。
本实验研究了虾青素对NAFLD的干预作用,并观察了虾青素对高脂所致节律紊乱的改善作用。为进一步研究虾青素的营养干预及其节律调节作用提供了依据。

