不同几何构型虾青素的体外抗氧化作用及对秀丽隐杆线虫氧化应激的保护作用
刘 涵,陈晓枫,刘晓娟,*,贺丽苹,3,曹 庸
(1.华南农业大学食品学院,广东 广州 510642;2.广东省功能食品活性物重点实验室,广东 广州 510642;3.华南农业大学测试中心,广东 广州 510642)
虾青素是一种酮式类胡萝卜素,广泛存在于藻类、虾类、蟹类、贝类、鱼类等食物中,是类胡萝卜素中近些年来备受关注的“超级抗氧化剂”,同时还具有抗衰老、抗肿瘤、提高机体免疫力等多种生物学功能,广泛应用于食品、保健品、医药、化妆品等领域[1-3]。虾青素分子的线性部分含有多个双键,每个双键都可以是顺式或反式,因此虾青素有全反式、9-顺式、13-顺式、15-顺式、9,13-顺式、13,15-顺式、9,15-顺式和9,13,15-顺式等多种几何异构体,其中全反式结构因空间位阻最小而最稳定(图1)。自然界中的虾青素大部分以全反式结构为主,但在食品加工/贮藏过程(加热或光照)中或受环境因素(高压、有机溶剂、金属离子等)影响会异构化为其顺式异构体,主要异构化为9-顺式和13-顺式异构体[4-6]。不同几何构型虾青素对动物和人体健康是否有不良影响目前尚无定论[7]。因此,自然界中的虾青素以不同几何构型存在,有必要明确其不同的生物学活性。
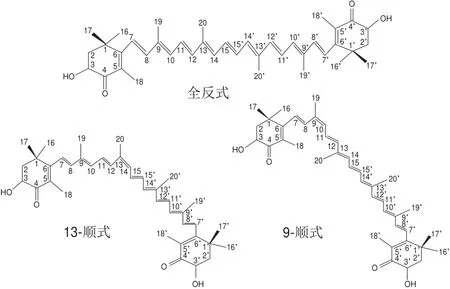
图1 3 种常见的虾青素几何异构体结构Fig.1 Structures of three common geometric isomers of astaxanthin
目前,国内外学者对于不同几何构型虾青素的抗氧化活性开展了一些研究。Liu Xuebo等利用清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、红细胞模型、大鼠微粒体模型、亚油酸模型以及人神经母细胞瘤SH-SY5Y模型等方法,比较了全反式、9-顺式和13-顺式虾青素的抗氧化活性,提出了虾青素顺式构型尤其是9-顺式的抗氧化活性最强[8]。金兴江等比较了不同构型虾青素清除DPPH自由基、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基和超氧阴离子自由基(O2-·)的能力,发现9-顺式虾青素清除DPPH自由基和ABTS自由基能力最强,13-顺式虾青素清除O2-·的能力更优[9]。孙伟红的研究表明,13-顺式虾青素对DPPH自由基的清除能力和还原力最强,9-顺式虾青素对二十二碳六烯酸(docosahexaenoic acid,DHA)过氧化的抑制作用最强[10]。因此,目前对于不同几何构型虾青素的抗氧化活性还存在一定的争议,有必要进一步对不同几何构型虾青素的抗氧化活性进行深入研究。秀丽隐杆线虫(Caenorhabditis elegans)由于具有廉价、易培养、生命周期短、全基因组序列明确、与人类基因同源性高等优点,成为抗氧化、延缓衰老研究首选的模式生物[11-14]。本实验采用体外(DPPH自由基、ABTS自由基和氧化自由基吸收能力(oxygen radical absorbance capacity,ORAC))和体内(秀丽隐杆线虫模型)相结合的方法,进一步开展不同几何构型虾青素的抗氧化和对氧化应激损伤影响的研究,揭示虾青素构效关系,为人们合理食用富含虾青素的食品或保健品提供指导。
1 材料与方法
1.1 材料与试剂
野生型秀丽隐杆线虫(the Bristol strain N2),雌雄同体,由北京市生命科学研究院惠赠;大肠杆菌(Escherichia coli)OP50由华南农业大学资源环境学院惠赠,OP50为尿嘧啶合成缺陷菌株。
全反式虾青素由广东巨元生化有限公司惠赠,纯度为(97.0f0.5)%;9-顺式和13-顺式虾青素由全反式虾青素通过碘光照法转化而成,再经过制备液相色谱分离纯化得到纯度大于95%的单一顺式构型。DPPH、ABTS、荧光素钠(fluorescein,FL)试剂、水溶性VE(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)(纯度≥97%)、2,2’-偶氮二异丁基脒二盐酸(2,2’-azobis(2-amidinopropane)dihydrochloride,AAPH)、二氯百草枯(paraquat,PQ)和2,7-二氯二氢荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,H2DCF-DA) 美国Sigma-Aldrich有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
AL 104电子天平 梅特勒-托利多仪器(上海)有限公司;Enspire2300多功能酶标仪 美国PE公司;UV3010紫外-可见分光光度计 日本日立集团;L530型台式低速离心机 湖南湘仪实验室仪器开发有限公司;HZQ-C水浴振荡器 常州澳华仪器厂;LRH生化培养箱上海申生科技有限公司;SMZ-T4连续变倍体视显微镜重庆奥特光学仪器有限公司;LC-8A制备型高效液相色谱(high performance liquid chromatography,HPLC)日本岛津公司;LC-15C分析型HPLC 日本岛津公司;1290-6540 HPLC-大气压化学电离质谱(atmospheric pressure chemical ionization-mass spectrometers,APCI-MS)美国安捷伦公司;R204B3旋转蒸发器 上海申生科技有限公司。
1.3 方法
1.3.1 顺式虾青素的制备、构型鉴定和纯度检测
1.3.1.1 碘光照法进行全反式虾青素的顺式转化
将全反式虾青素溶于2 000 mg/L二氯甲烷,并配制0.6 mg/mL的碘-二氯甲烷溶液,将两种溶液按照1∶2(V/V)比例混合。距40 W日光灯60 cm处照射60 min,然后将1 mol/L硫代硫酸钠溶液以体积比1∶1加入溶液中,搅拌后静置5 min,去除上清液,重复1 次,去除多余的碘。剩余溶液在避光条件下,25 ℃旋转蒸发浓缩至20 mL,氮吹至干,-20 ℃保存。选择制备液相色谱对不同顺式虾青素进行分离,液相色谱条件如下:制备液相色谱柱为PRC-ODS(K)柱(250 mmh30 mm,15 μm),流动相为甲醇-乙腈-二氯甲烷(体积比14∶1∶1)(A)、纯水(B),洗脱时A泵比例为90%,B泵为10%,运行时间120 min。将前期转化好的样品用甲醇溶解,制成25 mg/mL的溶液,过0.22 μm的有机滤膜后进样,进样量为1 mL。分别收集55 min和58 min的样本,通过分析液相色谱检测其纯度。
1.3.1.2 顺式虾青素的构型鉴定
将碘光照后的样品,配制成一定的浓度,利用HPLC-APCI-MS鉴定HPLC图各峰对应的一级MS图。同时采用HPLC-二极管阵列检测器(HPLC photo-diode array,HPLC-PDA),测定HPLC图上不同时间的峰对应的电子吸收光谱。
1.3.1.3 顺式虾青素的纯度鉴定
选择HPLC法对顺式虾青素进行检测,分析柱为Diamonsil C18柱(250 mmh4.6 mm,5 μm),检测器为PDA,流动相为甲醇-乙腈-二氯甲烷-水(体积比85∶5∶5∶5),柱温25 ℃。流速1 mL/min,进样量20 μL。
1.3.2 不同几何构型虾青素体外抗氧化活性测定
1.3.2.1 DPPH自由基清除能力的测定
DPPH自由基清除能力的测定参照文献[15]。将9-顺式、13-顺式和全反式虾青素用无水乙醇分别配制成质量浓度100、80、60、40、20、10 μg/mL的样品溶液。测定时,在96 孔板中加入2h10-4mol/L的DPPH乙醇溶液100 μL,然后再分别加入不同质量浓度的样品溶液100 μL,摇匀后,室温黑暗处放置30 min,测定517 nm波长处的吸光度At。同时,测定100 μL样品溶液+100 μL乙醇溶液在517 nm波长处的吸光度Ar,再测定100 μL DPPH溶液+100 μL乙醇在517 nm波长处的吸光度A0。同一测定设计3 个平行,DPPH自由基清除率按式(1)计算。
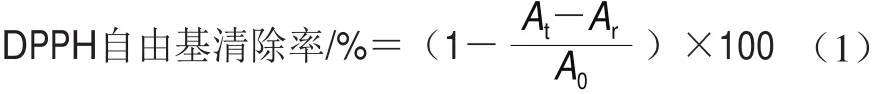
1.3.2.2 ABTS自由基清除能力的测定
ABTS自由基清除能力的测定参照文献[16]。将5 mL 7 mmol/L ABTS和88 μL 140 mmol/L过硫酸钾混合,室温、避光条件下静置过夜(12 h),制成ABTS储备液。该储备液在室温、避光的条件下稳定,使用前用无水乙醇稀释成工作液,使其在30 ℃、734 nm波长处的吸光度为0.70f0.02。
将9-顺式、13-顺式和全反式虾青素用无水乙醇配制成质量浓度100、80、60、40、20、10 μg/mL的样品溶液。测定时,在96 孔板中加入ABTS工作液100 μL,然后再分别加入不同质量浓度的样品溶液100 μL,振荡混匀,10 min后测定其在734 nm波长处的吸光度At,以100 μL ABTS工作液+100 μL无水乙醇作空白(吸光度记为A0),测定100 μL样品溶液+100 μL无水乙醇吸光度Ar。同一测定设计3 个平行,ABTS自由基清除率按式(2)计算。
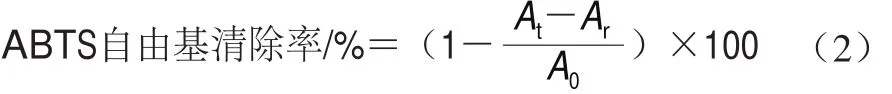
1.3.2.3 ORAC的测定
ORAC的测定参照文献[17]。精密吸取FL稀释液(8.4h10-8mmol/L)100 µL于96 孔荧光板中,再加入100 µL甲醇,以激发波长490 nm、发射波长514 nm进行测定并记录荧光值(记为A0)。在96 孔板上加入FL稀释液100 µL,再加入不同浓度的Trolox溶液50 µL,振荡,37 ℃温育10 min后迅速加入50 µL AAPH液启动反应。反应过程中每隔2 min(Δt)测定一次荧光值(记为An)。直至荧光值衰减至直线。按式(3)计算荧光衰退曲线下的面积(area under curve,AUC),按式(4)计算保护面积(Net AUC),以Trolox溶液浓度为横坐标,以Net AUC为纵坐标,绘制标准曲线。

精密称取2.000 mg 9-顺式、13-顺式和全反式虾青素,用甲醇溶解,配制成5 μg/mL的样品溶液,按上述方法进行测定与计算,同一测定设计3 个平行。ORAC以每克样品等同Trolox的物质的量来表示。
1.3.3 不同几何构型虾青素对秀丽隐杆线虫氧化应激损伤的影响
1.3.3.1 秀丽隐杆线虫的培养和同期化
将秀丽隐杆线虫放置在涂有大肠杆菌OP50的线虫生长培养基(nematode growth medium,NGM)上,在生化培养箱中(温度20 ℃,相对湿度40%~60%)培养。采用高氯酸钠裂解法对秀丽隐杆线虫进行同期化[18]。用1 mL M9缓冲溶液将NGM平板上年轻成虫充分冲洗,转移至2 mL无菌EP管中,加入1 mL现配裂解液,充分振荡5~10 min后,在低速离心机上以3 000 r/min离心1 min,弃上清液,再用1 mL M9缓冲液冲洗线虫以同样条件离心2 次,弃上清液,余下0.3~0.4 mL后混匀缓冲液和虫卵,用移液枪吸取EP管底部液体滴于NGM平板边缘的无菌区,后稍倾斜平板旋转一周。约48 h后线虫受精卵基本发育成L4期幼虫,完成同期化。
1.3.3.2 PQ诱导氧化应激损伤条件下线虫存活率检测
9-顺式、13-顺式和全反式虾青素用二甲基亚砜配制成0.16 mmol/L,取95 μL E. coli OP50菌液和5 μL二甲基亚砜混合均匀,涂布在NGM上。经药物处理96 h后,分别从药物组和对照组将线虫挑入96 孔板中,每孔3 只,每组3 孔,每组重复做3 次。每个孔预先加入100 μL M9缓冲液(含E. coli OP50菌液,PQ浓度为10 mmol/L),每隔24 h记录线虫生存、死亡数,直至线虫全部死亡。线虫死亡标准为用铂金丝轻触虫体时,无任何反应[19]。
1.3.3.3 PQ诱导氧化应激损伤条件下线虫活性氧检测
经药物处理96 h后,分别从药物组和对照组将线虫挑入96 孔板中(每孔80 条,3 个平行),加入100 μL M9缓冲液(含E. coli OP50菌液,PQ浓度为10 mmol/L)处理24 h后,加入50 μL用M9缓冲液配制的100 μmol/L的H2DCF-DA溶液;用50 μL不含线虫的H2DCF-DA溶液和50 μL M9缓冲液作为空白对照。立即将96 孔板放入酶标仪中测定荧光强度,反应温度25 ℃,发射波长528 nm、激发波长485 nm[20]。每隔20 min测定一次,反应6 h,每次读数前振荡。
1.4 数据处理
实验均采用3 次平行处理,数据均采用平均值±标准差表示,采用SPSS 17.0统计软件进行数据处理,不同处理组之间的差异用多重比较分析(Duncan)单因素方差分析(One-way analysis of variance,One-way ANOVA)进行处理,P<0.05表示差异显著。
2 结果与分析
2.1 虾青素几何构型的鉴定和纯度检测
对于虾青素几何构型的鉴定,国内外普遍采用HPLC-APCI-MS和Q值进行鉴定[9,21]。
2.1.1 通过HPLC-APCI-MS鉴定各峰分子质量
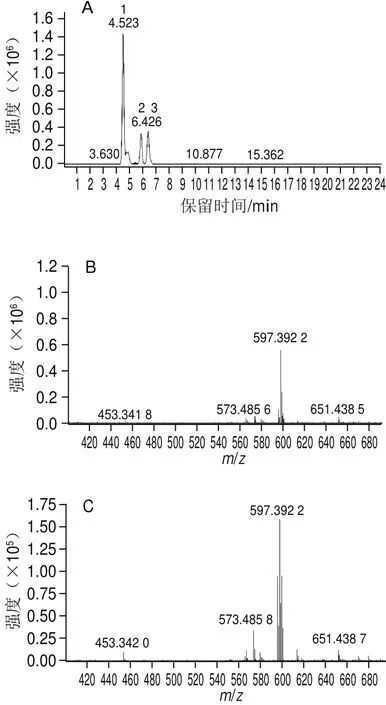
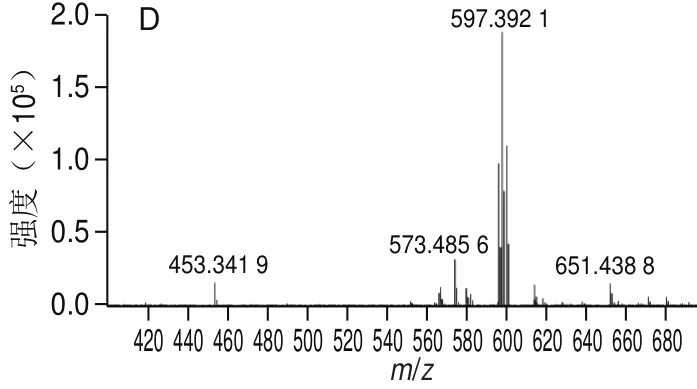
图2 反式虾青素碘光照处理后的高效液相色谱图(A)以及1号峰(B)、2号峰(C)和3号峰(D)对应的高效液相色谱-质谱图Fig.2 High performance liquid chromatograms of all-trans astaxanthin after iodine-light treatment (A) and high performance liquid chromatography-mass spectrometric analysis of peak 1 (B), 2 (C) and 3 (D)
采用碘光照法对全反式虾青素进行顺式转化,转化后的液相色谱图如图2A所示,1号峰为全反式虾青素,2号峰和3号峰为转化后出现的两个新峰。分别对图2A中的3 个峰进行液相色谱-质谱检测,从图2B~D可以看出,1、2、3号峰的质荷比(m/z)均约为597.39,即3 个峰的分子质量均与虾青素有相同的质荷比,从而推断这3 种物质为虾青素的同分异构体。
2.1.2 Q值的检测
利用PDA检测器,可以看到不同峰在一定波长范围内的吸光度变化。一般顺式异构体的溶液在电子吸收光谱中除了主要的吸收峰外,还会在300~400 nm波长处出现一吸收峰,被称之为“顺式峰”,顺式峰的吸光度与主峰的吸光度的比值定义为Q值,根据Q值来判断虾青素的几何构型。图3A~C分别为1、2、3号峰的PDA扫描图,由图3A可以看出,1号峰(已知为全反式虾青素),最大吸收波长在470 nm左右,该波长为虾青素的最大吸收波长。图3B、C中,2号峰和3号峰的最大吸收波长也在470 nm,并且存在顺式峰。计算1、2、3号峰对应的Q值,分别为0.09、0.11和0.55。Q值越大,发生在C链中间异构的概率越大。因此,判断1、2、3号峰分别为全反式、9-顺式和13-顺式虾青素。
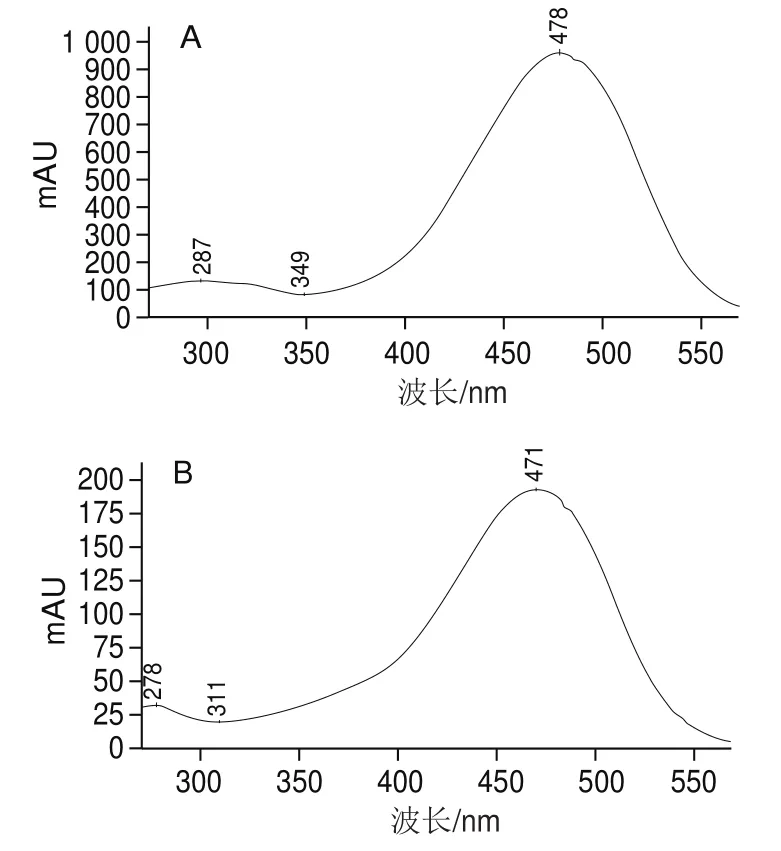
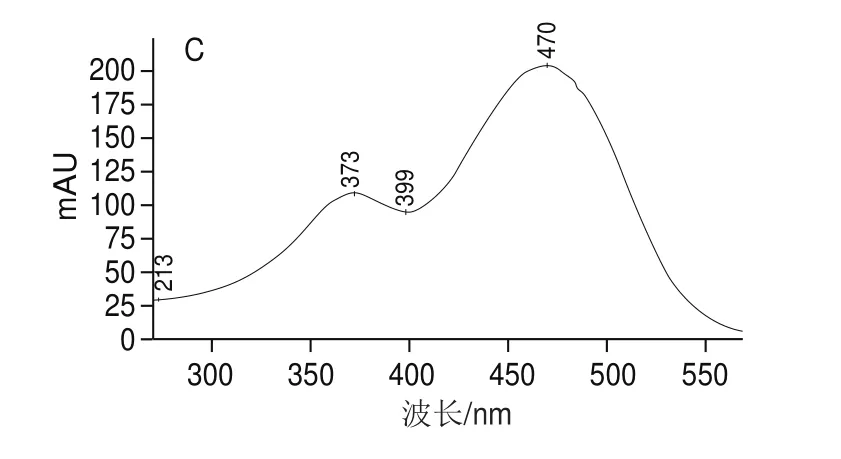
图3 1号峰(A)、2号峰(B)和3号峰(C)电子吸收光谱图Fig.3 Electronic absorption spectra of peak 1 (A), 2 (B) and 3 (C)
2.1.3 分离制备的顺式虾青素的纯度检测
不同几何构型虾青素的分离纯化主要通过制备液相色谱来实现,从制备液相色谱中获得对应峰的样品,经过萃取、旋转蒸发和冷冻干燥,得到纯度较高的9-顺式和13-顺式样品,纯度分别达到95%和90%(图4)。
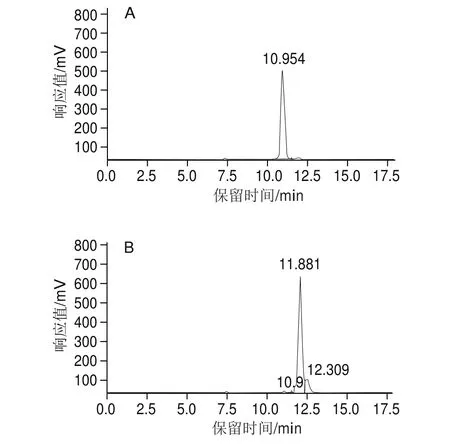
图4 9-顺式(A)和13-顺式(B)虾青素高效液相色谱图Fig.4 High performance liquid chromatograms of 9-cis (A) and 13-cis (B) astaxanthin
2.2 不同几何构型虾青素的体外抗氧化活性
2.2.1 DPPH自由基清除能力
从图5A可以看出,9-顺式、13-顺式和全反式虾青素对DPPH自由基的清除率都随着质量浓度的增大而提高,虾青素在质量浓度20~100 μg/mL范围内,9-顺式对DPPH自由基清除率质量浓度高于13-顺式和全反式。从图5B来看,不同几何构型虾青素清除DPPH自由基的半抑制浓度(half maximal inhibitory concentration,IC50)没有显著区别,从而表明不同几何构型虾青素在清除DPPH自由基能力方面没有显著性差异(P<0.05)。
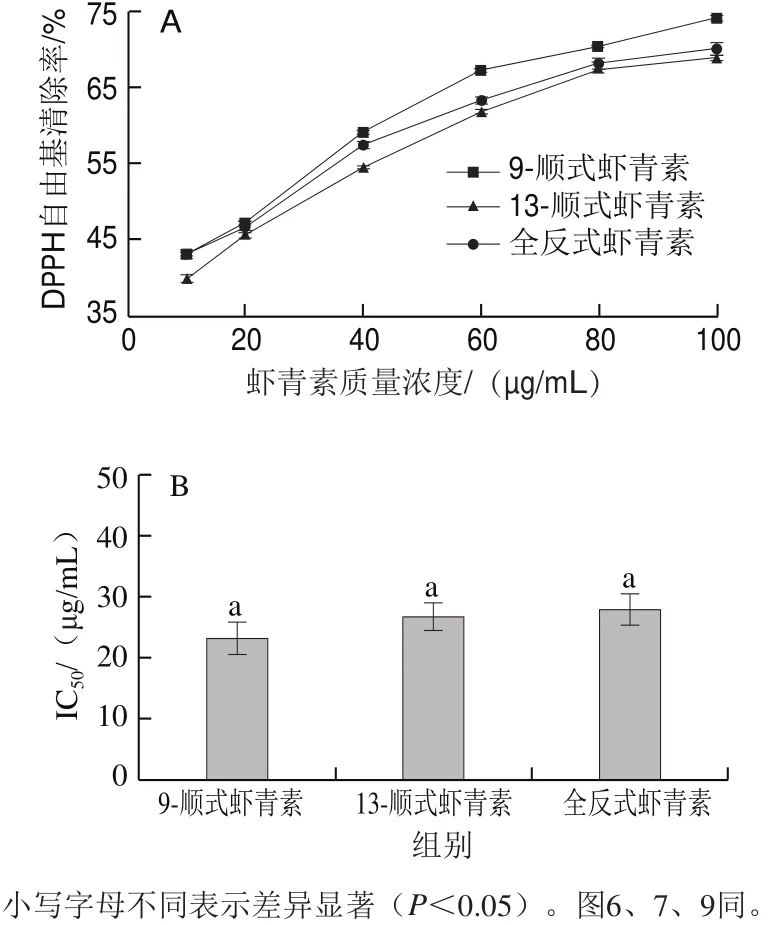
图5 不同几何构型虾青素DPPH自由基清除率(A)和IC50(B)Fig.5 DPPH radical scavenging capacity (A) and IC50 (B) of different geometric isomers of astaxanthin
2.2.2 ABTS自由基清除能力

图6 不同几何构型虾青素ABTS自由基清除率(A)和IC50(B)Fig.6 ABTS radical scavenging capacity (A) and IC50 (B) of different geometric isomers of astaxanthin
从图6A可以看出,9-顺式、13-顺式和全反式虾青素对ABTS自由基的清除率都随着质量浓度的增大而提高,不同几何构型虾青素质量浓度在20~100 μg/mL范围内清除ABTS自由基能力的顺序为:9-顺式>13-顺式>全反式。比较不同几何构型虾青素清除ABTS自由基的IC50,从图6B可以看出,9-顺式虾青素清除ABTS自由基的IC50(26.14 μg/mL)显著低于13-顺式(43.81 μg/mL)和全反式虾青素(39.77 μg/mL)(P<0.05)。
2.2.3 ORAC结果
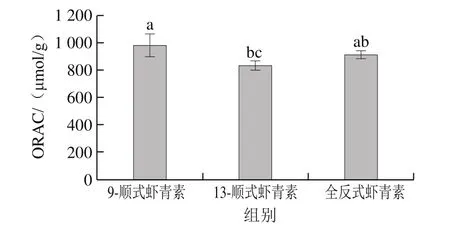
图7 不同几何构型虾青素的ORACFig.7 Oxygen radical absorbance capacity of different geometric isomers of astaxanthin
根据Trolox标准曲线y=0.077x-1.031(R2=0.990)计算不同几何构型虾青素的ORAC,由图7可以看出,3 种不同几何构型虾青素的总抗氧化能力的顺序为:9-顺式>全反式>13-顺式,其中9-顺式的ORAC(990.81 μmol/g)显著高于13-顺式(830.72 μmol/g)(P<0.05),与全反式虾青素处理组之间无明显差异(P>0.05)。
目前,主要通过化学方法来评价类胡萝卜素的体外抗氧化活性。虾青素分子结构和其他类胡萝卜素一样具有共轭双键长链,并且它的共轭双键链末端还有不饱和的酮基和羟基,构成α-羟基酮,这些结构都具有较活泼的电子效应,能向自由基提供电子或吸引自由基,从而清除自由基[22]。因此,大部分类胡萝卜素的体外抗氧化评价方法是以清除自由基为基础的,如DPPH法、ABTS法、ORAC法等[23]。本研究采用以清除自由基为基础的3 种方法对不同几何构型虾青素体外抗氧化活性进行综合评价。结果表明,在清除DPPH自由基方面,3 种不同几何构型之间均没有显著差异(P>0.05);在清除ABTS自由基方面,9-顺式虾青素显著高于13-顺式和全反式虾青素(P<0.05);在ORAC方面,9-顺式虾青素显著高于13-顺式(P<0.05),13-顺式虾青素和全反式虾青素之间没有显著差异(P>0.05)。3 种评价方法结果存在差异,可能是因为不同评价方法的作用原理不同:在DPPH方法中,当氢原子或电子被转移到带奇数电子的DPPH自由基中,会形成非自由基型DPPH-H,DPPH自由基在517 nm波长处的吸光度会随着DPPH-H的形成而成比例减少[24];ABTS自由基比DPPH自由基活性高,自由基的变化主要涉及电子转移过程[25];ORAC法模拟了体内环境中抗氧化物与自由基反应的情况,表示的是抗氧化物在特定的生理pH值下对生物化学自氧化产生的氧自由基的抑制作用,ORAC实验反应过程是一个经典的氢原子转移的氧化过程[26]。
2.3 不同几何构型虾青素对秀丽隐杆线虫氧化剂应激的影响
2.3.1 不同几何构型虾青素对PQ诱导氧化损伤线虫存活率的影响
氧化损伤被认为是许多疾病及衰老过程的一个主要病理、生理学因素,机体的过氧化是由于活性氧(reactive oxygen species,ROS)和抗氧化防御系统之间的不平衡所导致的,过量ROS容易损害脂质、蛋白质以及DNA等细胞大分子,从而破坏细胞的完整性和功能[27]。过氧化可诱导产生病理性蛋白聚合物,从而诱发各种神经变性疾病,如帕金森病和阿尔茨海默病;过氧化会引起基因组突变,被认为是肿瘤发生的重要原因;另外,过氧化还会引起线粒体损伤[28]。近年来,秀丽隐杆线虫在研究氧化诱导损伤方面已成为重要的模式生物。
采用PQ处理秀丽隐杆线虫来模拟内源性的氧化应激损伤。PQ进入线虫体内,消耗大量的NADPH,使NADPH参与的生化反应不能正常进行,竞争性抑制干扰呼吸链的电子传递,影响氧化磷酸化,一些电子与分子氧作用形成O2-·,O2-·很快被超氧化物歧化酶转化成H2O2,后者被过氧化氢酶转化成H2O。此外,H2O2也可以自由地在线粒体和细胞质之间自由扩散,形成羟自由基(·OH)和氢氧根离子(OH-)等更多的自由基,进而导致氧化应激损伤[19]。当线虫体内的抗氧化酶不足以抵抗内源性或外源性的氧化应激损伤时,需要加入外源的抗氧化剂来辅助机体对抗过多的ROS。因此,本实验以PQ为诱导剂,将正常培养96 h后的处理组和对照组进行处理,模拟氧化损伤环境,记录经PQ处理后各组秀丽隐杆线虫的存活数,计算其存活率。

图8 不同几何构型虾青素对PQ氧化损伤后线虫存活率的影响Fig.8 Effects of different geometric isomers of astaxanthin on the survival rate of Caenorhabditis elegans under oxidative damage induced by PQ
如图8所示,不同处理组中秀丽隐杆线虫的存活率都随着时间的延长而降低,与对照组相比,9-顺式、13-顺式和全反式虾青素均能显著提升线虫在不同时间的存活率(P<0.05),但三者之间对线虫存活率的提升不存在显著差异(P>0.05)。
2.3.2 不同几何构型虾青素对PQ诱导氧化损伤线虫体内ROS积累量的影响
过剩的ROS是衰老的主要原因,在氧化损伤环境下,秀丽隐杆线虫细胞线粒体电子传递链会产生大量的ROS,线虫体内ROS的积累量与荧光物质2’,7’-二氯荧光素的生成量成正比。实验测定了3 种几何构型虾青素和对照组经PQ诱导氧化损伤后线虫体内ROS的积累量。

图9 不同几何构型虾青素对PQ氧化损伤后线虫体内ROS积累量的影响Fig.9 Effects of different geometric isomers of astaxanthin on ROS accumulation in Caenorhabditis elegans under oxidative damage induced by PQ
如图9所示,与对照组相比,9-顺式虾青素组和全反式虾青素组线虫体内的ROS积累量显著下降(P<0.05),分别下降了56.05%和15.07%。9-顺式虾青素组对体内的ROS积累量的降低与全反式虾青素组和13-顺式虾青素组相比均有显著差异(P<0.05)。9-顺式虾青素在氧化诱导损伤线虫存活率方面高于13-顺式和全反式,可能与9-顺式虾青素具有较强的清除线虫体内ROS积累量有关。
综合体外抗氧化实验和对秀丽隐杆线虫氧化应激损伤的保护作用,9-顺式虾青素的活性显著高于全反式和13-顺式虾青素。然而,目前还没有一种确切的机制来解释它们之间存在抗氧化和改善氧化应激损伤差异的原因。根据量子化学的前线轨道理论,分子参与反应最先起作用的是前线轨道,即分子中的最高电子占有分子轨道和最低空分子轨道。能量差是分子稳定性的重要指标,差值越大,分子稳定性越强。反之,分子越不稳定,越易参与化学反应[29]。Levin等的研究显示,9-顺式β-胡萝卜素的能量差更大,因此更易与自由基发生反应[30]。因此推断9-顺式虾青素比其他两种几何构型虾青素的能量差更大,更容易起到抗氧化作用。在一个关于虾青素口服药代动力学的研究中发现,人类的血液会选择性地吸收较多的顺式虾青素,但却有较多的全反式虾青素在极低密度脂蛋白和酪氨酸微粒中显著分布[31]。
3 结 论
研究表明,9-顺式虾青素在体外清除ABTS自由基和ORAC及保护秀丽隐杆线虫氧化应激损伤方面,都显著优于13-顺式虾青素和全反式虾青素,13-顺式虾青素和全反式虾青素的抗氧化和对氧化应激的保护作用差异不显著。关于不同构型虾青素抗氧化活性存在差异的机理目前还未明确,还有待于进一步采用细胞模型和动物模型开展深入研究,研究结果对于阐明不同构型虾青素的构效关系提供了重要资料,为人们合理食用富含虾青素类食品提供指导。

