不同包装方式下冷鲜青虾的菌群多样性分析
吴海虹,孙芝兰*,张新笑,刘 芳,徐为民
(江苏省农业科学院农产品加工研究所,江苏 南京 210014)
青虾,又名河虾,广泛分布于淡水水域,是一种高蛋白、低脂肪、营养价值极高的水产食品,颇受消费者青睐。然而,其水分和蛋白质含量较高,在捕捞、运输、加工及贮藏过程中极易受细菌侵袭而腐败变质[1-4],不能适应市场流通销售的需要。气调包装技术已在生鲜食品的保鲜包装中广泛应用[5-8],励建荣等[9]研究气调包装对冷藏鱼糜制品品质的影响,得出体积分数50% CO2+50% N2的气调包装比真空包装和空气包装更有利于抑制鱼丸中微生物的生长和延长鱼丸的货架期,蓝蔚青等[10]认为体积分数80% CO2+20% N2的气调处理可将鲳鱼样品的冷藏货架期延长至6~12 d,且发现气调包装与低温结合可以显著延长水产品的货架期。
虾在养殖、运输及贮藏过程中污染微生物的种类复杂,导致其菌落结构呈现出多样性。曹荣[11]、李蕾蕾[12]等研究了对虾在贮藏过程中微生物菌相的变化,发现贮藏初期主要以假单胞菌和气单胞菌为主,在冷藏后期希瓦氏菌的比例大大增加;但是青虾在贮藏过程中微生物的菌群变化尚缺乏相关研究。因此研究不同包装方式下青虾的菌群结构及变化规律可为合理使用不同的保鲜技术提供理论依据。16S rDNA扩增子测序通常选择某个或某几个变异区域,利用保守区设计通用引物进行聚合酶链式反应(polymerase chain reaction,PCR),然后基于HiSeq 2500 PE250平台对高变区进行测序分析和菌种鉴定,测序深度高,更有利于低丰富群落物种的鉴定和提高微生物群落研究的完整性,可成为研究微生物群落多样性的首选[13-14]。本实验以青虾为对象,通过16S rDNA V4区域扩增子测序分析,研究冷藏(4.0f0.5)℃条件下气调包装和空气包装方式对微生物菌群多样性的影响,确定导致青虾腐败的优势菌,为探索延长青虾货架期的保鲜工艺提供理论依据。
1 材料与方法
1.1 材料与试剂
青虾由溧阳市启力润食品有限公司提供。
肉汤培养基 北京陆桥公司;细菌基因组提取试剂盒 德国QIAGEN公司;通用引物(515F:5’-GTGCCAGCMGCCGCGGTAA-3’;806R:5’-GGACTACHVGGGTWTCTAAT-3’)[15]由北京诺禾致源公司合成。
1.2 仪器与设备
UniCen MR台式冷冻离心机 德国Herolab公司;LDZX-30KBS立式压力蒸汽灭菌锅 上海申安医疗器械厂;SW-CJ-1FD型单人单面净化工作台 苏州净化设备有限公司;T-25数显匀浆器 德国IKA公司。
1.3 方法
1.3.1 样品准备
随机称取20 kg的优质青虾,加氧保活,在2 h内运至实验室。到达实验室后用碎冰猝死,经冰水冲洗后沥水备用。迅速按要求进行包装,每盒(150f5)g,本实验选取两种包装方式:托盘包装(以保鲜膜封口)和气调包装。气调包装取体积分数50% CO2,以N2作为补充气体,气体比例用气体测定仪测定后进行充气包装。随后将样品置于4 ℃贮藏6 d,每天分别随机取3 盒样品测定细菌总数和挥发性盐基氮(total volatile base nitrogen,TVB-N)含量。
1.3.2 菌落总数的测定
按照GB 4789.2ü2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[16]的方法进行虾仁样品中菌落总数的测定。无菌环境下打开包装盒,称取25 g青虾剪碎置于225 mL无菌生理盐水中,均质器中速档均质拍打1 min。取均质液依次10 倍梯度稀释后,取合适的3 个连续梯度,倾注营养肉汤培养基,待凝固后于37 ℃倒置培养72 h。
1.3.3 TVB-N含量的测定
将青虾绞碎搅匀,称取约10 g加90 mL去离子水,振荡浸渍30 min后过滤。取滤液5 mL参照GB/T 5009.228ü2016《食品安全国家标准 食品中挥发性盐基氮的测定》[17]测定TVB-N含量。
1.3.4 样品总DNA的提取
取托盘包装第2天和气调包装第4天的样品,收集菌体,参照Hinton等[18]的方法提取总DNA。将青虾剪碎放入装有250 mL蛋白胨-生理盐水(含1 g/L蛋白胨、8.5 g/L NaCl)的无菌均质袋中,振荡器中200 r/min振荡30 min。待振荡结束后,2 000 r/min低温离心5 min,去除虾壳、肌肉等成分,再经0.22 μm滤膜过滤,收集滤膜上的菌体于无菌离心管中,12 000 r/min离心10 min收集菌体。利用细菌基因组提取试剂盒提取样本的总DNA。
1.3.5 16S rDNA测序及序列分析
16S rDNA V4区扩增子测序及分析委托诺禾致源公司进行,其步骤为:首先利用带Barcode的特异性引物扩增16S rDNA的V4区。PCR产物经纯化后,利用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和实时荧光定量PCR定量,文库合格后,使用HiSeq2500 PE250进行上机测序。
对于得到的有效数据,利用Uparse 7.0.1001软件进行聚类[19],默认以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs)。对OTUs代表序列进行物种注释,用Mothur方法与SILV的SSUrRNA数据库进行物种注释分析(设定阈值为0.8~1.0)[20]。使用MUSCLE 3.8.31软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系[21]。最后对各样品的数据进行均一化处理,利用均一化的数据进行Alpha和Beta多样性分析。其中,使用R 2.15.3软件绘制稀释物种多样性曲线和主坐标分析(principal co-ordinates anyalysis,PCoA)图。
1.4 数据处理
利用统计学软件SPSS 17.0单因素方差分析对数据进行显著性比较,P<0.05表示差异显著。
2 结果与分析
2.1 不同包装方式对青虾贮藏过程中菌落总数的影响
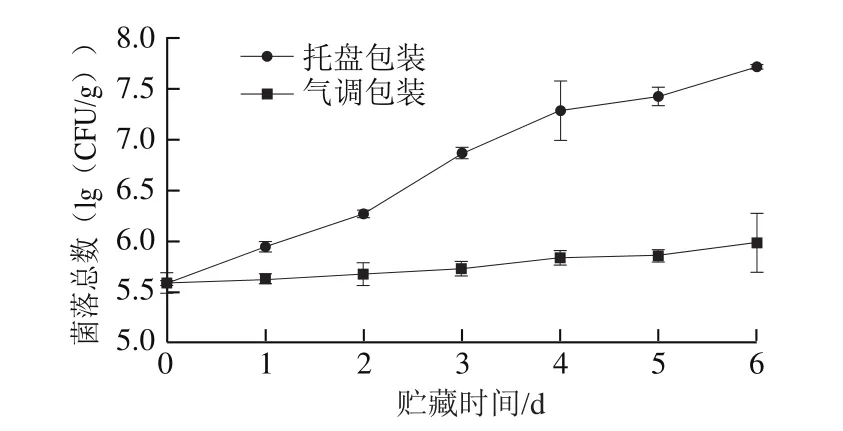
图1 不同包装方式对青虾贮藏过程中菌落总数的影响Fig.1 Change in total viable count under different packaging treatments
细菌的数量是表示产品腐败程度的重要指标,青虾在贮藏过程中菌落总数的变化如图1所示。在两种不同的包装方式中,随着贮藏时间的延长,菌落总数均逐渐增加。样品初始菌落总数为5.59(lg(CFU/g)),托盘包装组的菌落总数增长迅速,贮藏的第2天菌落总数已达6.27(lg(CFU/g)),而气调包装组菌落总数增长缓慢;在贮藏的第6天菌落总数为5.99(lg(CFU/g)),与托盘包装组第1天时接近。在整个贮藏过程中,气调包装组样品的菌落总数均显著低于托盘包装组(P<0.05),说明CO2气调包装方式能有效延长青虾的货架期。
2.2 不同包装方式对青虾贮藏过程中TVB-N含量的影响
TVB-N是微生物进入肌肉组织内部,生长繁殖导致肌肉蛋白质分解而形成的产物,是评价产品新鲜度的一项重要指标[22]。在GB 2733ü2015《食品安全国家标准鲜、冻动物性水产品》中规定淡水鱼虾TVB-N含量应不高于20 mg/100 g;因此,本实验中分析了青虾贮藏过程中TVB-N含量的变化,并将TVB-N含量为20 mg/100 g时定义为青虾的货架期。随后取腐败节点的样品进行微生物多样性分析,为后续青虾贮藏过程中腐败菌控制,进一步延长货架期提供依据。
如图2所示,随着贮藏时间的延长,两种不同包装方式的青虾TVB-N含量均逐渐增加。在托盘包装组青虾在贮藏的前2 d,TVB-N含量由最初的12.7 mg/100 g增长至20.4 mg/100 g,而气调包装组青虾在贮藏的第4天,TVB-N含量为21.3 mg/100 g。因此托盘包装组和气调包装组的青虾分别于贮藏的第2天和第4天到达腐败节点,后续微生物菌群分析样品分别取自托盘包装的第2天和气调包装的第4天。
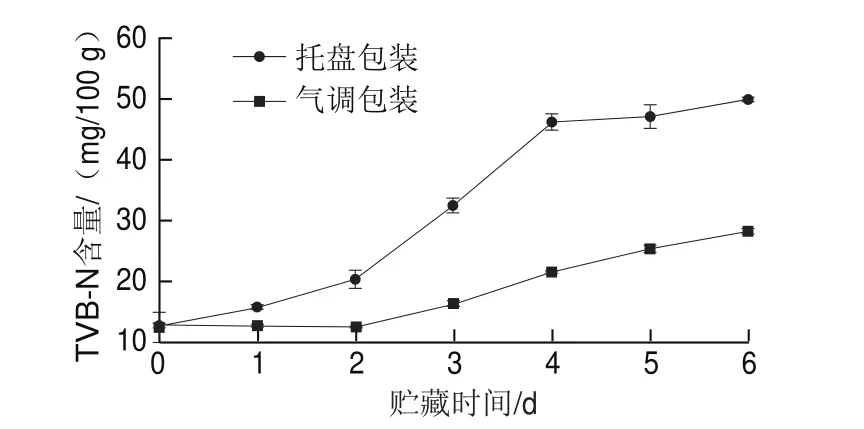
图2 不同包装方式对青虾贮藏过程中TVB-N含量的影响Fig.2 Changes in TVB-N content under different packaging treaments
2.3 基于16S rRNA基因测序的物种多样性
取初始样品、托盘包装组和气调包装组进入腐败期的样品,进行16S rRNA V4区测序。3 组样品产生的有效片段数量在65 219~95 052之间,平均长度在250~257 bp之间,98.5%的碱基Q值大于20(即错误率小于1%)。在有效的片段数量中,初始样品、托盘包装组和气调包装组的GC含量分别为50.2%、51.2%和52.0%。对样品中有效的Tags进行聚类,以97%的一致性将序列聚类成为OTUs,然后对OTUs的代表序列进行物种注释,发现这3 组样品中的菌群主要包含变形菌门(Proteobacteria)、软壁菌门(Tenericutes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、蓝藻门(Cyanobacteria)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、绿弯菌门(Chloroflexi)、互养菌门(Synergistetes)10 个优势菌门。
2.4 物种相对丰度分析
选取各组在科、属和种水平上最大丰度排名前10的物种,生成物种相对丰度柱形累加图(图3)。由图3可以看出,初始样品、托盘包装组和气调包装组样品所含微生物种类和数量在科、属和种水平均有差异。
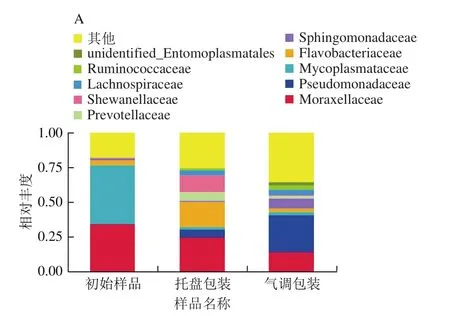
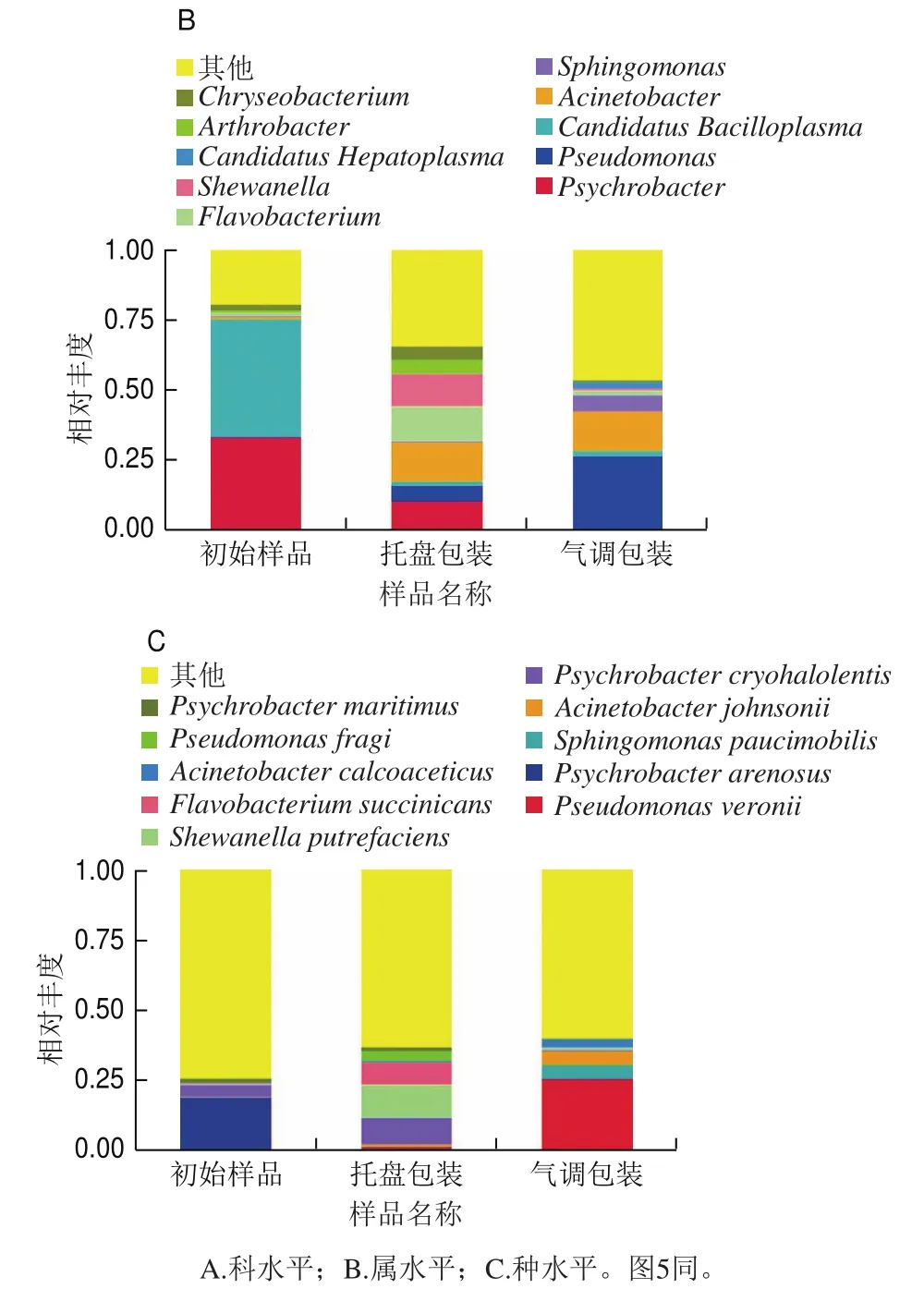
图3 不同包装方式样品在贮藏过程中微生物物种的相对丰度Fig.3 Relative abundance of microbial species under different packaging treatments during storage
由图3 A可知,初始样品中支原体科Mycoplasmataceae所占比例最大,为42.4%,其次为莫拉菌科Moraxellaceae,所占比例为34.6%,黄杆菌科Flavobacteriaceae占3.5%;托盘包装组中在科水平下主要有Moraxellaceae(25.0%)、Flavobacteriaceae(18.4%)、希瓦氏菌科Shewanellaceae(12.2%)、假单胞菌科Pseudomonadaceae(5.5%)、普雷沃氏菌科Prevotellaceae(6.0%)和毛螺菌科Lachnospiraceae(3.7%);气调包装组的菌群在科水平下主要有Pseudomonadaceae(26.4%)、Moraxellaceae(14.6%)、鞘脂单胞菌科Sphingomonadaceae(7.6%)、Lachnospiraceae(3.8%)和疣微菌科Ruminococcaceae(3.3%)。从科水平来看,与初始样品相比,托盘包装组第2天科水平的丰富度增加,Flavobacterium、Shewanellaceae、假单胞菌科等一些嗜冷菌相对丰度增加。而与托盘包装组相比,气调包装组假单胞菌科逐渐占据优势,这可能是因为Flavobacterium、Shewanellaceae对低氧环境耐受能力更差,而假单胞菌科有更强的耐受力。
从属水平来看(图3B),初始样品中优势菌属主要为嗜冷杆菌属Psychrobacter(33.6%)和Candidatus Bacilloplasma(42%),两者总丰度占75.6%。与初始样品相比,托盘包装组Psychrobacter和Candidatus Bacilloplasma的相对丰度大大减小,而假单胞菌属(Pseudomonas)(5.5%)、Acinetobacter(13.9%)、Flavobacterium(12.3%)和希瓦氏菌属(Shewanella)(12.2%)相对丰度显著增加,聚类在其他的菌属由19%增加至33.7%,也说明菌种的丰富度增加。与托盘包装组相比,气调包装组假单胞菌属(26.4%)丰度显著增加,而Flavobacterium和Shewanellaceae相对丰度显著降低。聚类在其他的菌属已接近50%,气调包装使菌种的丰富度进一步增加。
从种水平来看(图3C),初始样品中优势菌种主要为嗜冷杆菌属,分别为Psychrobacter arenosus(19.1%)、Psychrobacter cryohalolentis(4.3%)和Psychrobacter maritimus(1.5%)。与初始样品相比,托盘包装组Psychrobacter相对丰度降低,Shewanella putrefaciens(11.8%)和Flavobacterium succinicans(8.0%)相对丰度显著增加;气调包装组中优势菌种主要为Pseudomonas veronii(26%)。说明气调包装抑制多数微生物的增殖,包括嗜冷菌和非嗜冷菌,但对假单胞菌的抑制效果不明显,使其逐渐生长为优势菌。
2.5 物种丰度聚类分析
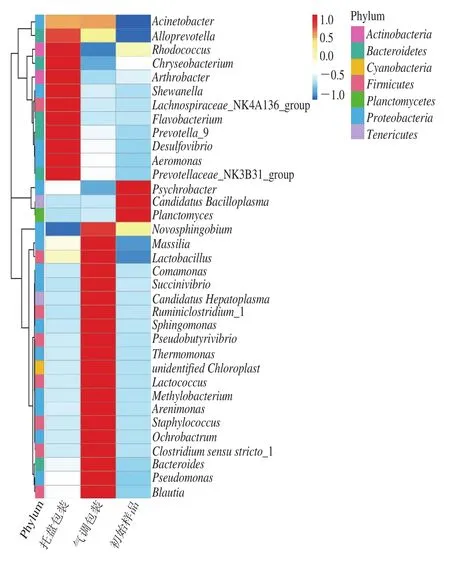
图4 不同包装方式样品在贮藏过程中微生物物种丰度聚类分析图Fig.4 Clustering analysis of microbial species abundance under different packaging treatments during storage
选取丰度排名前35的属,根据其在每个样品中的丰度信息,从物种和样品两个层面进行聚类,绘制成热图,更便于发现哪些物种在哪些样品中聚集较多或含量较低。如图4所示,图中颜色越深表示该物种聚集越多,可以看出3 组样品物种聚集差异较大。在初始样品组中,Psychrobacter、Candidatus Bacilloplasma和Planctomyces聚集较多,其他物种较分散;而在贮藏过程中,无论托盘包装还是气调包装,均有物种出现了不同程度的聚集,但集中在不同的区间。在托盘包装组中,Aeromonas、Flavobacterium、Shewanella等聚集较多,这可能与这些菌能耐受较低的温度有关。气调包装组中Pseudomonas聚集较多,说明气调包装能抑制贮藏期中优势腐败菌如Flavobacterium和Shewanella的生长,但假单胞菌属有较强的耐受力,从而逐渐生长为优势菌株。
2.6 Ternary plot分析

图5 不同包装方式样品在贮藏过程中微生物物种的三元相图Fig.5 Ternary plots of microbial species under different packaging treatments during storage
为了继续寻找初始样品、托盘包装组和气调包装组3 组样品之间优势物种的差异,选取这3 组样品在科、属、种水平上平均丰度排名前10的物种,生成三元相图。从科水平看(图5A),莫拉菌科Moraxellaceae在初始包装组和托盘包装组中有较大比例的富集,而在气调包装组中相对丰度较低,说明气调包装能抑制莫拉菌科的菌种生长。支原体科(Mycoplasmataceae)在初始样品中所占比例最大,但托盘包装组和气调包装组中比例接近都非常低,说明Mycoplasmataceae不能适应低温环境,在低温贮藏时将不会成为致腐的优势菌株。Flavobacteriaceae和Shewanellaceae在初始样品中比例较少,在托盘包装组中所占的比例大大增加,说明二者能耐受较低的温度,将会成为青虾低温贮藏时的主要威胁菌株。而在气调包装组中,二者的比例又大大降低,说明气调包装能显著抑制二者的生长,这可能与它们的多数菌株不能耐受低氧环境有关。Pseudomonadaceae在初始样品组和托盘包装组中都未有较大比例的富集,但是在气调包装组中所占比例大大增加,说明气调包装不能有效控制Pseudomonadaceae菌株的生长,需要配合一些其他的杀菌技术(例如高压静电保鲜技术[23])才能进一步延长货架期。
从属水平看(图5B),3 组样品中的优势物种也差异较大,在初始样品组中,与物种丰度分析结果一致,优势物种为Psychrobacter和Candidatus Bacilloplasma,且相对丰度最高。在托盘包装组中,Flavobacterium、Shewanella和Arthrobacter为优势物种,但相对丰度相比初始样品组已大大降低。在托盘包装组中优势物种主要为Pseudomonas和Sphingomonas,且Pseudomonas的相对丰度远远大于Sphingomonas。另外,Acinetobacter在托盘包装组和气调包装组中都有一定程度的聚集。
从种水平看(图5C),初始样品中优势菌种主要为Psychrobacter arenosus,且相对丰度较高。托盘包装组中主要为Shewanella putrefaciens和Flavobacterium succinicans,同样地,二者的相对丰度相对初始样品组也大大降低。而在气调包装组中Pseudomonas veronii已占据了绝对优势,其相对丰度远远大于其他物种。
2.7 属水平物种进化树
为了进一步研究属水平物种的系统进化关系,通过多序列比对得到排名前100属的代表序列的系统发生关系(图6),可以看出,初始样品组中优势物种Psychrobacter和Candidatus Bacilloplasma主要集中在两个不同的分支。在托盘包装组中,虽然物种种类丰富度增加,但种与种之间的亲缘关系较接近,依旧主要集中在两个不同的分支。但在气调包装组中,物种的丰度大大降低,丰富度却增加,散落在各个分支中。说明气调包装抑制了优势腐败菌的增长,从而使物种的丰富度增加。
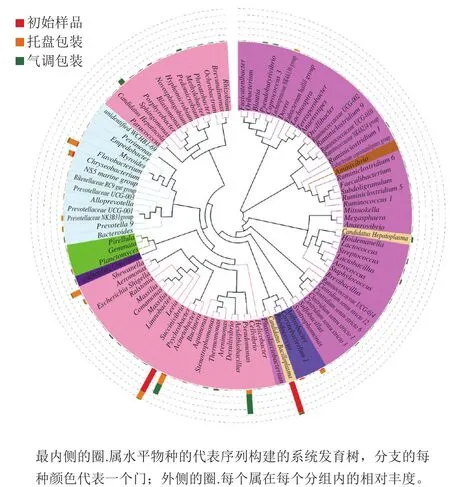
图6 不同包装方式样品在贮藏过程中微生物物种的属水平物种系统发育树Fig.6 Phylogenetic tree of microbial genera under different packaging treatments during storage
2.8 物种多样性曲线
物种多样性曲线可直观反映样品中物种的丰富度和均匀度。在水平方向上,物种的丰富度由曲线的宽度来反映,物种的丰富度越高,曲线在横轴上的跨度越大;在垂直方向上,曲线的平滑程度,反映了样品中物种的均匀程度,曲线越平缓,物种分布越均匀。
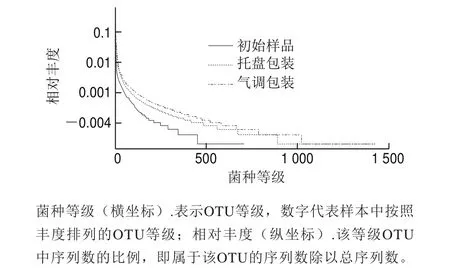
图7 不同包装方式样品在贮藏过程中微生物物种多样性曲线Fig.7 Rank abundance curves of microbial species under different packaging treatments during storage
由图7可知,从物种的丰富度和均匀度来说都是初始样品组<托盘包装组<气调包装组,这与上述分析也较为一致,青虾经过一定的贮藏期后,物种丰富度增加,物种分布较初始样品均匀,而气调包装能抑制原本优势腐败菌的生长,造成物种的丰富度和均匀度进一步增加。
2.9 基于OTU的Venn分析

图8 不同包装方式样品在贮藏过程中微生物物种间共有OTU分析图Fig.8 Shared OTU analysis of samples under different packaging treatments during storage
基于样品总OTU数作Venn图,进行相似性分析(图8)。初始样品组与托盘包装组共有的OTU数735 个,占二者OTU总数的42.4%。初始样品组中特有的OTU为102 个,托盘包装组中特有的OTU为557 个,同样也说明托盘包装组中菌群结构丰富度和均匀度与初始样品相比有所增加。气调包装组与托盘包装组共有的OTU为851 个,占二者总数的35.8%,气调包装组中特有的OTU为744 个,说明气调包装组中菌群结构的丰富度和均匀度稍高于托盘包装组,但二者的菌群结构差异较大。
2.1 0 物种主坐标PCoA分析
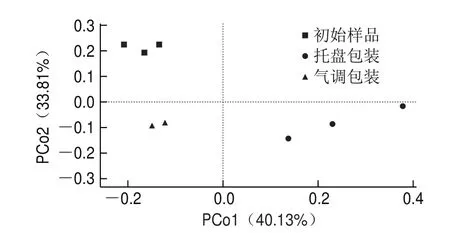
图9 基于Weighted Unifrac距离的PCoA分析Fig.9 PCoA analysis based on the Weighted Unifrac distance
基于Weighted Unifrac距离进行PCoA分析,由图9可知,初始样品组、托盘包装组和气调包装组3 组样品分别聚集在不同的象限,说明这3 组样品微生物群落结构存在显著差异。初始样品组的聚集性明显高于托盘包装组和气调包装组,说明初始样品组样品个体之间重复性高于另外两组,即初始样品组样品中所含有的微生物群落多样性较小。而托盘包装方式下微生物群落多样性增加,说明原始的优势菌株不能耐受较低的贮藏温度,而原本非优势的耐低温菌株快速生长,造成比例增大。托盘包装优势菌株聚集在第四象限而气调包装组聚集在第三象限,说明气调包装能抑制优势腐败菌-耐低温菌株的生长,起到较好的保鲜作用。
3 讨 论
本实验通过对托盘包装和CO2气调包装方式下青虾菌群结构的深入分析,认识了青虾贮藏过程中腐败菌群的一般结构、优势菌群及不同包装方式对优势菌群的影响,为进一步集成不同的冷鲜技术、延长货架期提供理论依据。青虾的初始菌落总数和TVB-N含量较高,分别为5.59(lg(CFU/g))和12.7 mg/100 g,托盘包装2 d后,TVB-N含量已达到20.4 mg/100 g,已腐败变质,因此通常青虾的保鲜期比较短。采用气调包装后,货架期延长至4 d,但相对于冷鲜肉来说货架期仍然较短[24]。本实验通过菌群结构分析显示,从属水平上看出,托盘包装方式下优势菌群主要以Acinetobacter、Flavobacterium和Shewanellaceae为主,因此这三者是造成青虾腐败的主要菌群。采用气调包装后,Flavobacterium和Shewanellaceae的丰度相对于托盘包装大大降低,Flavobacterium为严格好氧菌[25-26],50% CO2+50% N2造成的无氧环境能显著抑制二者的增殖。Shewanellaceae为兼性厌氧菌[27-28],在气调包装方式下,其生长繁殖受到抑制,这可能与CO2溶解于样品汁液中,所造成的低pH值有关[29-30]。因此50% CO2+50% N2能抑制优势腐败菌的生长,延长货架期。此外,气调包装增加了微生物菌群的多样性,这可能也与气调包装抑制了普通托盘包装时优势腐败菌的生长有关。环境中微生物互相竞争食物中的营养、溶解氧等物质,气调包装消除优势腐败菌的竞争,非优势菌株开始生长繁殖,因而增加了菌群多样性。在气调包装方式下,Pseudomonadaceae所占的比例为26.4%,成为新的优势腐败菌,这可能是因为Pseudomonadaceae有较强的耐受力。后期可研究与其他保鲜技术如高压静电保鲜技术[23]联合以进一步延长青虾的货架期。

