佐剂性关节炎大鼠血小板活化与FAK/Calpain信号通路紊乱有关①
章平衡 刘 健 纵瑞凯 黄 旦 万 磊
(安徽中医药大学,合肥230038)
类风湿关节炎(Rheumatoid arthritis,RA)是以关节滑膜的慢性炎症为基础病理变化的一种自身免疫性慢性疾病,随着疾病的逐渐进展,会导致血管翳形成以及软骨和软骨下骨破坏[1]。RA如不积极正规的诊治,将会慢慢发展侵蚀,导致骨及关节的不可逆转的破坏和畸形,最终导致功能的丧失。该病的发生发展过程相当复杂,至今病因病机尚不明确,但其炎症发生过程系与细胞因子、趋化因子等多因素密切相关[2,3]。目前有研究发现血小板活化,释放大量活性颗粒,如P-选择素、血小板活化因子(Platelet activating factor,PAF),血小板α颗粒膜糖蛋白-140(Granule membrane protein 140,GMP-140)、血小板分化抗原40配体(Cluster of differentiation 40 ligand,CD40L),与RA疾病相关。它们在体内发挥着多重生物学效应,并且在RA炎症发生与发展过程中相当重要[4-7]。黏附斑激酶(Focal adhesion kinase,FAK)是一种胞质非受体蛋白酪氨酸激酶,黏附斑复合物家族一员,它在介导细胞黏附、增殖等过程中起重要作用[8,9],并且FAK的黏着斑非激酶区(Four-ezrin-radixin-moesin,FERM)同源区结构域可以和血小板衍生生长因子受体的酪氨酸激酶相连,从而介导血小板活化及其下游的相关信号转导[10]。在血小板活化过程中会导致大量Ca2+内流,然后结合钙蛋白酶(Calpain),进而水解蛋白激酶、激活蛋白磷酸酶增强去磷酸化作用从而抑制血小板活化[11]。因此,FAK/Calpain信号通路在血小板的活化过程中起着重要作用。为了探讨血小板活化在类风湿关节炎发病中的作用机制,本研究观察佐剂关节炎大鼠血小板及FAK/Calpain信号通路的影响,现将研究结果作简要阐述。
1 材料与方法
1.1材料
1.1.1实验动物 40只雄性SD大鼠,体重(170±10)g。在保持阴暗、安静的清洁级动物房饲养,温度17~25℃,相对湿度45%~75%,通风换气每小时8~12次。
1.1.2药品及试剂 弗氏完全佐剂(FCA)由美国Sigma公司出品;IL-6、IL-8、MMP-9检测试剂盒购自美国R&D公司;CD40L、CD147、GPⅡb/Ⅲa试剂盒购自美国eBioscience公司; PCR 试剂盒(No:208054)购自Qiagen公司;逆转录试剂盒(货号:K1622)购自Thermo Scientific公司;引物由上海生工生物工程技术服务有限公司合成;兔抗FAK、p-FAK、Calpain1、Calpain2单克隆抗体购自Bioworld公司;β-actin鼠抗单克隆抗体购自北京中杉公司。
1.2方法
1.2.1模型复制分组 将40只SD雄性大鼠适应性喂养1周后,随机分为正常对照组(Normal control,NC,20只)和模型组(Model control,MC,20只),除正常对照组外,向每只大鼠右足跖皮内注射FCA 0.1 ml致炎,复制成佐剂关节炎(Adjuvant arthritis,AA)大鼠模型[12]。
1.2.2大鼠足跖肿胀度、关节炎指数的测算 造模前1 d、致炎后第48天测量各组大鼠后足跖的容积,计算各组大鼠足跖肿胀度[13]。肿胀度E(%)=(Vt-Vn)/Vn×100%(Vn、Vt分别代表造模前后的容积)。关节炎指数(Arthritis index,AI)的计算,按5级评分法评价,0分:无红肿;1分:小趾关节红肿;2分:趾关节和足跖肿胀;3分:踝关节以下的足爪肿胀;4分:包括踝关节在内的全部足爪肿胀。根据未注射佐剂的其余3只肢体的病变程度累积计分,计算出AI[14]。
1.2.3IL-6、IL-8、MMP-9测定 大鼠血清中IL-6、IL-8、MMP-9的测定:严格按照ELISA试剂盒说明书操作测定IL-6、IL-8、MMP-9的含量。
1.2.4全自动血细胞分析仪检测外周血血小板参数的表达 采用Sysmex XT-2000i全自动血细胞分析仪检测外周血血小板参数PLT、MPV、PCT、PDW。
1.2.5流式细胞术检测大鼠外周血CD40L、CD147、GPⅡb/Ⅲa的表达 取大鼠新鲜血液800 μl,按每106个细胞/管分别加入抗-鼠CD40L-FITC、CD147-FITC、GPⅡb/Ⅲa-FITC 20、1、1 μl,避光20~30 min;流式细胞仪检测CD40L、CD147和GPⅡb/Ⅲa 表达频率。
1.2.6大鼠滑膜组织FAK/Calpain通路mRNA及蛋白的表达水平 大鼠滑膜组织FAK、Calpain1、Calpain2 mRNA表达的测定:根据美国加利福尼亚州Invitrogen公司提供的引物序列号,使用Primer Primer 5软件设计并分析引物(见表1)。用Trizol提取大鼠滑膜组织中的总RNA,并按照Thermo反转录试剂盒说明书提供方法进行反转录。荧光实时定量PCR反应体系为10 μl:正、反引物各1 μl及SYBR Green染料5 μl,反转录产物2 μl,水补至10 μl。每一组样品进行PCR反应时,用β-actin作为内参照,用同一样品的cDNA和同样的PCR反应条件进行扩增,扩增条件为95℃预变性5 min,然后按下列循环条件进行扩增,95℃变性10 s,退火60℃30 s,循环40次。
表1半定量PCR引物序列及扩增长度
Tab.1Semi-quantitativePCR-primersequenceandamplificationlength

GenePrimer sequenceLength(bp)β-actinForward:5′-CCCATCTATGAGGGTTACGC-3′150Reverse: 5′-TTTAATGTCACGCACGATTTC-3′FAKForward: 5′-ACACATACACCATGCCCTCA-3′136Reverse: 5′-GCCAAAGCTGGATTCTCTGG-3′Calpain1Forward: 5′-TCGAGTTGTGCCTCTAGACC-3′91Reverse: 5′-GTATTCCAGTTCCGGAGGGT-3′Calpain2Forward: 5′-TCGAGTTGTGCCTCTAGACC-3′121Reverse: 5′-GTCCTTAGTGGGCAGTCTGT-3′
1.2.7大鼠滑膜组织FAK、p-FAK、Calpain1、Calpain2蛋白的表达 滑膜组织中蛋白质,用蛋白裂解液(RIPA液)提取,提取的蛋白质,用蛋白测定试剂盒,测定蛋白浓度,并将浓度调成2 μg/μl,取出16 μl提取的蛋白液加入4 μl上样缓冲液(5×),进行凝胶电泳,其中分离胶10%,浓缩胶5%。恒压80 V电泳至分离胶上部,恒压120 V电泳至分离胶底部;在恒流300 mA,50 min转移到硝酸纤维素膜上,用5%的脱脂奶粉封闭2 h后,加入FAK抗体属性为兔抗1∶1 000稀释;p-FAK抗体属性为兔抗1∶500 稀释;Calpain1抗体属性为兔抗1∶1 000稀释;Calpain2抗体属性为兔抗1∶500稀释,摇床上振摇 2 h 或4℃过夜,用磷酸盐缓冲液(PBST)洗涤3次,每次15 min。再加入1∶15 000羊抗鼠IgG-HRP,摇床上振摇1 h,PBST洗涤3次,每次15 min。电化学发光(ECL)试剂显色、曝光,并用扫描仪进行扫描。BANDSCAN软件对条带分析,计算条带灰度值,以FAK、p-FAK、Calpain1、Calpain2/β-actin灰度值比值作为滑膜组织FAK、p-FAK、Calpain1、Calpain2蛋白表达的相对含量。

2 结果
2.1大鼠体重(M)、足跖肿胀度(E)、关节炎指数(AI)的变化 在造模前两组大鼠的体重差异无统计学意义;造模后,与NC组比较,MC组大鼠致炎48 d体重下降明显;致炎第48天MC组大鼠E、AI显著升高,见表2。正常组大鼠关节滑膜仅有少量炎性细胞浸润,关节滑膜表面光滑无凸起;MC组大鼠关节滑膜有大量炎性细胞浸润,少量新生血管形成,关节滑膜表面有凸起,见图1、2。
2.2AA大鼠外周血血小板参数的变化 与NC组相比,MC组大鼠PLT、PCT显著升高(P<0.01),PDW、MPV差异无统计学意义(P>0.05)。见表3。
2.3大鼠外周血血小板相关指标CD40L、CD147、GPⅡb/Ⅲa的变化 两组各检测5只大鼠的外周血血小板相关指标变化,与NC组相比,MC组CD40L、CD147、GPⅡb/Ⅲa表达升高(P<0.01),见表4、图3。
2.4大鼠滑膜组织FAK/Calpain1信号通路的变化 两组各检测6只大鼠的滑膜组织FAK/Calpain1信号通路的变化,与NC组相比,MC组FAK mRNA表达升高,Calpain1、Calpain2 mRNA表达降低(P<0.05,P<0.01);MC组FAK、p-FAK蛋白表达升高,Calpain1、Calpain2蛋白表达降低(P<0.05,P<0.01)。见表5、图4。

图1 大鼠关节肿胀对比

图2 大鼠关节病理切片观察

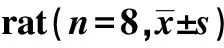

GroupsPLT(109)PCT(%)PDW(%)MPV(fl)NC1 005.71±20.810.86±0.1210.15±0.908.42±0.49MC1 434.00±160.511)1.09±0.161)10.20±0.748.40±0.38
Note:Compared with NC group,1)P<0.01.



GroupsM(g)Before theinflammatory 0 dBefore theinflammatory 48 dE(%)Before theinflammatory 18 dBefore theinflammatory 48 dAI(score)Before theinflammatory 12 dBefore theinflammatory 48 dNC179±13.0302±8.881.44±0.107.54±1.700.08±0.280.17±0.38MC184±15.5 254±11.61)29.20±8.461)17.50±4.891) 1.08±0.661) 7.08±0.791)
Note:Compared with NC group,1)P<0.01.
2.5大鼠外周血IL-6、IL-8、MMP-9的变化 与NC组相比,MC组IL-6、IL-8、MMP-9表达升高(P<0.05,P<0.01)。见表6。
2.6FAK/Calpain1信号通路指标与细胞因子、血小板活化指标及大鼠体重、足跖肿胀度、关节炎指数的相关性分析 分别检测了6只大鼠的FAK/Calpain1信号通路指标与细胞因子、血小板活化指标及大鼠体重、足跖肿胀度、关节炎指数等相关指标,并进行了相关性分析,发现FAK蛋白与CD147、GPⅡb/Ⅲa呈正相关,p-FAK蛋白与CD40L呈正相关,Calpain1蛋白与IL-6呈负相关,Calpain2蛋白与E呈负相关,FAK mRNA与IL-6呈正相关(P<0.01,或P<0.05)。见表7。



GroupsCD40L(%)CD147(%)GPⅡb/Ⅲa(%)NC47.66±1.2857.51±1.8149.99±2.61MC86.34±0.711)89.23±5.781) 79.01±10.761)
Note:Compared with NC group,1)P<0.01.

图3 大鼠血小板相关指标CD40L、CD147、GPⅡb/Ⅲa表达量的流式图



GroupsmRNAFAKCalpain1Calpain2ProteinFAKp-FAKCalpain1Calpain2NC1.00±0.421.00±0.131.00±0.130.16±0.020.20±0.061.29±0.361.58±0.04MC9.91±0.731)0.23±0.041)0.12±0.021)1.09±0.111)0.80±0.021)0.69±0.071)0.76±0.051)
Note:Compared with NC group,1)P<0.01.

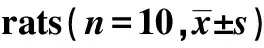

GroupsIL-6IL-8MMP-9NC149.08±10.14138.52±15.7275.96±8.32MC211.36±24.781)235.77±45.391)161.30±27.321)
Note:Compared with NC group,1)P<0.01.
表7FAK/Calpain1信号通路指标与细胞因子、血小板活化指标及大鼠体重、足跖肿胀度、关节炎指数的相关性分析(r)
Tab.7CorelationanalysisbetweenFAK/Calpain1andcytokinesplaletetactivitionaswellasM,EandAI(r)

IndexmRNAFAKCalpain1Calpain2ProteinsFAKp-FAKCalpain1Calpain2AI0.2960.6920.236-0.366-0.5670.214-0.169E-0.3320.0990.533-0.0280.1670.329-0.9681)IL-60.8192)0.309-0.655-0.3130.164-0.8902)0.646IL-80.1070.3630.021-0.385-0.5120.3720.053MMP-9-0.5750.1940.432-0.559-0.2600.733-0.364CD40L0.0020.4150.5990.1660.8812)0.541-0.096CD147-0.758-0.6490.6630.9331)-0.1830.588-0.176GPⅡb/Ⅲa-0.732-0.4820.7710.9042)-0.2010.578-0.310
Note:1)P<0.01,2)P<0.05.
3 讨论
FAK是一种胞质非受体蛋白酪氨酸激酶,是黏附斑复合物家族成员之一,它主要介导细胞增殖、黏附、迁移及调控细胞周期等[15]。Calpain则是钙激活中性蛋白酶,属于半胱氨酸蛋白水解酶超家族成员之一。它的表达水平与重塑细胞骨架、细胞凋亡以及信号转导密切相关,并在很多自身免疫性疾病的发生发展过程中起着至关重要的作用。
血小板膜糖蛋白分子(GPⅡb/Ⅲa),在血小板活化的过程中起着关键的作用[16]。当其受某些因素刺激后,导致空间构型的变化,会引起纤维蛋白结合位点的暴露,则会诱导血小板膜“内-外”的双向信号转导,致使FAK发磷酸化,活化后FAK酪氨酸位点的PKC发生磷酸化,引起胞内骨架蛋白的重排,然后在第二信使或蛋白激酶等介导作用下,不断整合放大,最终实现血小板的活化[17-22]。当FAK磷酸化活化导致PKC活化后,Ca2+内流增加,正常情况下,钙蛋白酶Calpain会与大量内流的Ca2+相结合后活化,进而水解活化的FAK,发生一系列的活化磷酸化,从而抑制血小板活化。当在机体功能紊乱的情况下,上述动态平衡被打破,会导致持续的血小板活化,产生大量的可溶性CD40L[23],经过血液循环,进入增生滑膜组织中,促进局部炎症细胞因子IL-8、IL-6等大量生成,导致RA滑膜炎症的形成、发展,甚至引起关节软骨的破坏[24]。另外,当血小板被激活,表达于血小板膜表面CD147的表达亦会增多[25-27]。CD147 能够刺激基质成纤维细胞,产生多种基质金属蛋白酶(MMP),并且能够通过血液循环,进入关节滑膜,形成关节滑膜炎症[28]。
本研究结果显示,AA大鼠E、AI比正常组明显升高,血小板活化后表达产物CD40L、CD147、GPⅡb/Ⅲa表达水平升高,同时细胞因子(IL-6、IL-8、MMP-9)表达亦明显升高,表明AA大鼠在关节出现炎症反应同时其体内还存在着血小板的活化,表现为血小板活化产物CD40L的大量分泌,以及血小板表面受体CD147和血小板表面膜糖蛋白分子GPⅡb/Ⅲa的高表达。并且FAK通路活化及Calpain通路抑制的同时,血小板相关指标(CD40L、CD147、GPⅡb/Ⅲa)、细胞因子(IL-6、IL-8及MMP-9)的表达升高,且相关性分析显示FAK蛋白与CD147、GPⅡb/Ⅲa呈正相关,p-FAK蛋白与CD40L呈正相关,Calpain1蛋白与IL-6呈负相关,Calpain2蛋白与E呈负相关,FAK mRNA与IL-6呈正相关。说明FAK/Calpain信号通路的改变,能够促进血小板的活化,增加CD40L、CD147、GPⅡb/Ⅲa的分泌,从而促进炎症细胞因子IL-6、IL-8及MMP-9的分泌,最终导致滑膜炎症的发生发展。
RA血小板活化的发病机制至今还不完全明确,而FAK/Calpain信号传导通路的作用环节复杂,在本研究中结果显示,抑制FAK的活化,抑制血小板活化产物的分泌,可能会减轻滑膜炎症的发生。为进一步明确FAK/Calpain信号传导通路的作用靶点,我们将从体外实验角度深入研究,以更加准确地阐述其作用机制。