雌二醇通过雌激素β受体促进非小细胞肺癌A549细胞增殖
信 波,庞海林,申炜炜,张开亮,张 蕾,张立成,张贺龙*
(1解放军第88医院肿瘤科,泰安 271000;2空军军医大学第二附属医院肿瘤科;3解放军第88医院骨科;*通讯作者,E-mail:cnxazhl@163.com)
肺癌是目前世界范围内最常见的肿瘤,其引起的死亡占所有肿瘤导致死亡的20.6%[1]。肺癌的主要组织学类型是非小细胞肺癌(NSCLC),占所有肺癌的80%-85%[2]。
雌激素是人体内一类重要的类固醇性激素。它调节着体内众多的生理功能,如细胞生长、繁殖、发育和分化。雌激素除了对正常的细胞和生理过程产生影响外,还在诸如肿瘤、代谢病、心血管疾病、神经退行性疾病、炎症、骨质疏松等病理过程中发挥着极其重要的作用。雌激素主要通过雌激素受体(estrogen receptor,ER)发挥这些作用[3],而ER又分为ERα和ERβ两类。
近年来,雌激素在肺癌发生发展中的作用受到了广泛关注[4]。已有文献报道,与正常肺细胞相比,NSCLC组织中存在有大量ER[5]。而人体内雌激素主要为雌二醇,因此,本实验旨在探讨雌二醇对人非小细胞肺癌细胞增殖能力的影响,为其临床应用提供理论及实验依据。
1 材料和方法
1.1 细胞株及主要试剂
人类非小细胞肺癌细胞系A549、H1299(购自中科院上海细胞生物研究所);RPMI 1640培养基、胎牛血清(Gibco,美国);E2(17β-雌二醇,Sigma,美国);PPT(雌激素受体α激动剂,TOCRIS,英国);DPN(雌激素受体β激动剂,TOCRIS,英国);MTT细胞增殖检测试剂盒、结晶紫染色液(上海碧云天生物技术有限公司)。
1.2 细胞培养
常规使用RPMI 1640培养液(含10% FBS、100 U/ml青霉素和0.1 mg/ml链霉素)培养人非小细胞肺癌细胞系A549细胞和H1299细胞。每次取对数生长期的细胞进行实验。
1.3 细胞增殖实验
将A549细胞和H1299细胞分别用三种药物(E2、PPT、DPN)各作用24 h和48 h。取生长至铺满瓶底80%左右的A549细胞和H1299细胞,常规消化;按每孔1 000个细胞的密度将细胞接种至96孔板,为了去除FBS中可能存在的激素所带来的影响,待细胞贴壁后,换无血清培养基培养24 h,而后在96孔板内按浓度梯度(0,10-10,10-9,10-8,10-7,10-6mol/L)加入E2,按浓度梯度(0,10-8,10-7,10-6,10-5,10-4mol/L)加入PPT或DPN,每个浓度设立5个复孔;“十字形”晃动培养板,使细胞分布均匀,放入培养箱;加入相关试剂后的第24小时和48小时分别用MTT法检测细胞的增殖情况,并分析得出的数据。
1.4 平板克隆形成实验
将处于对数生长期的A549和H1299细胞用胰酶消化,重悬后制成单细胞悬液;于6孔板培养板中接种200个细胞/孔,每个实验组3个复孔;将接种好的细胞于培养箱中继续培养6 d,然后换无血清培养液培养24 h,而后在无血清培养液中加入相应浓度的E2、PPT和DPN培养24 h和48 h,然后换新鲜完全细胞培养液继续培养5 d;肉眼可见克隆形成或镜下可观察到绝大多数单克隆中细胞数大于50个为止(中途每3 d进行换液并观察细胞状态)。每孔加入95%酒精1 ml,固定细胞20 min;PBS漂洗细胞1次;每孔加入1%结晶紫染液1 ml,染细胞15 min;将六孔板浸泡至流水中洗涤,直至洗净板上背景,晾干;数码相机拍照整张板,并对肉眼可见克隆进行计数。
1.5 细胞凋亡检测
按每孔2×105个细胞的数量将细胞接种至六孔板中,待细胞贴壁后加入无血清培养液培养24 h;分别加入相应浓度的E2、PPT和DPN,继续孵育48 h;收集1×105-5×105个细胞,加入500 μl结合缓冲液重悬细胞;加入5 μl Annexin Ⅴ-FITC混匀,再加入Annexin Ⅴ-FITC Propidim Iodin 5 μl;室温避光反应5-10 min。1 h内用流式细胞仪检测细胞凋亡情况。
1.6 细胞周期检测
按每孔2×105个细胞的数量将细胞接种至6孔板,待细胞贴壁后加入无血清培养液培养24 h;分别加入相应浓度的E2、PPT和DPN,继续孵育48 h;收集1×105-5×105个细胞;加入1 ml 70%冰乙醇,4 ℃固定12-24 h;1 000g离心5 min,弃上清;加入1 ml预冷过的PBS漂洗1次,1 000g离心5 min,弃去上清液,轻弹离心管底以分散细胞。管内加入500 μl碘化丙啶染色液,充分混匀,37 ℃避光反应30 min。4 ℃避光存放,于24 h内用流式细胞仪在400 nm处检测。
1.7 统计学分析
使用SPSS 11.0统计学软件进行分析。根据不同的数据类型,采取相应的统计学方法如方差分析、One-way ANOVA和Stutent’st检验,数据以平均值±标准差表示,P<0.05为差异有统计学意义。
2 结果
2.1 E2与DPN均可促进A549细胞增殖
为了排除完全培养基内血清中可能含有的激素对细胞生长的影响,在加入E2、PPT和DPN前24 h即用无血清培养基培养细胞,加入E2、PPT和DPN后继续用无血清培养基培养细胞。由于细胞在无血清培养基中无法正常分裂生长,所以本实验只观察加入E2、PPT和DPN后48 h内(即无血清培养基培养细胞72 h)三者对细胞的影响。且以未添加相应试剂的无血清培养基为对照组。
本实验观察A549细胞和H1299细胞在不同浓度E2、PPT和DPN作用下增殖的变化时,结果显示当E2浓度为10-8mol/L,作用48 h,可以促进A549细胞增殖(P<0.05,见图1)。当PPT作用于A549细胞和H1299细胞24 h,在10-4mol/L和10-5mol/L高浓度下,两种细胞几乎全部死亡(P<0.05),可能由于药物浓度较大时,其毒性作用导致了细胞的死亡;而当其浓度稀释至10-6mol/L后,对增殖没有明显的影响(P>0.05,见图2)。当DPN浓度处于10-6-10-8mol/L时,作用48 h,可以促进A549细胞增殖(P<0.05,见图3)。表明雌激素及ERβ激动剂DPN对A549细胞增殖的促进作用具有浓度依赖性和时间依赖性。
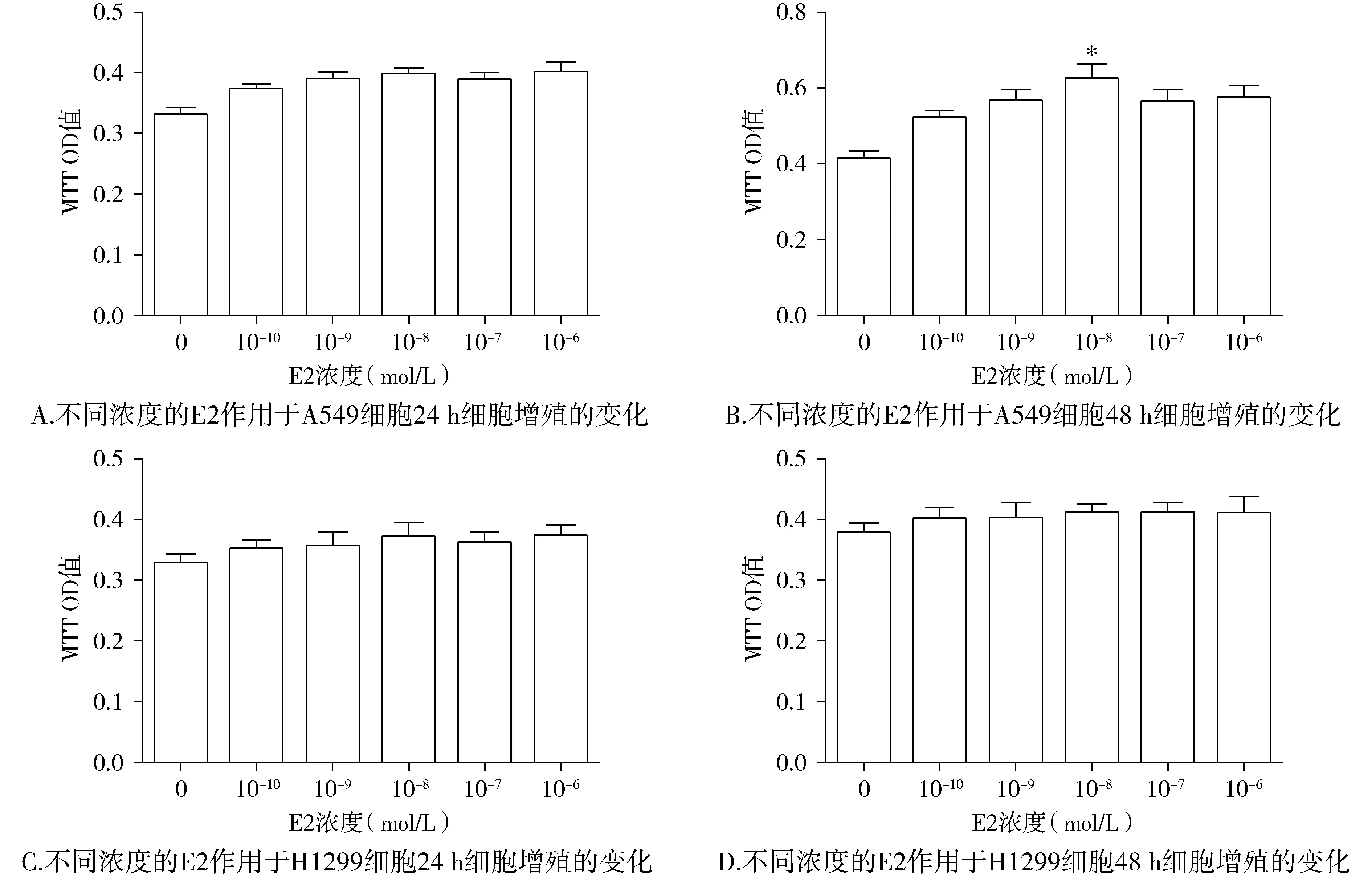
与对照组相比,*P<0.05图1 不同浓度的E2对A549细胞和H1299细胞增殖的影响Figure 1 The effect of E2 on proliferation of A549 and H1299 by MTT assay
2.2 雌激素及其α和β受体激动剂对肺癌细胞克隆形成能力的影响
根据已有的MTT实验结果,并结合参考文献,选择E2、PPT、DPN的作用浓度均为10-8mol/L,以此作为给药剂量,且以未添加相应试剂的无血清培养基为对照组。在接种细胞14 d后,对各组细胞形成的克隆进行计数,结果显示:E2和DPN对A549细胞作用48 h,可以显著提高细胞的克隆形成能力(P<0.05,见图4)。而E2、PPT、DPN对H1299细胞的克隆形成能力没有明显的影响(P>0.05,见图5)。表明E2和DPN均可提高A549细胞的克隆形成能力。
2.3 雌激素及其β受体激动剂对肺癌细胞凋亡和细胞周期的影响
通过上述实验,我们发现在体外,E2和DPN均可以促进A549细胞的增殖,而E2、PPT和DPN对H1299细胞的增殖并未发挥明显的促进作用。为进一步探索雌激素和DPN如何影响A549细胞增殖的机制,我们利用流式细胞仪分别检测加E2和DPN后对A549细胞的凋亡和细胞周期的影响,以无血清培养基为对照组。
经统计学分析,E2和DPN并未影响A549细胞的凋亡,E2组、DPN组、对照组凋亡率分别为1.5%±0.8%,1.6%±0.6%,1.8%±0.5%,差异无统计学意义(P>0.05,见图6)。E2和DPN可以使A549细胞处于G1期的比例减少,而处于S期的细胞比例增加,差异有统计学意义(P<0.05,见图7,表1)。提示E2和DPN能够促进细胞G1-S周期进程,提高细胞增殖能力。
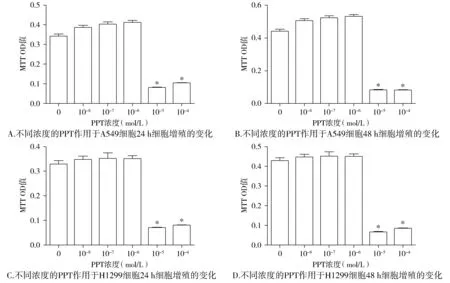
与对照组相比,*P<0.05图2 不同浓度的PPT对A549细胞和H1299细胞增殖的影响Figure 2 The effect of PPT on proliferation of A549 and H1299 by MTT assay

与对照组相比,*P<0.05图3 不同浓度的DPN对A549细胞和H1299细胞增殖的影响Figure 3 The effect of DPN on proliferation of A549 and H1299 by MTT assay
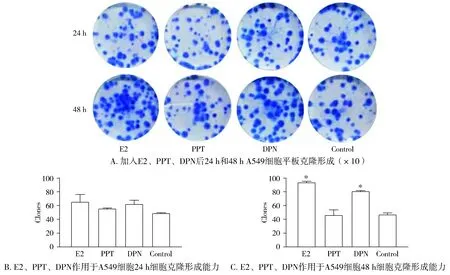
与对照组相比,*P<0.05图4 E2、PPT、DPN对A549细胞克隆形成能力的影响Figure 4 The effects of E2, PPT and DPN on colony forming abilities of A549 cells
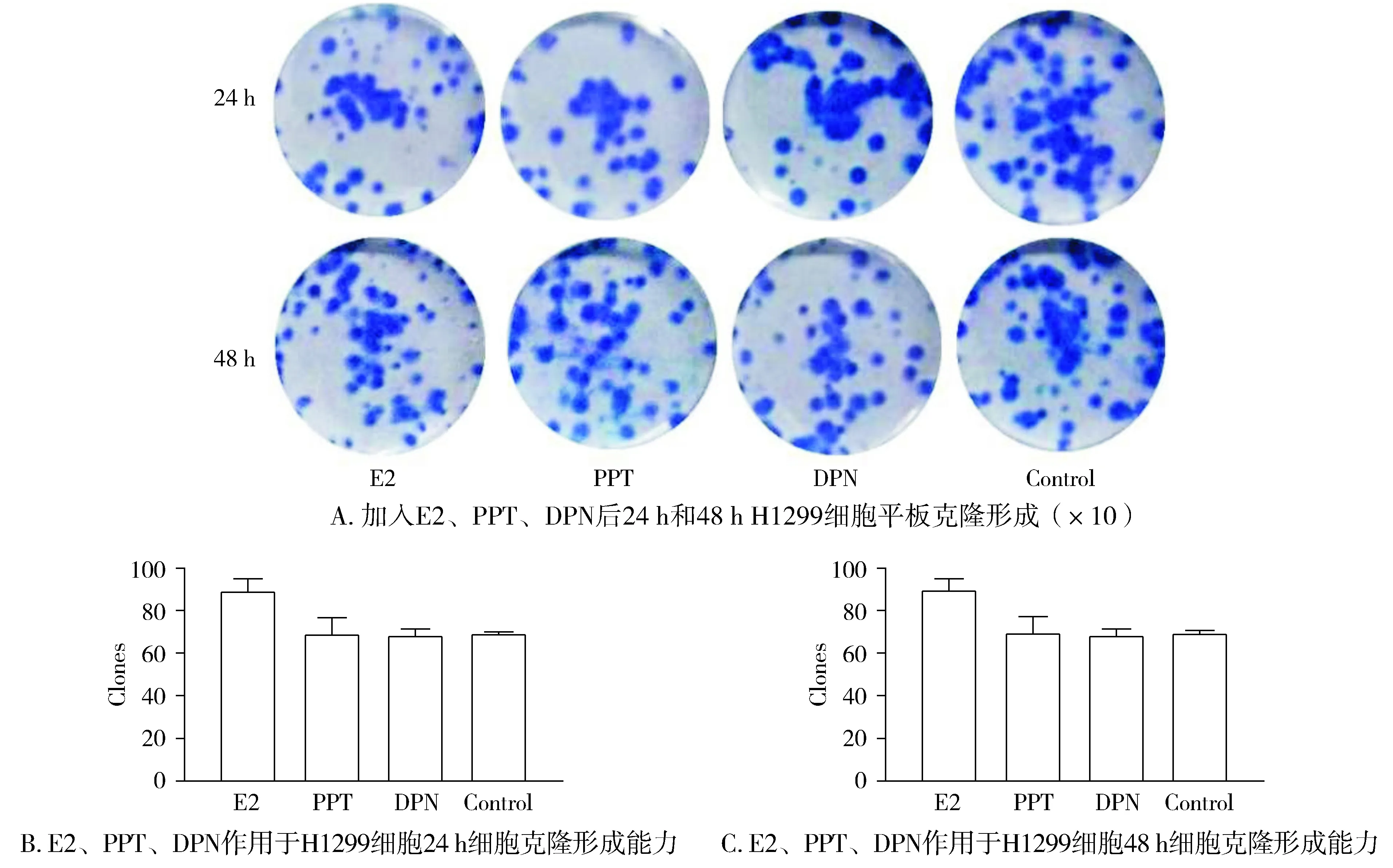
图5 E2、PPT、DPN对H1299细胞克隆形成能力的影响Figure 5 The effects of E2, PPT and DPN on colony forming abilities of H1299 cells
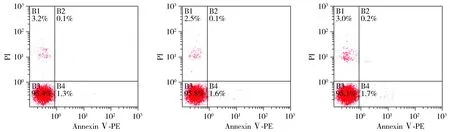
A. E2组 B. DPN组 C.对照组图6 E2和DPN作用24h对A549细胞凋亡的影响Figure 6 Effects of E2 and DPN on apoptosis of A549 cells
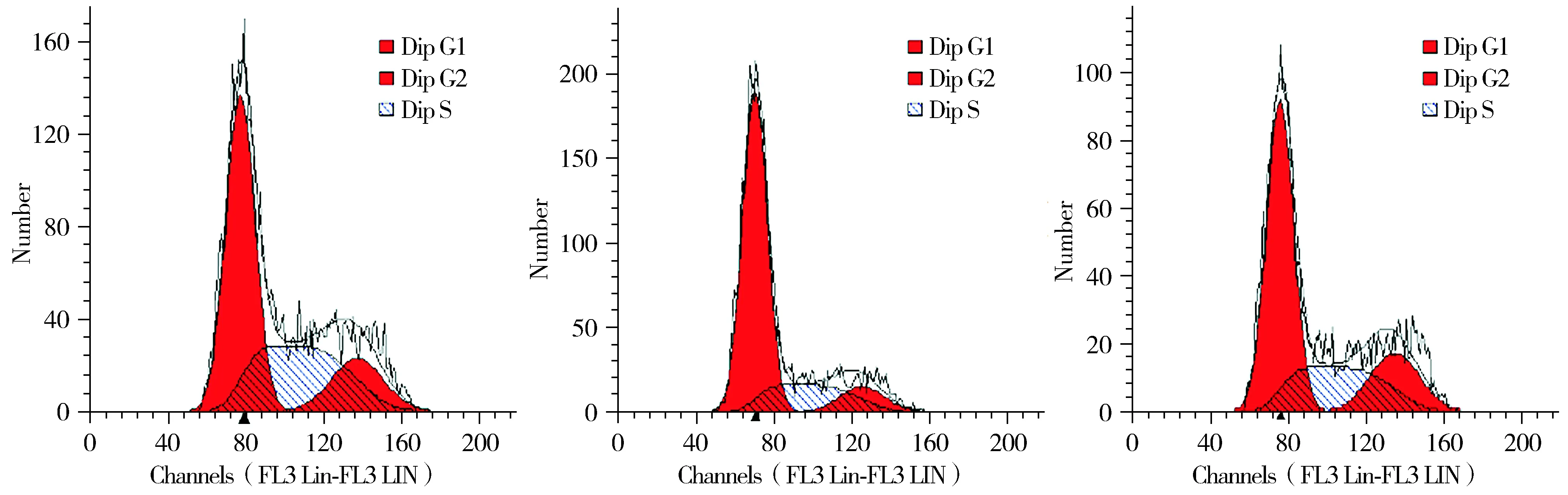
A. E2组 B. DPN组 C.对照组图7 E2和DPN促进A549细胞G1-S周期进程Figure 7 E2 and DPN promoted G1-S phase of A549 cell cycle
表1E2和DPN对A549细胞G1-S周期的影响
Table1EffectsofE2andDPNonG1-SphaseofA549cellcycle

组别G1期S期G2期E2组50.98±3.3∗33.71±2.6∗15.31±1.8 DPN组55.43±4.1∗26.05±3.5∗18.62±1.9对照组70.03±3.220.10±2.29.67±1.5
与对照组比较,*P<0.05
3 讨论
雌激素是一类非常重要的甾体类性激素,通过与其不同的受体结合形成E2/ER复合物,从而促进机体的生长发育和维持多系统器官的功能。ER主要表达于子宫、脑、肝脏、卵巢、乳腺、男性生殖系统、肺以及骨骼组织。ER作为核受体蛋白超家族中的重要一员,主要和小分子疏水配体结合,主要包括ERα、ERβ两种亚型[6]。
根据文献报道,肺癌尤其是非小细胞肺癌,雌激素与其发生和进展紧密相关。与正常肺细胞相比,肺癌细胞含有大量的ER[7]。ERα和ERβ具有不同的组织分布。在正常的肺细胞和恶性肺细胞内都发现了ERβ。但是,ERα却在正常肺细胞里很少存在,而是在肺癌细胞内大量存在[8]。虽然ERα和ERβ识别相似的靶DNA序列,对E2的应答也相似,但它们对DNA的亲和力以及配体识别的特异性有所不同。而且在不同肿瘤中,发挥作用的ER也有所不同[9]。此外,在共表达ERα和ERβ的组织中,ERα的转录活性比ERβ略强,但ERβ具有减弱ERα的作用[10]。那么,雌激素在非小细胞肺癌细胞增殖中又是通过与哪个受体结合后发挥作用呢?
针对这一问题,本研究通过MTT实验筛选出了雌激素(E2)、ERα激动剂(PPT)和ERβ受体激动剂(DPN)对肺癌细胞系A549和H1299的有效作用浓度和作用时间。结果显示:E2和DPN可以促进A549细胞的增殖,而对H1299的增殖没有影响。PPT在高浓度时,可严重抑制这两种细胞的增殖,低浓度时则无明显作用。平板克隆形成实验的结果提示,E2及DPN促进A549细胞的增殖,而对H1299细胞不具有类似的作用;而PPT对两种细胞的增殖无明显的促进作用。流式细胞术结果提示E2和DPN通过促进细胞G1-S周期进程,提高细胞增殖能力。
综上,E2是通过ER起作用,当ERβ被激活时,可以促进A549细胞增殖,而激活ERα对A549细胞则没有任何相应的作用,所以本研究的结果提示E2激活ERβ后可促进A549细胞在体外的增殖。这为探索肺癌的发病机制以及寻找新的治疗靶点提供了实验依据。

