辽东山区典型人工针叶林土壤细菌群落多样性特征
邓娇娇,周永斌,殷 有,魏亚伟,秦胜金,朱文旭,*
1 沈阳农业大学林学院,沈阳 110161 2 中国森林生态系统监测网络辽宁辽河平原森林生态系统定位研究站,昌图 112500
人工林是辽东山区典型的植被类型之一,20世纪50年代以来,由于人类生产生活对木材需求的不断增加,该地区原始森林被逐渐砍伐破坏,大量红松阔叶林转化为落叶松(Larixolgensis)和红松(Pinuskoraiensis)人工纯林,随着天然阔叶林被人工林取代,加上造林后管理措施的影响,土壤微生物群落结构、种群多样性及功能会随着土壤质量发生改变,进而反映出一个生态系统土壤受损程度或恢复潜力。提高人工林的生态功能,维持高效的人工林生态系统一直是当前该地区的重要任务,针对不同人工林,对土壤微生物群落结构变化进行监测,可为实现退化土壤生态系统恢复和人工林可持续经营提供理论基础,而目前有关辽东地区土壤微生物群落结构、多样性对不同人工林类型变化的响应方面较少。因此,研究该区不同人工林生态系统中土壤微生物的变化规律对认识生态系统恢复具有重要意义[1]。
土壤微生物是土壤生态系统的重要组成部分[2],参与有机质分解、养分元素循环以及能量转换[3-5],在维持生态系统生产力、功能及稳定性等方面起着重要作用[6-7],是衡量土壤质量和生产力的关键指标[8]。因此,研究土壤微生物对了解土壤质量保育、土壤元素周转具有重要意义。在土地覆被过程中,气候因子、土壤特性、植被群落结构和多样性都会影响土壤微生物群落结构[9-10]。同一气候条件下,植被类型是影响土壤微生物群落的重要因素[11],不同植被类型凋落物的质量和根系分泌物差异较大,进而对土壤微生物群落产生影响[12]。有研究表明,不同树种会对土壤微生物生物量、微生物群落结构和微生物活性产生影响[13- 15],阔叶林地土壤微生物的数量远远高于针叶林地[16],不同针叶林土壤细菌群落结构和物种多样性具有显著差异[17],而有关不同针叶人工林对土壤养分及微生物群落的影响机制尚不明确,因此通过研究不同树种土壤细菌群落及土壤养分的关系将有助于提高树种对土壤肥力的改善认识,对管理和调控人工林和土壤生态恢复具有重要意义。
本研究选择辽东山区白石砬子自然保护区立地条件相同的落叶松人工林(LGe)和红松人工林(PKe),以及辽宁省森林经营研究所实验林场立地条件相同的落叶松人工林(LGd)和红松人工林(PKd)为研究对象,通过比较不同人工林土壤养分及细菌群落结构的差异,探索土壤微生物对不同人工林的响应,探明不同树种造林恢复对土壤养分及土壤微生物群落结构的影响,旨在为该区人工林生态系统的经营管理及保护提供理论依据。
1 研究地区与研究方法
1.1 研究区概况
该研究区域位于辽东地区,属温带季风气候,四季分明,年平均气温6.5℃,平均降雨926—1100 mm,无霜期127—140 d,研究区概况见表1。
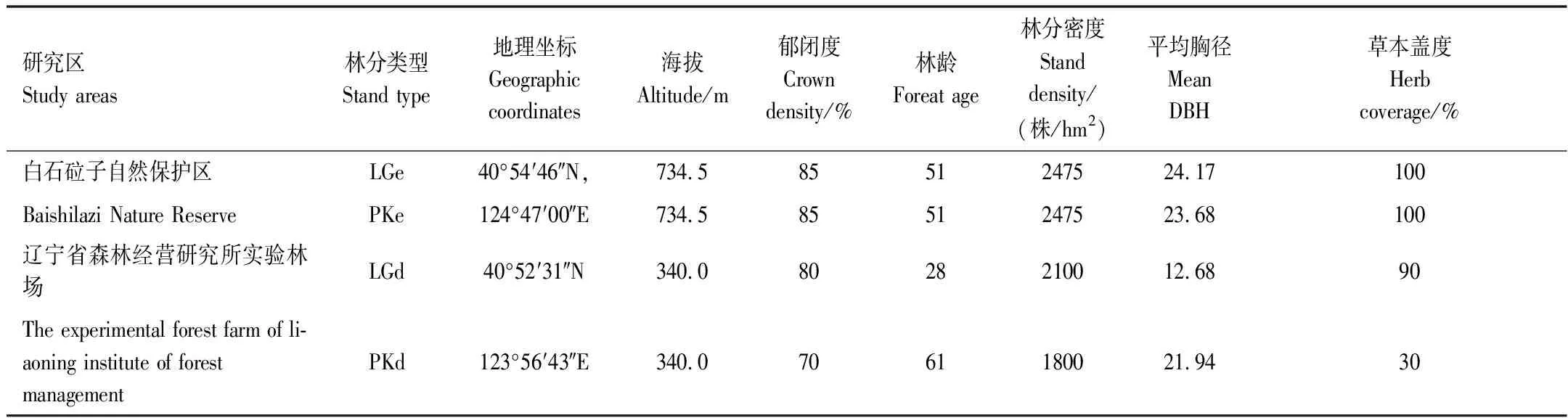
表1 研究区概况
LGe: 白石砬子自然保护区落叶松林,Larixolgensisforests in Baishilazi Nature Reserve; PKe: 白石砬子自然保护区落红松林,Pinuskoraiensisforests in the Baishilazi Nature Reserve; LGd: 辽宁省森林经营研究所实验林场落红松林,Larixolgensisforests in the experimental forest farm of Liaoning Institute of Forest Management; PKe: 辽宁省森林经营研究所实验林场红松林,Pinuskoraiensisforests in the experimental forest farm of Liaoning Institute of Forest Management; Mean DBH: 平均胸径, Mean diameter at breast high.下同
1.2 土壤样品的采集与处理
于2017年8月,在保护区和林场分别选择立地条件一致的红松和落叶松人工林样地,在每种林型下分别设置3块间距大于100 m的20 m×20 m的样方,每个样方内采用S形布点,利用土钻采集15—20个0—10 cm土层样品,以“四分法”取得约1 kg重量的鲜土作为1个土样,将其混匀装入无菌的自封袋中,做好标记后密封放入冰盒中,将其带回沈阳农业大学森林生态实验室。去除土壤样品中的植物残根和石砾等杂物,研碎混匀,过2 mm筛,一部分土样置于-80℃冰箱进行保存,以供进行微生物测序分析,一部分土壤样品在室温下风干,研磨、过筛,用于土壤理化性质的分析。
1.3 土壤DNA提取纯化
土壤总DNA 使用美国OMEGA公司的 MoBio PowerSoil® DNA Isolation Kit(MP Biomedicals,Santa Ana,CA,USA)试剂盒,每个样品称取约0.5 g新鲜土壤,按照试剂盒提取步骤进行。用1%的琼脂糖凝胶电泳检测提取DNA的纯度和完整性,用核酸定量仪NanoDrop ND- 1000(Thermo Fisher Scientific,Waltham,MA,USA)检测提取 DNA 的浓度和纯度。
1.4 细菌16S rRNA序列的扩增测序
用引物338F(5′-ACTCCTACGGGAGGCAGCA- 3′)和806R (5′-ACTACHVGGGTWTCTAAT- 3′)扩增细菌16S rRNA基因的V3—V4区。PCR反应体系24 μL包括:缓冲液5 μL,Q5高保真缓冲液5 μL,0.25 μL高保真DNA聚合酶(5 U/μL),dNTP(2.5 mmol/L) 2 μL, 上下游引物(10 μmol/L)各1 μL,DNA模板2 μL,最后加入超纯水(ddH2O)8.75 μL。PCR 扩增条件为:98 ℃预变性2 min,98°C变性15 s,55°C退火30 s,72°C延伸30 s,25个循环;最后72℃延伸5 min。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收,回收采用AXYGEN公司的凝胶回收试剂盒。采用Illumina公司的TruSeq Nano DNA LT Library Prep Kit制备测序文库。
1.5 生物信息学和统计分析
对下机原始数据进行质量控制,用软件QIIME 18.0对原始序列进行过滤、拼接、去除嵌合体[18],并对序列长度进行筛选。然后将有效数据进行归类操作,通过归类操作,将序列按照彼此的相似性分归为许多小组,一个小组就是一个OTU。对OTUs进行丰度指数和多样性指数等分析,包括群落丰富度Chao1指数和ACE指数,群落均匀度的Shannon指数和Simpson指数。利用Metastats对门水平和属水平的群落分类学组成和丰度进行分析[19]。
1.6 数据分析
数据用Excel 2010进行处理,统计分析采用SPSS 19.0处理,单因素方差分析(one way ANOVA,Lsdt-test)用于不同处理间的差异显著性校验,皮尔逊相关系数(Pearson correlation coefficient)用于评价土壤理化性质与土壤细菌群落间多样性的相关性,以及优势细菌类群与土壤环境因子的相关性。使用Canoco 4.5软件对土壤环境因子和细菌群落进行冗余分析(Redundancy analysis,RDA)。
2 结果与分析
2.1 不同人工林土壤理化性质
本研究调查了两个研究区,共四个样地土壤理化性质,LGe和PKe土壤pH、全碳、全氮、碱解氮和C/N都无显著差异(表2)。LGd和PKd的土壤pH值和C/N无显著差异,但LGd土壤的全碳和全氮的含量都显著高于PKd(表2)。
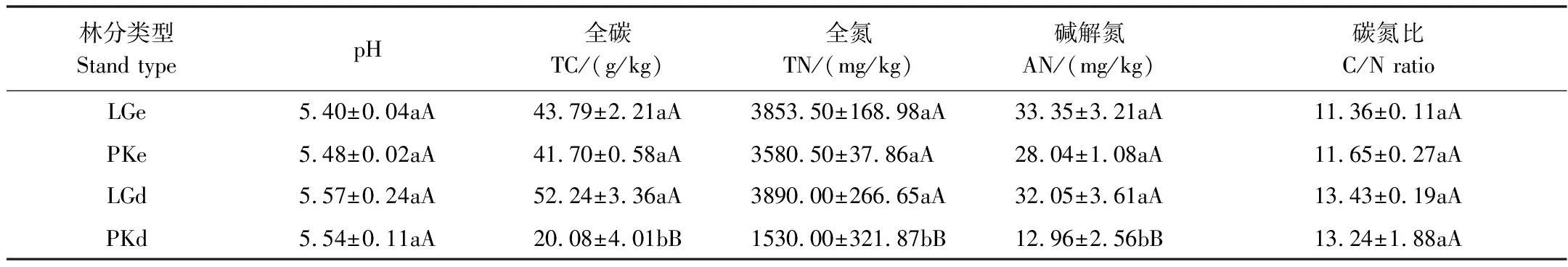
表2 不同处理土壤理化性质
表中数据为平均值±中数标准差,同一行数据不同小写字母表示差异显著(P<0.05),同一行数据不同大写字母表示差异显著(P<0.01);TC:全碳,total carbon;TN:全氮,total nitrogen;AN:碱解氮,available nitrogen
2.2 不同人工林土壤微生物多样性
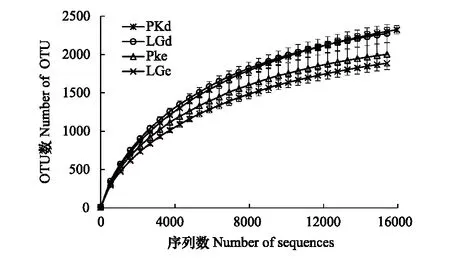
图1 不同处理下土壤细菌群落高通量测序16S rDNA稀疏曲线 Fig.1 Rarefaction curves of 16S rDNA for high throughput sequencing of bacterial under different treatmentsLGe:白石砬子自然保护区落叶松林,Larix olgensis forests in Baishilazi Nature Reserve;PKe:白石砬子自然保护区落红松林, Pinus koraiensis forests in the Baishilazi Nature Reserve;LGd:辽宁省森林经营研究所实验林场落红松林,Larix olgensis forests in the experimental forest farm of Liaoning Institute of Forest Management;PKe:辽宁省森林经营研究所实验林场红松林,Pinus koraiensis forests in the experimental forest farm of Liaoning Institute of Forest Management;OUT:操作分类单元,Operational Taxonomic Units
本研究采用97%的序列相似度作为OTU划分阈值,表3反映了不同分类单元的OTU数,在门分类水平上LGe和PKe分别有1904和2018个OTU,LGd和PKd分别有2289和3334个OTU。如图1所示,曲线随着测得序列数量的增加而趋于平坦,表明实验已获取绝大多数样本信息,已经能够反映森林土壤的微生物群落组成。用QIIME软件分别对每个样本计算Chaos1、ACE、Simpson和Shannon指数。LGe和PKe土壤微生物的Shannon指数、ACE指数、Chao1指数和Simpson指数无显著差异;LGd的Shannon指数和Simpson指数显著高于PKd,而Chao1指数和ACE指数无显著差异(表3)。相关性分析结果显示,细菌的Shannon指数与pH呈显著正相关(r=0.966,P<0.05)(表4),4个处理中LGd土壤pH较高,可能是导致细菌群落结构多样性的主要原因。
2.3 不同人工林土壤细菌群落结构在门水平的分析
在门水平上,LGe,PKe,LGd和PKd共获得34个类群,将平均相对丰度<0.1%类群归类为其他,得到18个类群,平均相对丰度>1%类群共有10个(图2),其中变形菌门(Proteobacteria)(43.11%,40.28%;36.22%,39.77%),酸杆菌门(Acidobacteria)(27.62%,19.19%;11.98%,16.04%),放线菌门(Actinobacteria)(6.99%,8.35%;30.76%,21.25%),绿弯菌门(Chloroflexi)(5.42%,6.50%;5.82%,10.96%),疣微菌门(Verrucomicrobia)(7.23%,4.12%;3.78%,0.65%),芽单胞菌门(Gemmatimonadetes)(2.24%,2.24%;5.19%,6.07%),厚壁菌门(Firmicutes)(0.52%,8.60%;0.64%,0.16%),拟杆菌门(Bacteroidetes) (1.90%,4.60%;2.09%,0.77%),浮霉菌门(Planctomycetes)(2.07%,1.78%;0.94%,1.68%)和硝化螺旋菌门(Nitrospirae) (1.54%,1.75%;1.37%,0.98%)为主要优势类群。采用Metastats方法对LGe和PKe进行比较检验,发现有4个门的相对丰度有显著差异(P<0.05),其中,酸杆菌门(Acidobacteria)具有极显著性差异(P=0.008)(表5)。LGd和PKd土壤变形菌门(Proteobacteria)、放线菌门(Actinobacteria)和酸杆菌门(Acidobacteria)有极显著差异(P<0.01),P值分别为0.008,0.000和0.011,绿弯菌门(Chloroflexi)有显著差异(P=0.033),疣微菌门(Verrucomicrobia)和芽单胞菌门(Gemmatimonadetes)无差异(表6)。
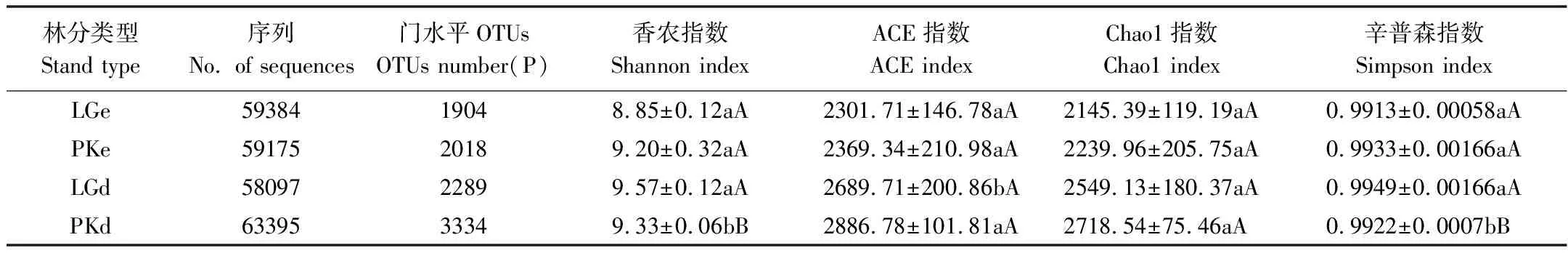
表3 不同处理土壤微生物多样性指数
表中数据为平均值±中数标准差,同一行数据不同小写字母表示差异显著(P<0.05),同一行数据不同大写字母表示差异显著(P<0.01)
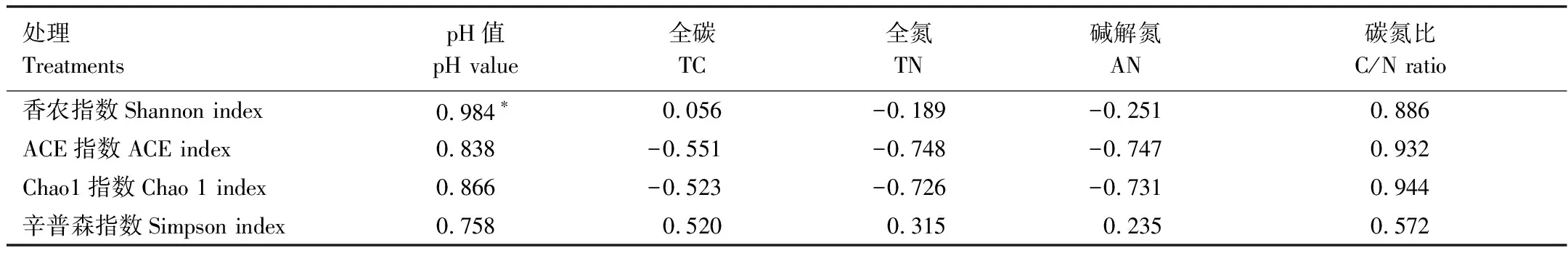
表4 细菌群落多样性与土壤理化性质的Pearson相关性分析
*P<0.05
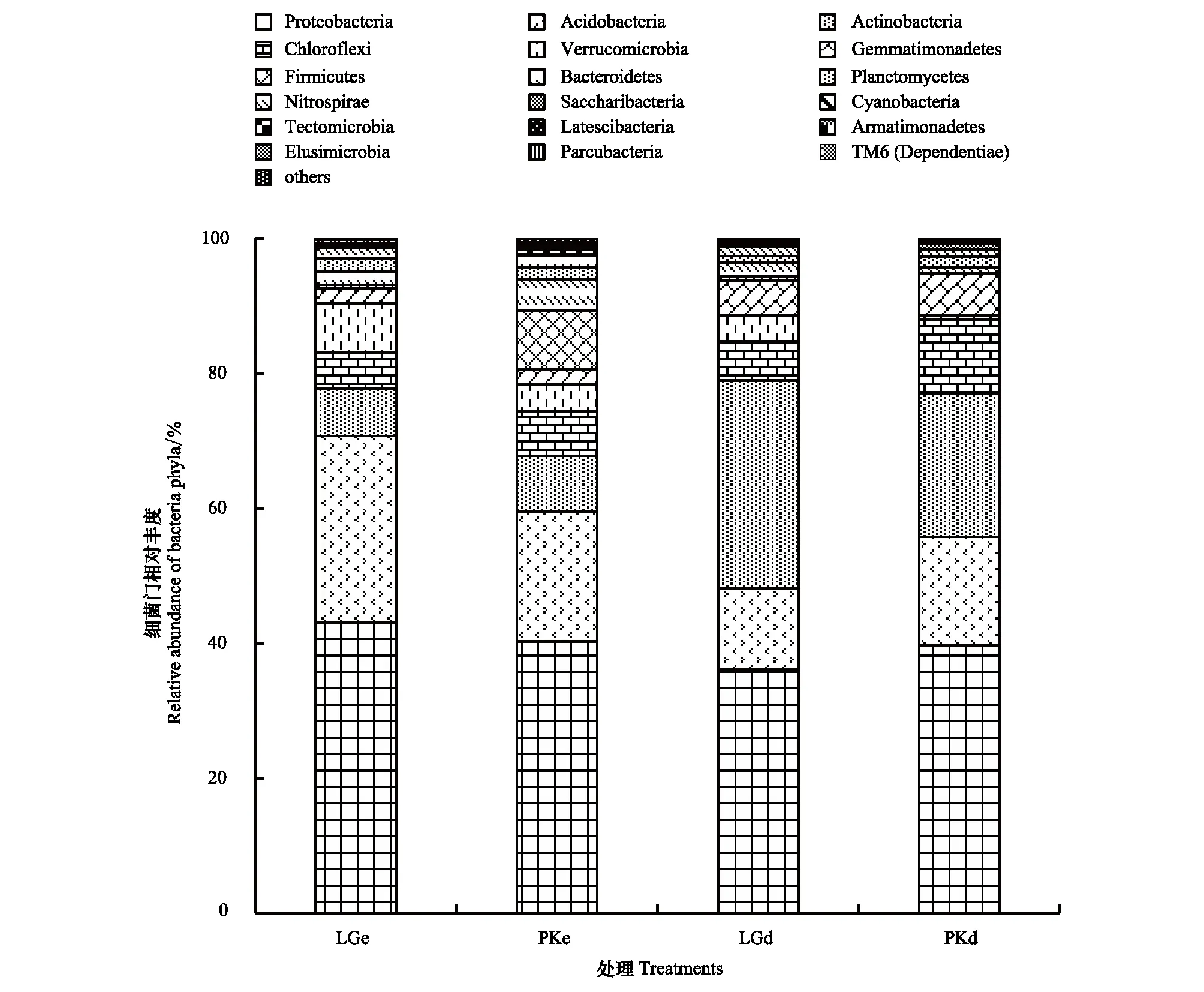
图2 不同处理土壤细菌门水平相对丰度Fig.2 Relative abundance of soil bacteria at the phylum under different treatments

土壤比较类型Comparison of soil type微生物群落门水平Microbial community phylum levelP值P valuePKe-LGe酸杆菌门(Acidobacteria)0.008Saccharibacteria0.028Armatimonadetes0.039GAL150.046
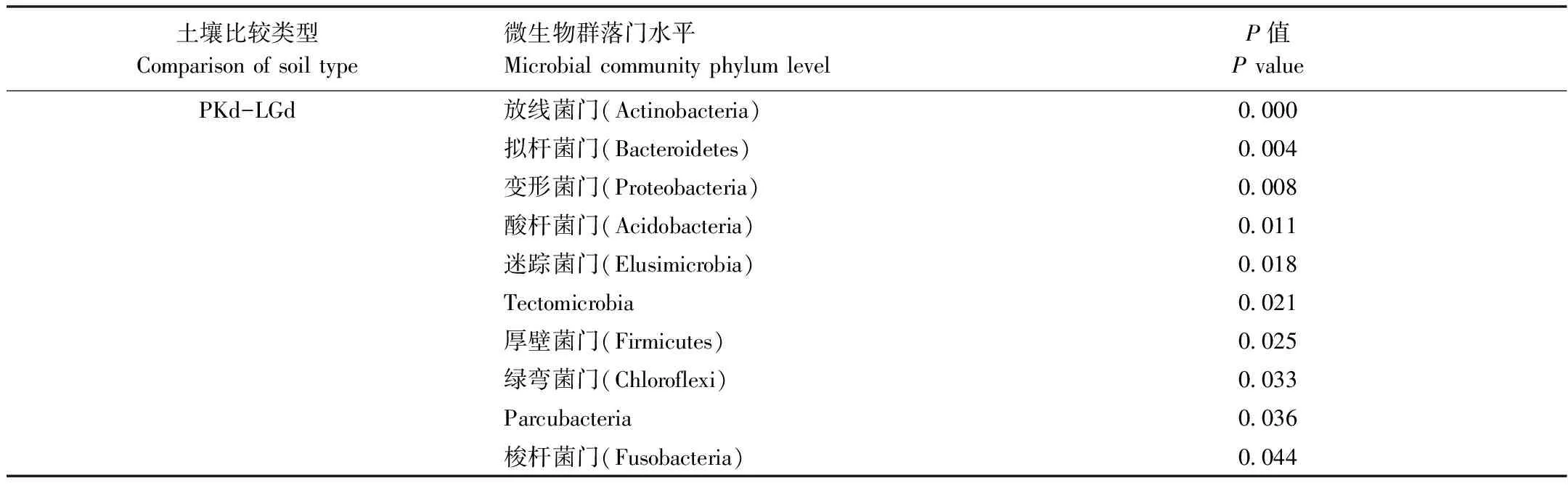
表6 LGd和PKd土壤微生物门水平的Metastats两两比较检验结果统计表
2.4 不同人工林土壤细菌群落结构在属水平的分析
在属水平上,共得到了458个类群。将LGe,PKe,LGd和PKd平均相对丰度<1%类群归为其他,得到19个类群,其他(others)超70% (图3)。其中,有10个优势类群,分别是硝化菌属(Nitrobacter)(4.77%,6.75%;6.18%,4.99%)、CandidatusSolibacter(1.27%,2.37%;5.29%,2.99%)、Pseudolabrys(1.73%,2.98%;3.47%,2.94%)、Variibacter(1.74%,2.93%;1.97%,1.62%)、Bryobacter(0.75%,1.62%;2.80%,1.97%)、Haliangium(1.45%,1.10%;1.55%,1.51%)、红游动菌属(Rhodoplanes)(1.68%,1.69%;0.85%,0.80%)、副球菌(Rhizomicrobium)(0.99%,0.92%;1.52%,1.33%)、芽单胞菌属(Gemmatimonas)(1.55%,1.90%;0.53%,0.74%)和H16(0.74%,0.64%;1,69%,1.16%)。其中,硝化菌属、Variibacter、红游动菌属和芽单胞菌属在样地PKd中占有优势,CandidatusSolibacter、Pseudolabrys、Bryobacter和副球菌属是LGe样地中的优势细菌属。
土壤微生物群落结构在属水平也产生了明显的差异(表7,表8),采用Metastats方法比较检验,发现LGe和PKe有7个属的相对丰度有极显著差异,LGd和PKd有25个属的相对丰度有极显著差异(P<0.01),其中,优势菌群中的硝化杆菌属(Nitrobacter)和Pseudolabrys达到极显著差异(P<0.01)。
2.5 细菌优势菌群与环境因子的相关性
对优势细菌门和优势细菌属相对丰度和土壤环境因子进行冗余分析(图4),结果显示,第1轴和第2轴累积解释变异量分别达94.4%和98.2%。在门水平上,第一排序轴和第二排序轴的特征值分别为0.832和0.112,土壤pH(r=0.9482)和土壤C/N(r=0.9377)与轴1的相关性较大,第1轴解释率达到了83.2%。在属水平上,第一排序轴的特征值为0.755,土壤pH(r=-0.9810)和土壤C/N(r=-8.778)与第1轴的相关性较大,第1轴解释率达到了75.5%,土壤全碳(r=-0.8981),土壤全N(r=-0.9224)和土壤碱解氮(r=-0.8623)与轴2的相关性较大,第二排序轴的特征值为0.227,解释度为22.7%,它们共同解释微生物总方差值的98.2%。由此可见,这两个轴能大部分反映土壤环境因素对土壤微生物群落结构的影响。
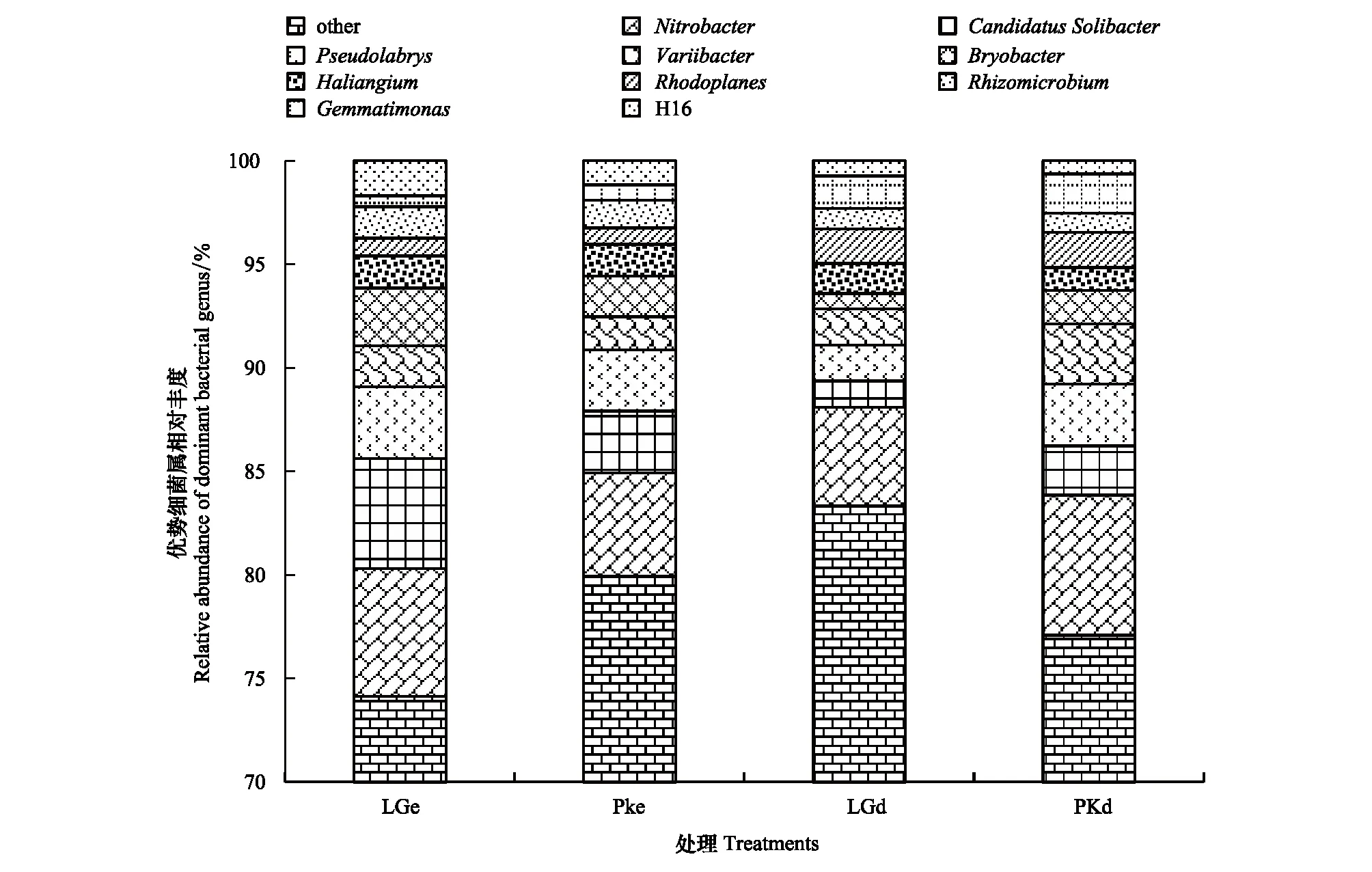
图3 不同处理土壤细菌属水平相对丰度Fig.3 Relative abundance of soil bacteria at the genus under different treatments

土壤比较类型Comparison of soil type微生物群落属水平Microbial community genus levelP LGe-PKeGranulicella0.001Burkholderia-Paraburkholderia0.002酸杆菌属(Acidobacterium)0.004马赛菌属(Massilia)0.004Candidatus.Koribacter0.005Acidibacter0.008Edaphobacter0.008
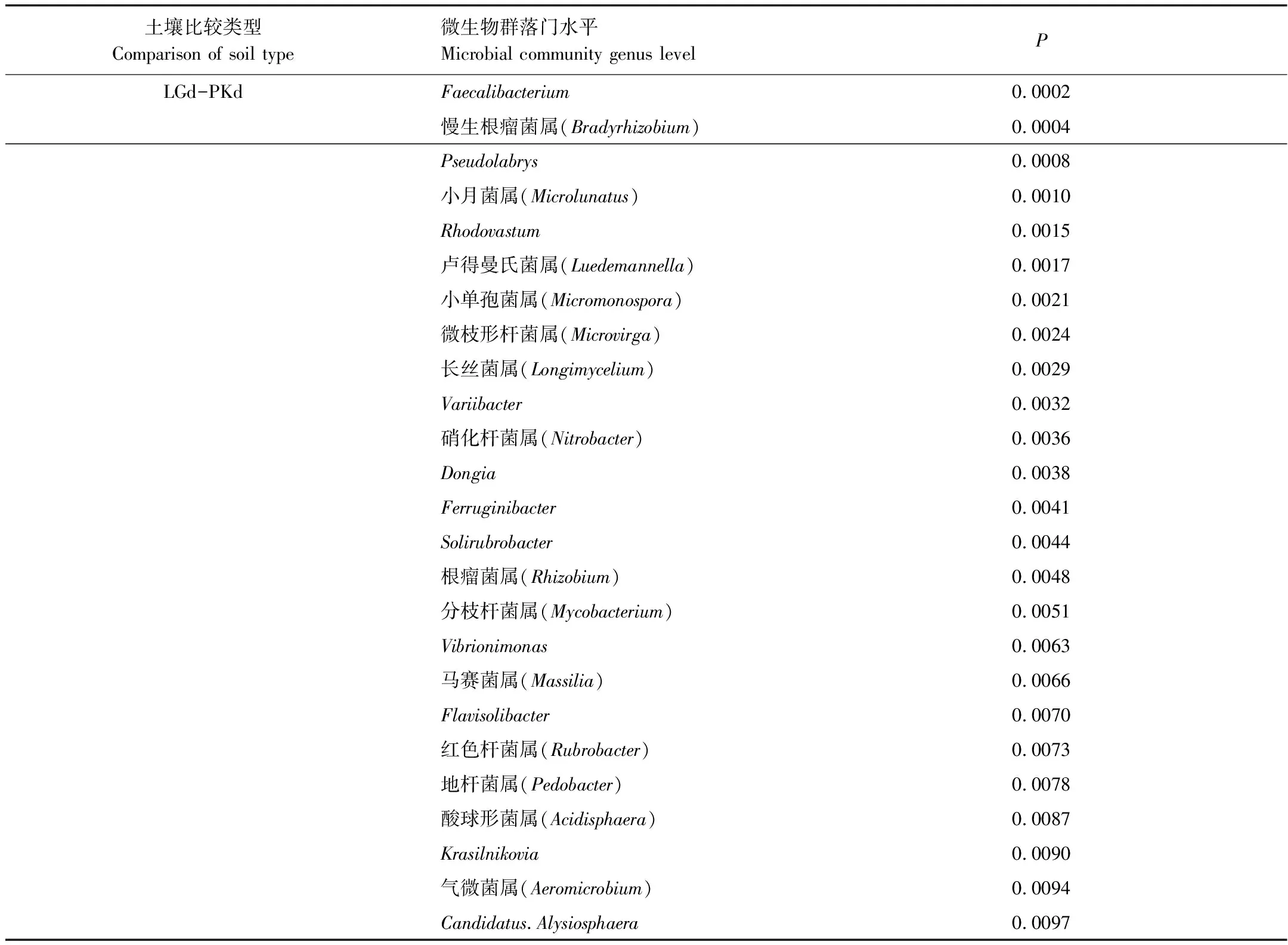
表8 LGd和PKd土壤微生物属水平的 Metastats两两比较检验结果统计表
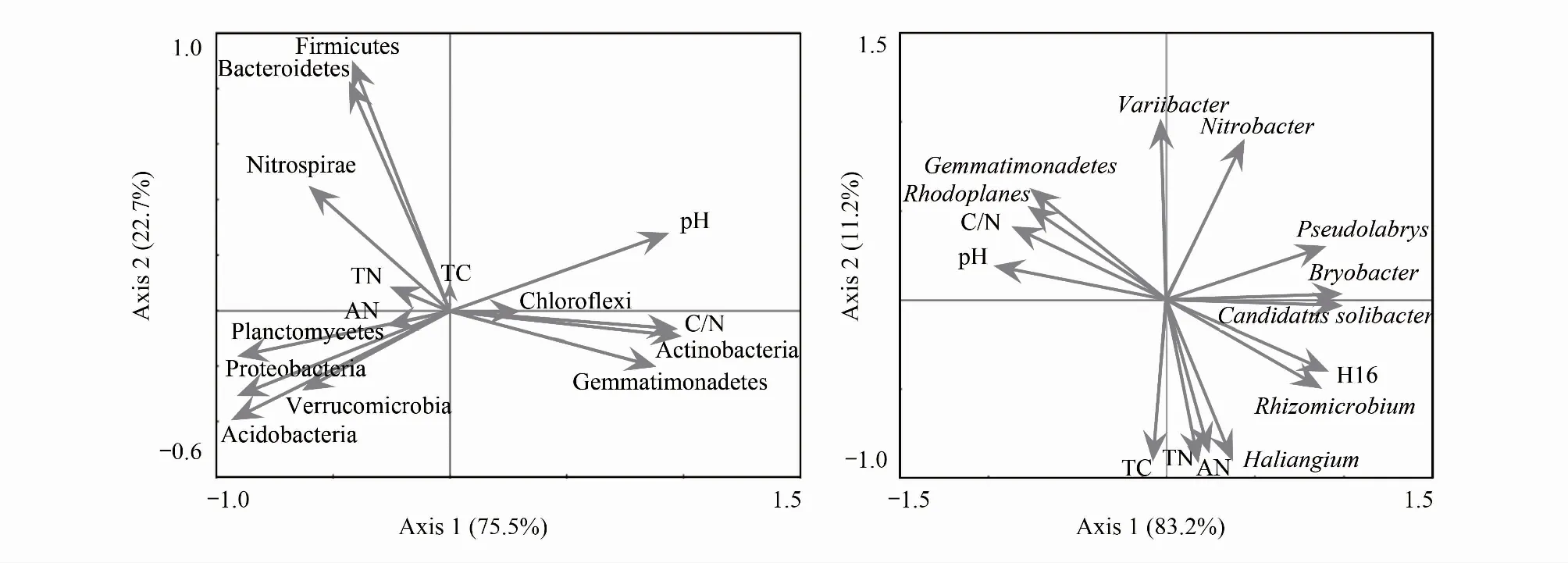
图4 优势细菌门和优势细菌属与土壤环境因子冗余分析Fig.4 Redundancy analysis (RDA) on soil dominant bacteria phyla and soil dominant bacteria genus constrained by soil variablesTC:全碳,total carbon;TN:全氮,total nitrogen;AN:碱解氮,available nitrogen;C/N:碳氮比,C/N ratio
对优势细菌类群和土壤环境因子进行Pearson相关性分析,在门水平上,酸杆菌门平均相对丰度与pH呈极显著负相关(r=-0.990,P<0.01),绿弯菌门与全氮(r=-0.996,P<0.01)和碱解氮(r=-0.997,P<0.01)成极显著负相关,放线菌门(r=0.960,P<0.05)和芽单胞菌门(r=0.962,P<0.05)与碳氮比呈显著正相关。在属水平上,CandidatusSolibacter(r=-0.983,P<0.05),Bryobacter(r=-0.965,P<0.05)和H16(r=-0.969,P<0.05)的平均相对丰度与pH呈显著负相关,Haliangium与全氮(r=0.967,P<0.05)和碱解氮(r=0.955,P<0.05)呈显著正相关,红游动菌属 (r=0.984,P<0.05)和芽单胞菌属(r=0.956,P<0.05)与碳氮比呈显著正相关,副球菌与碳氮比呈显著负相关(r=-0.972,P<0.05)(表9)。
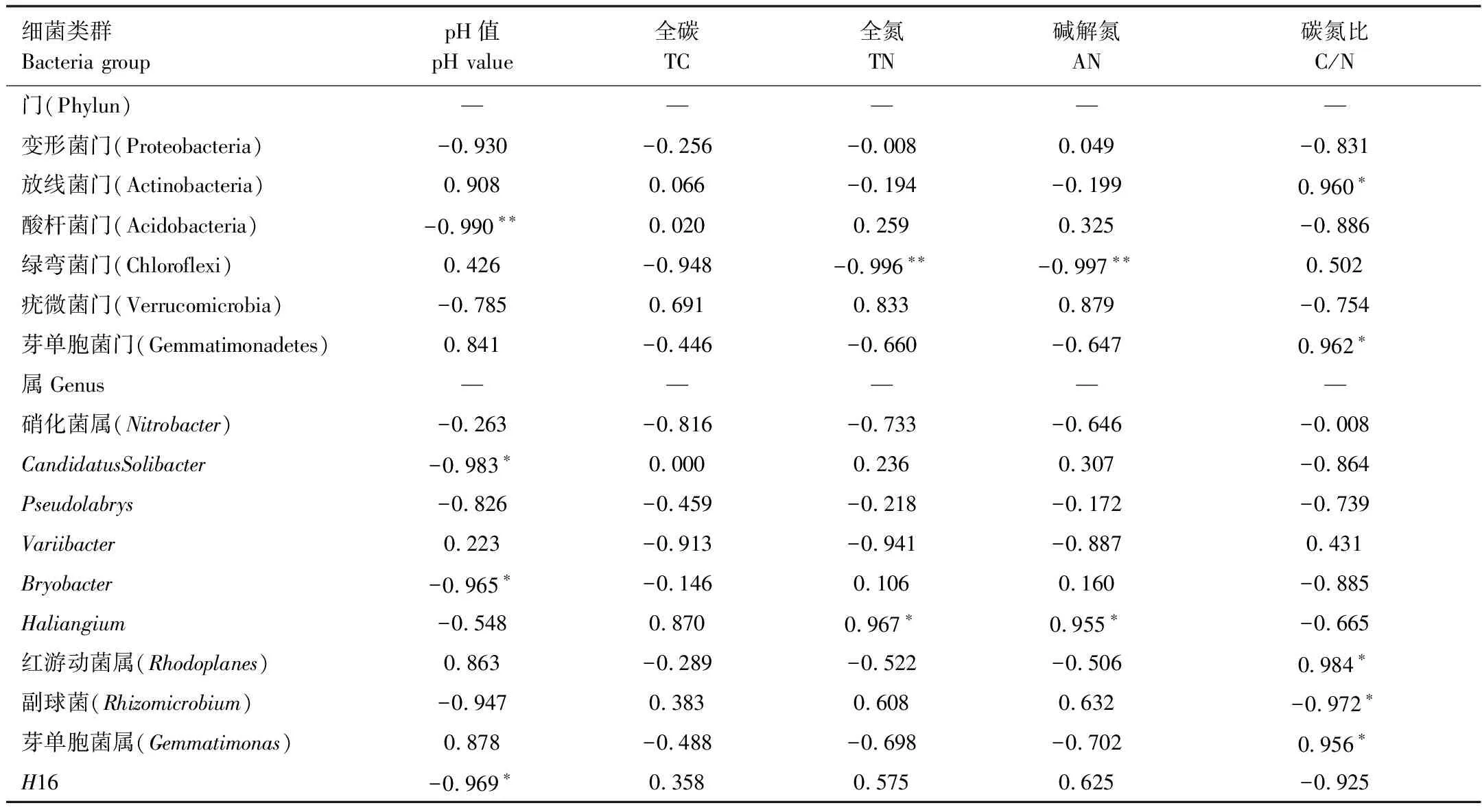
表9 优势细菌类群与土壤环境因子相关性分析
*P<0.05,**P<0.01
3 讨论
不同人工林树种可通过影响林地微环境、凋落物量与分解速率,以及根系的周转等过程,进而对土壤pH、碳、氮有不同程度的影响[20- 21]。本研究显示各研究区域的落叶松人工林土壤pH、全碳、全氮、碱解氮含量都高于红松人工林,其中,LGe和PKe无显著差异,二者提高土壤肥力的效果差异不显著;而LGd显著高于PKd(表2)。土壤中碳、氮和有机质的输入主要来源于凋落物中养分的归还及生物固氮,落叶松属寒温性落叶针叶林,凋落物较多,尽管凋落物中多含木质素、树脂、单宁和蜡质等难以分解的物质,但覆盖于土壤表面密集的针叶凋落物会促使形成空气不流通的环境,有助于土壤养分的积累;相反,红松为温性常绿针叶林,凋落物量较少,土壤养分较为贫瘠。土壤养分与微生物有着密切的联系,土壤碳[22]、土壤氮[23]高低影响着土壤微生物群落。本研究表明,LGe和PKe土壤微生物的多样性指数和丰富度指数无显著差异(表3),Metastats分析结果表明,LGe和PKe在门水平和属水平上丰度显著差异的个数较少(表5,表7),土壤细菌群落结构显示了趋同性。LGd土壤微生物的Shannon指数和Simpson指数显著高于PKd,而Chao1指数和ACE指数无显著差异(表3),且Metastats分析结果表明LGd和PKd在门水平和属水平上丰度显著差异的个数较多(表6,表8)。土壤理化性质的改变对微生物群落的组成和多样性具有重要影响,其中,Shen等[24]研究结果表明,土壤pH是决定微生物多样性和群落组成的关键因素。本研究表明土壤细菌的Shannon指数与pH呈显著正相关(r=0.966,P<0.05)(表4),与Hartman等[25]的研究结果相一致,表明尤其在pH小于6.5的土壤中,微生物多样性随着土壤pH 的降低随之降低。本研究中LGd土壤细菌的Shannon指数和pH都最高,可能与土壤类型、植被类型、管理措施等相关。
土壤微生物在有机质的转换,生物地球化学循环过程中扮演着非常重要的角色[26-28],对地表生态系统[29],植物健康[30-31],土壤结构[32],土壤肥力[33-34]具有重要影响。土壤细菌群落结构的组成在不同人工林树种土壤样中有一定差异,变形菌门、放线菌门和酸酐菌门是该区针叶人工林土壤中优势菌群(图3),与Sun等[35]的研究基本相一致。有研究表明变形菌门和放线菌门主要参与有机质分解[36- 37],绿弯菌门、芽单胞菌门、硝化螺旋菌门和厚壁菌门的相对丰度低,主要进行碳氮的固定[38- 40]。变形菌门和酸酐菌门由于其不同的生活方式,常被用作衡量土壤营养状况的指标[25],已有的研究表明变形菌门的相对丰度与土壤碳含量有正相关关系[41- 42],变形菌门的丰度随着有机质的增加而增加[43],而且在营养较为丰富的土壤中比例更高[44],本研究虽未能证明这一观点,但是本研究中土壤细菌变形菌门是所有处理中的优势菌群,被视为有机质分解转化的主要功能细菌,该研究结果与先前研究结果相一致[45- 46]。酸酐菌门属于嗜酸性细菌门,广泛分布在不同的土壤环境中[47- 49],酸酐菌门的相对丰度能够表明土壤的酸性条件[50- 51]。
以土壤微生物优势类群为原始变量,冗余分析和相关分析表明土壤pH、TN、AN和C/N对细菌群落结构影响显著(图4,表9),这一观点与前人的研究[52- 53]基本一致。冗余分析表明该区针叶人工林土壤微生物细菌群落门水平组成信息中94.4%能够为土壤pH和土壤C/N 两个环境变量所解释,第1轴解释了83.2%的变异信息,第2轴解释了11.2%的变异信息(图4A)。细菌属水平有98.2%的变异信息能够被土壤pH、全碳、全氮、碱解氮和C/N所解释(图4B)。本研究相关性分析表明酸杆菌门与土壤pH呈极显著负相关(表9),与以往的研究结果相一致[54],pH在土壤生物地球化学循环过程中起重要作用,对土壤中理化反应都具有重要的调节作用,是影响细菌分布的重要因子[28,30,55- 56]。本研究属酸性土壤,变形菌门占主要优势,绿弯菌门与全氮和碱解氮成极显著负相关(表9),与Zeng等[57]研究结果相吻合,表明在森林生态系统中,变形菌门较适合生活在酸性土壤中,绿弯菌门在营养贫瘠的土壤中更占有优势。放线菌门和芽单胞菌门的相对丰度与土壤碳氮比呈显著正相关(表9),土壤碳氮比可衡量土壤C、N营养平衡状况,是表征土壤质量的敏感指标,低碳氮比可加快微生物的分解和氮的矿化速率[58]。本研究中辽东山区不同人工林土壤的微生物群落组成的变化与土壤pH、氮素营养、有机质等理化性质有紧密关系,微生物群落的变化是这些环境因子影响的综合反映。
4 结论
辽东山区不同人工针叶林(落叶松和红松)土壤细菌优势门类群主要包括变形菌门、放线菌门、酸杆菌门、绿弯菌门、疣微菌门和芽单胞菌门,土壤pH、全氮、碱解氮的含量以及C/N是本区针叶林细菌群落结构的主要影响因子。就落叶松和红松而言,保护区内两者的土壤有机质和细菌群落多样性无显著差异,表现趋同性,而在实验林场落叶松土壤有机质的含量及微生物群落多样性显著高于红松,落叶松相对更有利于土壤肥力的提高,优化土壤细菌群落结构。综合分析表明,在保护区选择单一树种落叶松或红松造林对改善土壤养分及优化微土壤细菌群落结构无显著差异,而在实验林场选择落叶松更有利于提高土壤肥力。

