米诺环素对大鼠神经病理性疼痛模型中小胶质细胞IL-1分泌的影响
郭云翮
(山西大同大学医学院外科教研室,山西大同037009)
有研究表明,免疫细胞和神经元相互作用介导的神经炎症在神经病理性疼痛中起重要作用[1]。在创伤及炎症模型中,外周神经中发挥作用的免疫细胞是中性粒细胞和小胶质细胞。这些免疫细胞可直接调节白细胞介素-1(IL-1)等细胞因子,从而参与神经病理性疼痛的发生和发展[2]。以往研究证实,米诺环素(MI)可抑制神经病理性疼痛动物模型的发展[3]。因而,本研究目的是评价MI对慢性压迫性损伤(CCI)大鼠神经病理性疼痛模型及小胶质细胞分泌IL-1的影响。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组 雄性SD大鼠,体重180~200 g,购于山西医科大学实验动物中心。将SD大鼠随机分成:Sham+vehicle、CCI+vehicle和CCI+MI组。MI(10、20和40 mg/kg)溶于生理盐水中,在大鼠CCI手术前1h腹腔膜注射,持续到CCI手术后14 d(1次/d)。
1.1.2 实验仪器和试剂 MI和丙酮(美国Sigma公司);ELISA试剂盒(美国Sigma公司);DMEM培养基(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 大鼠CCI模型制备 10%水合氯醛麻醉(150~200 mg/kg)大鼠,在股骨下方约1 cm切开皮肤,然后钝性分离肌肉,在坐骨神经分成三支前主干部位游离神经7 mm左右,在距神经起始处上方2 mm,用线结扎坐骨神经4道。Sham组除结扎坐骨神经,其余程序同CCI组。
1.2.2 机械性刺激痛 CCI模型制备前及制备后1、3、5、7、10和14 d对大鼠进行缩足阈值(Paw withdrawal threshold,PWT)测定。主要采用vonFrey细丝法,vonFrey细丝(1.0~15 g)垂直刺激大鼠后足中央处,持续5~10 s,出现明显缩足、舔足及抬足行为为阳性反应。
1.2.3 冷刺激诱发痛 将丙酮涂到大鼠后足心,每只大鼠双侧后足均检测5次,每次间隔时间为1 min,按照下面的公式计算缩足的频率=缩足次数/5×100%。
1.2.4 小胶质细胞分离 水合氯醛麻醉大鼠,取出脊髓腰膨大部分,用剪刀剪碎,然后加入胰蛋白酶消化,将细胞悬液加入新试管中,吸管吹打,用筛网过滤细胞悬液,加入DEEM培养基,上述混合培养的胶质细胞在培养箱中培养48 h后纯化小胶质细胞。
1.2.5 ELISA分析 对培养的小胶质细胞进行裂解,通过ELISA试剂盒规定的步骤检测细胞中IL-1浓度。
1.2.6 统计学方法 采用SPSS21.0统计软件进行分析,数据以均数±标准差表示,多组间比较采用方差分析,两组间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 机械性痛觉增敏
与CCI手术前比较,CCI手术后3 d大鼠出现很强的痛觉增敏(P<0.01),这种效应持续到研究结束(P<0.001)。Sham组大鼠没有表现出机械性痛觉增敏。与CCI手术前比较,CCI+MI(10、20和40 mg/kg)大鼠也无明显机械性痛觉增敏发生(见图1)。

图1 VonFrey法检测大鼠缩足阈值(PWT)
2.2 冷刺激反应
与CCI手术前比较,CCI手术后3 d大鼠出现疼痛行为(P<0.01),这种效应在研究期间一直存在(P<0.001)。Sham组大鼠没有表现出疼痛行为。与CCI手术前大鼠比较,CCI+MI(10、20和40 mg/kg)大鼠也无显著疼痛行为产生(见图2)。
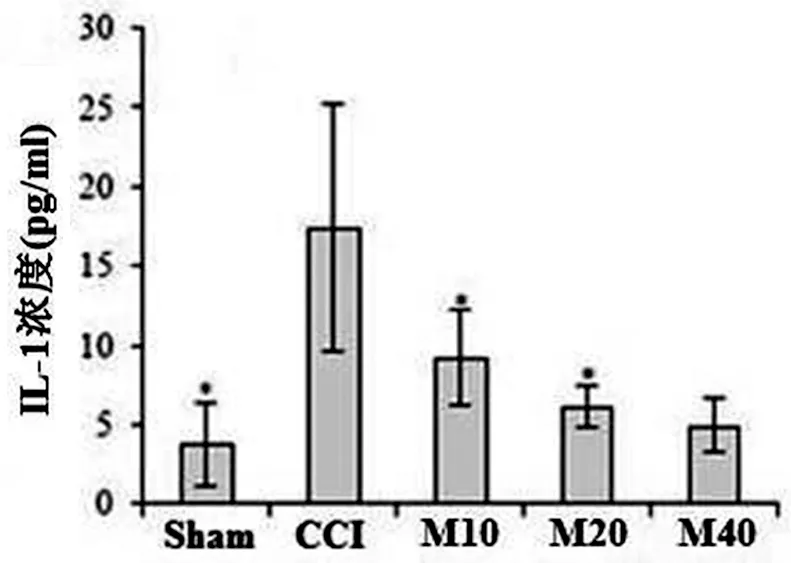
图2 丙酮法检测大鼠缩足频率
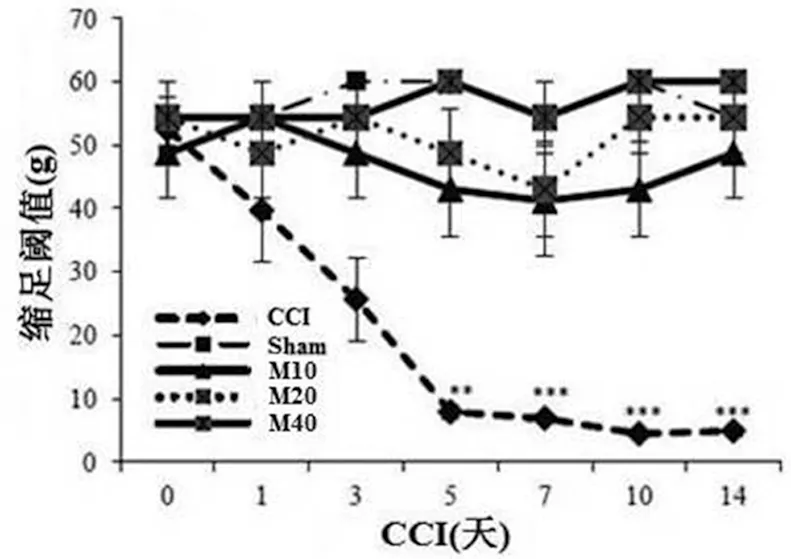
图3 小胶质细胞中IL-1浓度
2.3 小胶质细胞中IL-1浓度
ELISA分析结果显示,与CCI组大鼠比较,MI处理(20和40 mg/kg)CCI大鼠小胶质细胞中IL-1浓度明显降低(P<0.05);然而MI处理(10 mg/kg)大鼠小胶质细胞中IL-1浓度未降低(见图3)。
3 讨论
本研究主要评估MI在CCI诱导大鼠神经病理性疼痛模型中的镇痛作用,并检测分离小胶质细胞分泌IL-1水平。炎性细胞因子在神经病理性疼痛发生中起重要作用。其中受伤部位以及脊髓胶质细胞均可以产生炎性细胞因子。中枢神经系统中炎性介质也是由小胶质细胞释放的[3]。其中细胞因子如TNF-α和IL-1,是由激活的小胶质细胞产生,参与神经元损伤,并引起免疫细胞进入中枢神经系统[4]。神经损伤和/或炎症后,胶质细胞释放的促炎性细胞因子和其他介质促进疼痛传导。小胶质细胞抑制剂在减少疼痛传导方面发挥重要的作用[5]。目前有研究已经试图合成抑制促炎性细胞因子物质。据研究报道,抑制胶质细胞活化的药物可以减少细胞因子释放[6]。抑制不同免疫细胞来源炎性细胞因子可以预防神经损伤后神经性痛。外周神经损伤后脊髓IL-1增加可能参与神经病理性疼痛的发展。坐骨神经损伤诱导病变区域IL-1及其受体上调。上述结果提示,IL-1与神经损伤和疼痛相关,而且在神经病理性疼痛发生中起重要作用[7]。
本研究结果表明,MI(10、20和40 mg/kg)可缓解CCI诱导的大鼠神经病理性疼痛,并且降低培养小胶质细胞分泌IL-1。Amin等[8]人研究指出,炎性细胞因子TNF-α和IL-1β在CCI建立后第3、7和14天表达均增高;而连续7 d腹腔内注射MI(50 mg/kg)可有效降低CCI后第3天和第7天TNF-α、IL-1β的表达。我们的研究结果与上述实验结果均表明,MI可缓解大鼠神经病理性疼痛。
总之,本研究发现,MI作为小胶质细胞抑制剂,可以通过减少CCI诱导神经病理性疼痛,并降低参与神经病理性疼痛的小胶质细胞释放IL-1,从而发挥神经保护作用。

