河蚬扰动对不同质地沉积物中重金属生物有效性与毒性的影响
贾艳霞,尹洪斌,唐婉莹
(1.南京理工大学化工学院,江苏 南京 210094; 2.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008)
随着经济的快速发展和人类活动加剧,含重金属的工业废水和生活废水等的大量排放导致我国地表水面临着严重的重金属污染问题。重金属通过食物链逐级富集,由于其危害的持续性、难降解性以及不可逆转性,受到社会的广泛关注[1-2]。郭朝晖等[3-4]的研究表明,湘江衡阳—长沙段土壤中重金属Cd的平均质量比达2.44 mg/kg,Pb的平均质量比达65.00 mg/kg,分别超湖南省相应土壤重金属背景值[5]7.97和3.69倍。滑丽萍等[6]的研究表明,洱海沉积物中Cr的最高质量比达到130 mg/kg,太湖沉积物中As的最高质量比达到了21.4 mg/kg;滇池中Cu、Zn、Pb、Cd、Ni的平均浓度均已达到了污染水平。林曼利等[7]的研究表明,宿州市部分地区农村地下水中Pb、Ni的平均浓度分别超过GB5479—2006《生活饮用水卫生标准》1.43%和7.14%。
沉积物中的重金属受到复杂的氧化-还原、吸附解析、再悬浮沉降等地球化学过程的影响,当微环境(pH值、溶解氧、氧化还原电位等)发生变化时,沉积物中富集的重金属会释放到上覆水中,造成二次污染[8]。沉积物中重金属的毒性不仅取决于其总量,与其形态也密切相关。Pempkowiak等[9]的研究表明,以还原态、有机质结合态和残留态存在的重金属在通常环境条件下难以被生物吸收利用。Toro等[10-12]认为酸可挥发性硫化物(acid volatile sulfide,AVS)是重金属在沉积物中的重要结合相,在还原环境中,二价重金属能与AVS反应形成低毒化合物或不溶性化合物,因此AVS浓度的大小影响着沉积物中重金属的生物有效性,也决定了重金属的毒性。Toro等[10,13-14]均以同步可提取金属(simultaneously extracted metals,SEM)与AVS的质量摩尔浓度差值bS-A来表示重金属的生物有效性,且 Toro等[10]认为当bS-A<2 μmol/g时, 沉积物中重金属对底栖生物无生物有效性, 反之则表现出生物毒性。
底栖动物以沉积物为栖息地,既是沉积物-水界面的有机组成部分,又是界面附近重要的环境因子[15],其活动会对沉积物-水界面的理化环境产生很大的影响[16]。生物扰动是指栖息在沉积物中的底栖生物的各种活动,如摄食、筑穴、排泄、避敌等[17]。研究[18]发现,生物扰动可以改变沉积物的pH值、氧化还原电位等微环境指标,对沉积物-水界面的物质与能量交换产生影响。在生物扰动作用下,沉积物与上覆水的接触面增大,导致沉积物含氧量增加[19-20],使得沉积物或间隙水中的一些重金属离子氧化成难溶的金属氧化物沉积在底部,从而降低其毒性;但AVS的氧化使原本与AVS结合的重金属被释放出来,导致间隙水中的重金属含量提高。河蚬是我国湖泊沉积物中常见的底栖生物,高密度的河蚬扰动势必会对沉积物-水界面的微环境产生影响,进而影响到沉积物中重金属的生物有效性和毒性,但目前相关研究较少。本文通过研究河蚬扰动对微环境的影响,分析河蚬扰动作用下底泥重金属的生物有效性和毒性的变化特征。
1 材料与方法
1.1 样品采集与制备
采用彼得森采样器在太湖竺山湾(31°12′53″N,120°7′10″E)采集18 kg沉积物样品并将其均匀分为6份,其中3份样品中分别加入质量分数为0、5%、15%的α-纤维素,另3份样品中分别加入质量分数为20%、40%和70%的石英砂,得到6组试验样品,编号分别为S-0、S-A5、 S-A15和S-B20、S-B40、S-B70。
将每组混合均匀的试验样品平均分成4份并填装到直径10 cm、高15 cm的有机玻璃柱中,玻璃柱底部密封,泥面磨平,标明编号后统一放入样品箱内稳定7 d待用。样品准备完成后,沿管柱壁向箱内缓慢加入湖水,保证沉积物-水界面不被扰动。为保证试验结果可信,每组样品都设置两个平行试验,每组试验又分为对照组和扰动组,其中,在扰动组样品中加入10只数量大小及生理状态一致的河蚬,对照组中不加河蚬。河蚬均采集于太湖,单个体长1.1~2.3 cm。采用曝气泵在沉积物-水界面3 cm处进行微曝气,以满足河蚬生存所需氧气。每隔2 d取15 mL 上覆水,21 d后换水,同时注意河蚬的生存情况。在试验结束前2 d,将间隙水平衡(Peeper)装置和薄膜扩散梯度(diffusive gradient in thin film,DGT)装置放于沉积物中。
1.2 分析方法
1.2.1 重金属的测定
取不同性质的沉积物底泥2~3 g于自封袋中,放入冷冻干燥机中干燥,研磨后过直径0.154 mm的筛网。称取0.1 g过筛的干泥样,加入 1 mL 过氧化氢、2 mL 氢氟酸、1 mL 硝酸,放入微波消解炉(Mars6)中消解 4 h,冷却后过滤上清液,取 1 mL 过滤后的上清液稀释到10 mL。用安捷伦电感耦合等离子体质谱仪(7700X)测定其中的重金属含量,相对误差在10%以内,回收率在80%~120%范围内,每个样品重复3次。
1.2.2 AVS和SEM提取与测定
称3 g沉积物于500 mL的广口瓶中。用镊子将装有5 mL碱性乙酸锌(3 %)的玻璃试管倾斜放入广口瓶中,盖上带三通阀的橡胶塞,向瓶中通入1~2 min高纯氮气后,注入15 mL的盐酸溶液(6 mol/L)和2 mL的抗坏血酸溶液(6 mol/L),关闭阀门。4 h后取出试管,用亚甲基蓝比色法测定并计算AVS[21]的质量摩尔浓度bAVS。将广口瓶内的底泥移至离心管中,以6 500 r/min的转速离心10 min,测定上清液中的重金属含量并计算SEM的质量摩尔浓度bSEM及bS-A。
1.2.3 间隙水提取与测定
将Peeper装置和DGT装置插入底泥中,分别平衡48 h和24 h,标记好沉积物-水界面的位置,并记下温度。用去离子水将取出的Peeper板表面泥渍冲洗干净,将液体转移到离心管中并稀释用于测定重金属的含量。同样用去离子水将取出的DGT板表面泥渍冲洗干净,以沉积物-水界面为起点分别向两个方向将吸附膜切成条状,宽度为4 mm,然后将切好的小条吸附膜按顺序放入离心管中,加入1 mL硝酸(1 mol/L)后震荡24 h(180 r/min)获得提取液,测定并计算其中的重金属含量。

表1 不同质地沉积物的理化性质


(a)有机质沉积物 (b)砂质沉积物


(a)有机质沉积物 (b)砂质沉积物
2 结果与分析
2.1 基本理化性质
根据GB15618—1995《土壤环境质量标准》,由表1可知,Ni、Cd、As、Cr、Pb的质量比在一级范围内,Cu、Zn的质量比在二级范围内,属轻度污染。沉积物中Cr、Ni、Cu、Cd、Zn等的质量比随着砂质或者有机质含量的增加逐渐降低。相比于S-0样品,S-A5、S-A15、S-B40和S-B70样品中重金属质量比分别降低了25%~30%、40%~44%、7%~26%和16%~23%。随着有机质含量增加,沉积物的含水率不断降低,而砂质沉积物随砂质含量的增加含水率不断升高。
2.2 河蚬扰动对上覆水中重金属Cd和As的影响
在众多的重金属元素中,Cd和As对生物影响较大,不同样品上覆水中Cd和As的质量浓度变化分别如图1和图2所示。从图1可以看出,随着试验的进行,样品上覆水中Cd的质量浓度越来越高,这说明沉积物中的河蚬扰动可以明显提高上覆水中Cd的质量浓度,并且试验时间越长,影响越大。相比于其对照组中Cd的平均质量浓度,S-0、S-A5、S-A15、S-B20、S-B40和S-B70样品扰动组Cd的平均质量浓度分别增大了9%、6%、9%、4%、2%和12%。从图1还可以看出,不同质地沉积物中的Cd质量浓度存在较大差异,砂质沉积物中上覆水Cd的质量浓度明显高于有机质沉积物,这主要与河蚬的摄食行为有关。 Tessier等[22]认为,河蚬扰动能够显著增强溶解氧在表层沉积物的渗透深度,进而造成了硫化物的氧化;沉积物中Cd主要与硫形成镉硫沉淀(CdS),生物扰动使得沉积物中的AVS氧化,使原本与AVS结合的重金属Cd被释放出来,导致上覆水中重金属Cd含量增加,而好氧型的砂质沉积物相对于厌氧型的有机质沉积物表现得更为明显。
从图2可以看出,随着试验的进行,样品上覆水中As质量浓度越来越低。除S-A5样品外,其余几组样品中的河蚬扰动明显增大了上覆水中As的质量浓度,相比于其对照组中As的平均质量浓度,S-0、S-A15、S-B20、S-B40和S-B70样品扰动组As的平均质量浓度增大了198%、10%、6%、2%和23%。这是由于As在沉积物中通常与Fe/Mn化合物结合成不同的形态,随着试验的进行,沉积物中Fe/Mn含量升高,导致了上覆水As的质量浓度越来越低,而生物扰动促进了Fe、Mn向上覆水释放,使原本与Fe/Mn化合物结合的As被释放出来,导致扰动组上覆水中As的质量浓度高于对照组。

(a)有机质沉积物

(b)砂质沉积物
图3 沉积物间隙水中溶解态Cd的质量浓度

(a)有机质沉积物
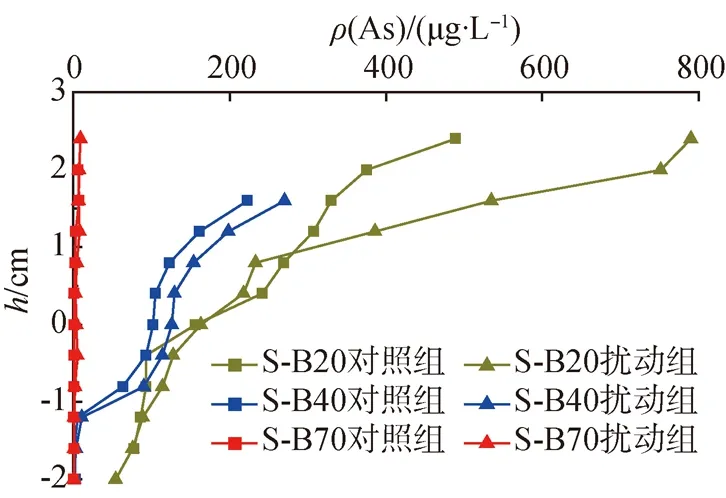
(b)砂质沉积物
图4 沉积物间隙水中溶解态As的质量浓度
此外,从图2可以发现,在砂质沉积物中,河蚬扰动对于As质量浓度的影响较小,试验进行到21 d左右,扰动组和对照组才表现出明显的差别;而在有机质沉积物中,底栖生物对上覆水As的质量浓度影响较大,尤其是原始沉积物(不含有机质)中As的质量浓度变化最为显著,增加了将近2倍。
2.3 河蚬扰动对沉积物中重金属活性的影响
Peeper装置测得的沉积物间隙水中溶解态的Cd和As的质量浓度如图3和图4所示(图中深度h以沉积物-水界面为0界面,沉积物-水界面以上为正值,以下为负值)。由图3可以看出,Peeper装置测得的溶解态Cd的质量浓度为0.01~11.07 μg/L。在不同质地的沉积物样品中,溶解态Cd的质量浓度均随着沉积物深度的增加呈现先增大而后降低的趋势,S-0、S-A5和S-A15样品中质量浓度峰值分别出现在0.8 cm、-1.2 cm和0.4 cm,S-B20、S-B40和S-B70 样品中质量浓度峰值分别出现1.2 cm、0 cm和1.2 cm。与对照组相比,生物扰动均增加了沉积物间隙水中溶解态Cd的质量浓度,其中S-0、S-A5、S-A15、S-B20、S-B40和S-B70样品中间隙水溶解态Cd的平均质量浓度分别是对照组的1.5倍、2.9倍、1.2倍、4.9倍、1.3倍和2.9倍。
在不同质地沉积物样品中,S-0、S-A15、S-B20、S-B40和S-B70样品中溶解态As的质量浓度均随着沉积物深度的增加先减小后趋于稳定;S-A5样品中溶解态As的质量浓度均随着沉积物深度的增加先减小然后趋于稳定,质量浓度峰值出现在1.2 cm。与对照组相比,生物扰动均增加了沉积物间隙水中溶解态As的质量浓度,其中S-0、S-A5、S-A15、S-B20、S-B40和S-B70中间隙水溶解态As的平均质量浓度分别是对照组的1.6倍、2.9倍、1.3倍、1.3倍、1.3倍和1.9倍。
以上结果表明,生物扰动增加了不同质地沉积物间隙水溶解态重金属的质量浓度,这可能是由于生物扰动增加了沉积物-水界面溶解氧的穿透深度,从而导致金属硫化物的氧化,Fe/Mn化合物发生氧化还原反应而释放出与之结合的重金属[23],而随后质量浓度的降低可能是由于缺氧条件导致金属硫化物沉淀[24]。
DGT装置测得的沉积物间隙水中有效态的Cd和As的质量浓度如图5和图6所示,相对于Peeper装置来讲,DGT装置中测得的间隙水中有效态重金属的质量浓度较低,有效态Cd和As的质量浓度分别为0.001~1.302 μg/L和0.001~2.314 μg/L,且有效态Cd和As的质量浓度的变化趋势和Peeper装置测得的基本一致。

图5 沉积物间隙水中有效态Cd的质量浓度

图6 沉积物间隙水中有效态As的质量浓度
DGT装置测得的有效态金属的质量浓度与溶解态金属的质量浓度的比值R反映了金属从固相到液相的释放速率与金属从液相到DGT装置的扩散速率的相对大小。R值接近于1说明重金属从沉积物到间隙水的释放速率相比于重金属从液相扩散到DGT固定凝胶层更快,R值接近0.05说明重金属从沉积物到间隙水的释放速率很慢[25],重金属主要通过在间隙水中的扩散到达DGT膜。由表2可知,As的R值在0.001~0.162范围内,基本都接近0.05,说明As从沉积物到间隙水的释放速率非常慢;Cd的R值在0.067~0.763范围内,说明Cd从沉积物到间隙水的释放速率较快,且Cd从沉积物到间隙水的释放速率在砂质沉积物中最大,在有机质沉积物中最小;而As从沉积物到间隙水的释放速率在原始沉积物中最大,在砂质沉积物中最小,且不同质地的沉积物中扰动组的释放速率大于无扰动组,说明生物扰动能影响沉积物中重金属的活性。
2.4 河蚬扰动对沉积物AVS与SEM的影响
2.4.1 AVS质量摩尔浓度的变化

表3 不同质地沉积物不同深度AVS与SEM的质量摩尔浓度 μmol/g
AVS很容易与金属Cd、Cu、Ni、Pb和Zn络合,因此,沉积物表面中AVS的氧化对沉积物中重金属的生物利用度有很大的影响。试验结束后,将沉积物-水界面以下的沉积物按0~2 cm、2~5 cm分层,分别测其AVS、SEM的质量摩尔浓度,结果如表3所示。可以看出,在砂质沉积物中,AVS质量摩尔浓度为0.170~0.548 μmol/g,2~5 cm沉积物层的AVS质量摩尔浓度大于0~2 cm沉积物层,扰动组的AVS质量摩尔浓度低于对照组,是由于扰动使沉积物含氧量增加,导致AVS被氧化,说明生物扰动改变了沉积物的氧化还原电位;在有机质沉积物中,AVS质量摩尔浓度为0.254~2.174 μmol/g,扰动组AVS质量摩尔浓度也是低于对照组,但 0~2 cm沉积物层AVS的质量摩尔浓度大于2~5 cm沉积物层,这与砂质沉积物中相反,可能是由于河蚬在沉积物中的生活高度不同,沉积物中溶解氧量受生物扰动的影响,进而影响AVS的质量摩尔浓度。
2.4.2 SEM质量摩尔浓度的变化及与重金属生物有效性和毒性的关系
AVS的质量摩尔浓度能直接影响重金属的生物利用度,当沉积物中含有过量的AVS时,其中SEM的质量摩尔浓度可忽略,且对底栖生物无毒害[26-28]。由表3可知,不同质地的沉积物所测得的bSEM在0.190~3.326 μmol/g之间,bS-A的值在-0.578~2.934 μmol/g之间。在砂质沉机物中,只有S-B20扰动组0~2 cm沉积物层中的bS-A大于2 μmol/g。在原始沉积物中,0~2 cm 沉积物层中的bS-A均大于2 μmol/g,表示该沉积物中的重金属具有潜在的生物毒性。在有机质沉积物中,bS-A的值均在2 μmol/g以下,且2~5 cm沉积物层中小于0,说明其对生物不产生毒性。在不同质地沉积物中,扰动组的bS-A的值大于对照组,说明生物扰动能改变沉积物中重金属的生物有效性,增加其毒性。
3 结 论
a. 河蚬扰动使得沉积物中的AVS氧化,使原本与AVS结合的重金属Cd被释放出来,导致间隙水中的重金属Cd的质量浓度增大;扰动也促进了Fe、Mn向上覆水释放,使原本与Fe/Mn化合物结合的As被释放出来,导致扰动组上覆水中As的质量浓度增大。
b. 河蚬扰动使Cd、As的扩散能力增强,增大了其活性,且在砂质沉积物中的活性大于有机质沉积物中的活性。
c. 河蚬扰动可促使沉积物中AVS的质量摩尔浓度降低,进而改变其对沉积物中亲硫金属的结合能力,增强了沉积物中重金属的毒性。

