机器人辅助微创食管切除术的早期肿瘤学控制结果
张晓彬 郭旭峰 李斌 杨洋 茅腾 孙益峰 李志刚
食管癌是常见的消化道恶性肿瘤之一,目前被列为世界第5大恶性肿瘤,病死率居第4位[1]。手术切除是目前食管癌的主要治疗方式。尽管近年来传统开放性食管癌根治术手术方式不断改进,但仍然存在术后创伤大、并发症多、围术期病死率高等问题[2-3]。1992年微创技术开始在食管癌外科治疗中应用[4],即利用胸腔镜或腹腔镜代替开胸、开腹操作[5-7]。目前国内外已有大量的文献证明微创手术相对于开放手术,术中出血量少、术后并发症少、重症监护室(intensive care unit,ICU)监护时间及住院时间短[8-11],并且术后患者在生活质量、身体机能以及疼痛方面可以获得更好的临床结局[12]。但是腔镜辅助食管癌根治术也因其设备缺点未能完全在全球范围内开展流行,主要包括2D成像技术、腔镜器械固定不能灵活操作,以及术者操作位置不舒适性等。
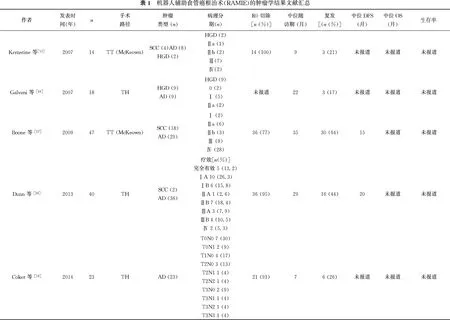
达芬奇机器人手术操作系统(Intuitive Surgical, Sunnyvale, California)因其3D高清成像技术、灵活稳定的机械臂、自动过滤手部颤动以及术者操作舒适位置等优势在胸外科手术中被越来越多的临床医师接受。2003年,Horgan等[13]首先报道了经裂孔路径达芬奇机器人辅助食管癌根治术(robotic assisted minimally invasive esophagectomy, RAMIE)。此后,对于经裂孔RAMIE的报道也集中围绕于近期手术结果和手术技巧。2004年,Kernstine等[14]报道了首例经胸RAMIE。此后,不断有大综合医疗机构报道了经胸RAMIE的经验和疗效。然而大多数文章报道了RAMIE的近期手术结果和围术期安全性,对于中长期生存结果的报道比较短缺。现本文结合文献及本中心经验对经胸RAMIE的肿瘤控制学效果进行报道。表1列出了关于RAMIE肿瘤学结果的主要文献报道[15-27]。
一、 肿瘤复发
Horgan团队[19]在2014年更新了23例行经裂孔RAMIE的患者资料。患者病理类型均为腺癌,其中19例(83%)患者接受了新辅助治疗。30 d内病死率为4%。21例(91%)患者行R0切除,平均淋巴结清扫15枚。中位随访时间7个月,6例(26.1%)患者出现单纯远处复发,18例(78%)患者尚且存活。
2015年,van Hillegersberg等[20]的回顾性研究纳入了108例行机器人辅助McKeown三切口食管癌根治术的患者资料,其中70例(64.8%)患者接受了新辅助治疗,病理结果证实鳞癌20例,腺癌78例,病理完全缓解(pathologic complete response,pCR)10例。102例(94%)患者达到R0切除。中位淋巴结清扫数量为26(5~53)枚,淋巴结转移率为56%。4例患者术后于院内死亡。中位随访时间为58个月,排除5例术后死亡患者,103例患者纳入生存复发分析。51例(49.5%)患者出现了复发转移。复发模式为局域复发6例,远处转移31例,局域复发联合远处转移14例。该研究首次报道了超过100例患者的RAMIE远期生存结果。作者认为RAMIE是安全可行的。在肿瘤学效果上,RAMIE可实现可行的淋巴结清扫和R0切除率。并且RAMIE可实现合适的肿瘤局控效果和较低的局域复发。
Dae Joon Kim教授的团队[24]2017年回顾性分析了115例机器人辅助McKeown食管癌根治术治疗食管鳞癌的结果。R0切除率达95.7%,平均淋巴结清扫数量(49.0±1.9)枚,多数患者(n=84,75.7%)肿瘤T分期为T1期,淋巴结转移率为45.9%。平均随访(32.4±2.2)个月,19例(16.5%)患者出现复发,其中7例患者为区域淋巴结复发,5例为远处转移,7例为区域淋巴结复发联合远处转移。
目前最大样本量经裂孔RAMIE的报道来自Dunn等[26]2017年的回顾性分析研究。该研究纳入了100例接受了经裂孔RAMIE的患者资料,其中恶性肿瘤98例,包括6例鳞癌和92例腺癌;69例患者接受了新辅助治疗;围术期死亡患者2例(2.0%);中位淋巴结清扫17枚;中位随访时间27.7个月。其中41例患者出现复发,复发模式为吻合口复发1例,区域淋巴结复发1例,远处转移38例,未知复发区域1例。
二、 远期生存
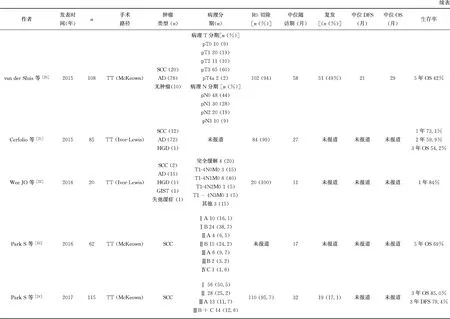
对于机器人辅助Ivor-Lewis食管癌根治术的报道相对较少,且主要围绕近期手术结果开展。关于生存的结果仅有2篇回顾性分析文章提及。Cerfolio等[21]回顾性分析了85例行机器人辅助Ivor-Lewis食管癌根治术的患者资料,其中鳞癌12例,腺癌72例,重度不典型增生(high grade dysplasia,HGD)1例;84例(98.8%)患者达到R0切除;3例(3.5%)30 d内死亡患者,9例(10.6%)90 d内死亡患者;中位随访时间27.4个月,3年总生存时间(overall survival,OS)患者占54.2%。Wee等[22]报道了20例机器人辅助Ivor-Lewis食管癌根治术的结果,其中鳞癌2例,腺癌15例,HGD 1例;所有患者行R0切除,中位随访时间11个月,1年OS患者占84%。
Dunn等[26]对100例经裂孔RAMIE进行回顾性研究,共纳入98例恶性肿瘤患者,中位随访时间27.7个月,中位肿瘤无进展生存期(progression-free survival,PFS) 为41个月,中位OS为54个月,1年和3年OS患者分别占95%和57%。
2015年,van Hillegersberg等[20]的回顾性研究纳入了108例行机器人辅助McKeown三切口食管癌根治术的患者资料,其中70例(64.8%)患者接受了新辅助治疗,病理结果证实鳞癌20例,腺癌78例,pCR10例。中位随访时间为58个月,排除5例术后死亡患者,103例患者纳入生存复发分析,结果显示中位DFS为21个月,中位OS为29个月,5年OS为42%。
来自韩国的一项行机器人辅助McKeown食管癌根治术的回顾性研究[24],共纳入115例食管鳞癌患者,平均随访(32.4±2.2)个月,3年OS和无疾病生存期(disease-free survival,DFS)患者分别占85.0%和79.4%。3年OS在肿瘤病理分期的分层比较中,Ⅰ、Ⅱ、ⅢA、ⅢB/C期分别占94.4%、86.2%、77.8%和37.5%。3年OS患者在N分期的分层比较中,N0、N1、N2期分别占84.4%、80.7%和51.6%。在淋巴结区域效能(efficacy Index,EI)分析中,右侧喉返神经旁和胃左动脉旁淋巴结EI效能最高(14.4和11.8)。
三、 与开放/传统胸腔镜辅助食管癌根治术的对照研究
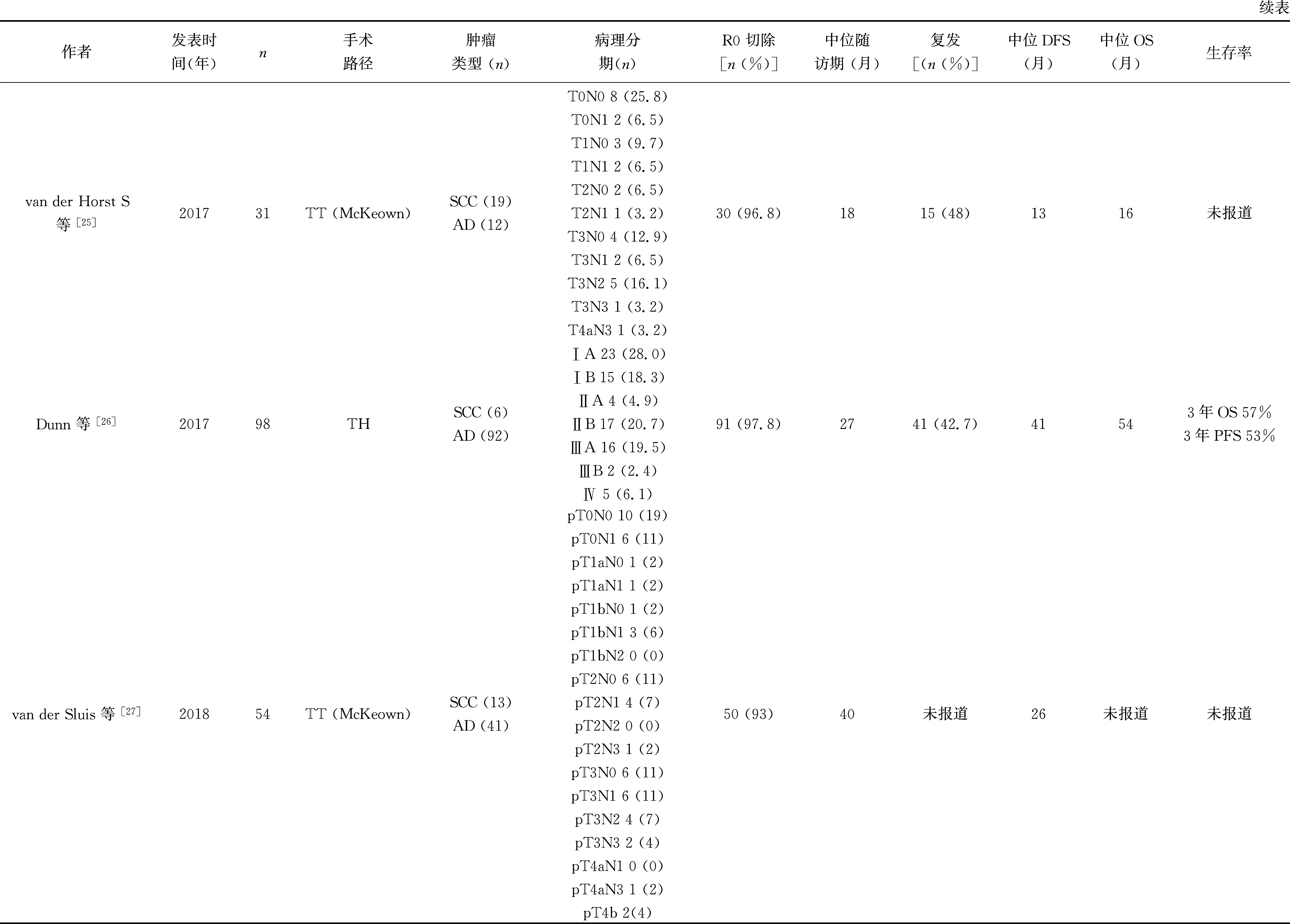
van Hillegersberg团队发起了第一项RAMIE与开放食管癌根治术的单中心前瞻性随机对照研究[28]。2018年,该研究报道了长期生存结果[27]。该研究入组109例患者,其中开放组55例,机器人组54例。该研究的主要终点是手术相关并发症(Clavien-Dindo等级≥2级)发生率。结果显示RAMIE组发生率更低(59%vs80%,P= 0.02)。RAMIE组鳞癌13例,腺癌41例,R0切除率达93%,中位淋巴结清扫数量为27(17~33)枚。RAMIE组2例围术期死亡患者。中位随访时间40个月,中位DFS为26个月,与开放组28个月比较,差异无统计学意义(P= 0.983)。两组OS比较无统计学差异(P= 0.427)。此研究是迄今为止证据等级最高的研究报道,结果显示RAMIE围术期并发症发生率更低,术后生活质量更好,远期肿瘤学结果与开放手术相当。
Park S等[23]比较了RAMIE与传统胸腔镜辅助食管癌根治术在食管鳞癌治疗的远期结果,该共纳入了105例患者,其中RAMIE组62例,胸腔镜组43例。RAMIE组54.8%的患者肿瘤病理分期为Ⅰ期,淋巴结转移率为32.3%,平均淋巴结清扫数量为(37.3±17.1)枚,1例患者于30 d内死亡;中位随访期22个月,两组患者的5年OS患者比例(69%vs59%,P= 0.737)和5年无局域复发率(88%vs74%,P= 0.100)的比较无统计学差异。
2016年,Yerokun等[29]纳入了美国NCDB数据库中4 266例T1-3N0-3M0食管癌患者,包括开放手术2 958例、传统微创食管切除术(minimally invasive esophagectomy,MIE)1 077例和231例RAMIE,结果显示,与开放手术相比,接受传统MIE手术和RAMIE的患者住院时间较短,淋巴结清扫数目数量更高。对于生存情况的比较,依据不同的病理类型分层比较,对于腺癌,开放组与微创组3年OS分别为49.4%和56.7%(P= 0.206);对于鳞癌,开放组与微创组3年OS患者分别占56.3%和54.7%(P= 0.870)。依据手术方式分层分析,对于腺癌,RAMIE组与传统MIE组3年OS的比较无统计学差异(P= 0.783);对于鳞癌,RAMIE组生存率更高,2年OS患者分别占84%和56%(P= 0.034)。
2018年,Espinoza-Mercado等[30]利用美国国家癌症数据库(National Cancer Database, NCDB)纳入了5 553例肿瘤分期为0~Ⅲ期的食管癌患者。其中开放手术3 542例,传统MIE手术1 578例以及433例RAMIE手术。作者对于三组患者分别行1∶1的倾向性得分匹配。结果显示,三组OS比较无统计学差异,开放组、传统MIE组和RAMIE组的中位OS分别为53.9、45.9和58.8个月;并且RAMIE具有潜在生存获益的趋势(HR=0.81,95%CI:0.69~0.95,P= 0.012)。
四、 本中心结果
2015年12月至2017年10月,222例食管鳞癌患者在上海市胸科医院接受了RAMIE。所有患者行机器人辅助McKeown食管癌根治术,并且接受了至少胸-腹两野淋巴结清扫。为进行生存及复发分析,最终入组206例(93.0%)R0切除的患者。
患者基本情况见表2。其中男性164例,女性42例,中位年龄63.5(42~84)岁。肿瘤位置为上段27例,中段134例,下段45例。15例(7.3%)患者接受了新辅助放化疗。

表2 206食管鳞癌患者的基本情况
术后中位住院时间为11(7~85) d。术后主要并发症发生率为肺炎22例(10.7%),吻合口瘘28例(13.6%),喉返神经损伤55例(26.7%)。平均淋巴结清扫(18.5±9.2)枚,淋巴结转移率为48.5%。根据肿瘤病理T分期,T0、T1、T2、T3和T4分别为9例(4.4%)、59例(28.6%)、45例(21.8%)、91例(44.2%)和3例(1.5%)。根据肿瘤病理N分期,N0、N1、N2和N3期分别为106例(51.5%)、66例(32.0%)、29例(14.1%)和5例(2.4%)。根据肿瘤临床病理分期,Ⅰ、Ⅱ、Ⅲ和Ⅳ期分别为50例(24.3%)、68例(33.0%)、82例(39.8%)和6例(2.9%)(表3)。全组无30 d内死亡患者。

表3 206例食管鳞癌患者近期手术结果
中位随访时间24(12~36)个月;176例(85.4%)患者尚且存活,22例(10.7%)患者死于肿瘤复发转移,8例(3.9%)患者死于其他原因;43(20.9%)例患者出现复发,中位复发时间9.7个月;复发模式为吻合口复发3例(1.5%),区域淋巴结复发18例(8.8%),远处转移31例(15.2%)。区域复发患者中,11例(5.3%)出现了纵隔淋巴结复发。患者生存情况见Kaplan-Meier生存曲线(图1和图2)。全组1年和2年OS发生率分别为94.2%和83.2%,1年和2年DFS发生率分别为84.5%和72.4%。分层分析结果显示肿瘤临床病理分期中,Ⅰ、Ⅱ、Ⅲ和Ⅳ期的2年OS和DFS患者分别占100%、88.3%、70.5%和50%(P< 0.001)以及93.9%、78.5%、56.9%和33.3%(P< 0.001)。
本研究的结果显示,RAMIE在食管鳞癌治疗中是安全和可行的,并且可达到较佳的肿瘤学控制效果。全组复发率为20.9%,且区域淋巴结复发率仅为8.8%。2年OS患者占83.2%,尤其对于肿瘤分期Ⅰ期和Ⅱ期的患者,2年OS患者比例高达100%和88.3%。这证实了RAMIE在肿瘤控制以及长期生存获益的潜在可行性。
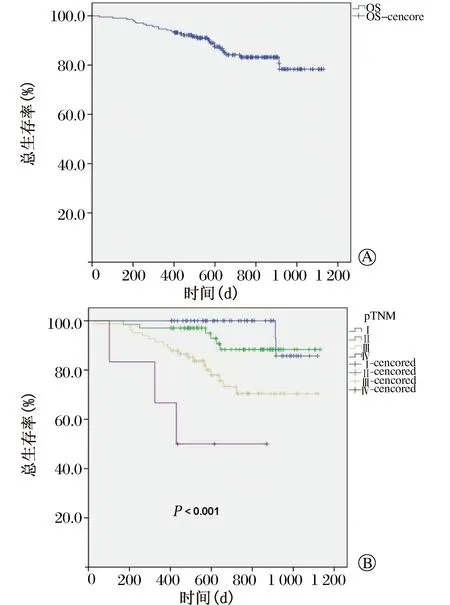
图1 206例食管鳞癌患者总体生存情况。A. 总体生存率;B. 分层分析-pTNM分期
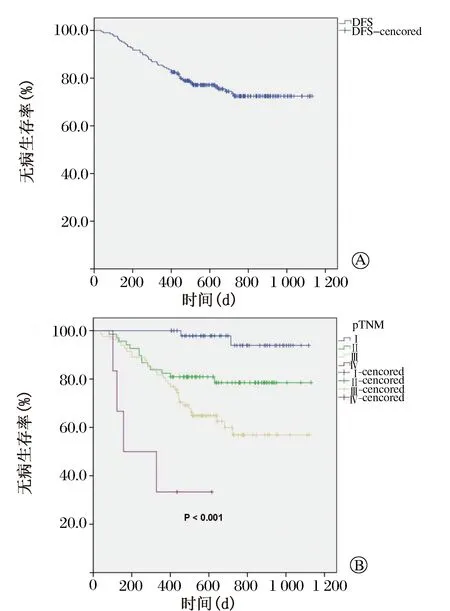
图2 206例食管鳞癌患者无疾病生存情况。A. 无疾病生存率;B. 分层分析-pTNM分期
1 Bray F, Jemal A, Grey N, et al. Global cancer transitions according to the Human Development Index (2008-2030): a population-based study[J]. Lancet Oncol, 2012, 13(8):790-801.
2 Orringer MB, Marshall B, Chang AC, et al. Two thousand transhiatal esophagectomies: changing trends, lessons learned[J]. Ann Surg, 2007,246(3):363-372.
3 Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial[J]. Lancet, 2012, 379(9829):1887-1892.
4 Cuschieri A, Shimi S, Banting S. Endoscopic esophagectomy trough a right thoracoscopic approach[J]. J R Coll Surg Edinb, 1992,37(1):7-11.
5 DePaula AL, Hashiba K, Ferreira EA, et al. Laparoscopic transhiatal esophagectomy with esophagogastroplasty [J]. Surg Laparosc Endose, 1995,5(6):1-5.
6 Nguyen NT, Schauer PR, Luketich JD. Combined laparoscopic and thoracoscopic approach to esophagectomy [J]. J Am Coll Surg, 1999,188(3):328-332.
7 Watson DI, Davies N, Jamieson GG. Totally endoscopic Ivor Lewis esophagectomy [J]. Surg Endosc,1999,13(3):293-297.
8 Nafteux P, Moons J, Coosemans W, et al. Minimally invasive oesophagectomy: a valuable alternative to open oesophagectomy for the treatment of early oesophageal and gastro-oesophageal junction carcinoma[J]. Eur J Cardiothorac Surg, 2011,40(6):1455-1463.
9 Sihag S, Wright CD, Wain JC, et al. Comparison of perioperative outcomes following open versus minimally invasive Ivor Lewis oesophagectomy at a single, high-volume centre[J]. Eur J Cardiothorac Surg, 2012,42(3):430-437.
10 Tsujimoto H, Takahata R, Nomura S, et al. Video-assisted thoracoscopic surgery for esophageal cancer attenuates postoperative systemic responses and pulmonary complications[J]. Surgery, 2012;151(5):667-673.
11 Mu J, Yuan Z, Zhang B, et al. Comparative study of minimally invasive versus open esophagectomy for esophageal cancer in a single cancer center[J]. Chin Med J (Engl), 2014,127(4):747-752.
12 Kauppila JH, Xie S, Johar A, et al. Meta-analysis of health-related quality of life after minimally invasive versus open oesophagectomy for oesophageal cancer[J].Br J Surg, 2017 ,104(9):1131-1140.
13 Horgan S, Berger RA, Elli EF, et al. Robotic-assisted minimally invasive transhiatal esophagectomy[J]. Am Surg, 2003,69(7):624-626.
14 Kernstine KH, DeArmond DT, Karimi M, et al. The robotic, 2-stage, 3-field esophagolymphadenectomy[J]. J Thorac Cardiovasc Surg, 2004,127(6):1847-1849.
15 Kernstine KH, DeArmond DT, Shamoun DM, et al. The first series of completely robotic esophagectomies with three-field lymphadenectomy: initial experience[J]. Surg Endosc, 2007,21(12):2285-2292.
16 Galvani CA, Gorodner MV, Moser F, et al. Robotically assisted laparoscopic transhiatal esophagectomy[J]. Surg Endosc, 2008,22(1):188-195.
17 Boone J, Schipper ME, Moojen WA, et al. Robot-assisted thoracoscopic oesophagectomy for cancer[J]. Br J Surg, 2009,96(8):878-886.
18 Dunn DH, Johnson EM, Morphew JA, et al. Robot-assisted transhiatal esophagectomy: a 3-year single-center experience[J]. Dis Esophagus, 2013,26(2):159-166.
19 Coker AM, Barajas-Gamboa JS, Cheverie J, et al. Outcomes of robotic-assisted transhiatal esophagectomy for esophageal cancer after neoadjuvant chemoradiation[J]. J Laparoendosc Adv Surg Tech A, 2014,24(2):89-94.
20 van der Sluis PC, Ruurda JP, Verhage RJ, et al. Oncologic long-term results of robot-assisted minimally invasive thoraco-laparoscopic esophagectomy with two-field lymphadenectomy for esophageal cancer[J]. Ann Surg Oncol, 2015,22(Suppl 3):S1350-S1356.
21 Cerfolio RJ, Wei B, Hawn MT, et al. Robotic esophagectomy for cancer: early results and lesson learned[J]. Semin Thorac Cardiovasc Surg, 2016,28(1):160-169.
22 Wee JO, Bravo-I?iguez CE, Jaklitsch MT. Early experience of robot-assisted esophagectomy with circular end-to-end stapled anastomosis[J]. Ann Thorac Surg, 2016,102(1):253-259.
23 Park S, Hwang Y, Lee HJ, et al. Comparison of robot-assisted esophagectomy and thoracoscopic esophagectomy in esophageal squamous cell carcinoma[J]. J Thorac Dis, 2016,8(10):2853-2861.
24 Park SY, Kim DJ, Do YW, et al. The oncologic outcome of esophageal squamous cell carcinoma patients after robot-assisted thoracoscopic esophagectomy with total mediastinal lymphadenectomy[J]. Ann Thorac Surg, 2017,103(4):1151-1157.
25 van der Horst S, Weijs TJ, Ruurda JP, et al. Robot-assisted minimally invasive thoraco-laparoscopic esophagectomy for esophageal cancer in the upper mediastinum[J]. J Thorac Dis, 2017,9(Suppl 8):S834-S842.
26 Dunn DH, Johnson EM, Anderson CA, et al. Operative and survival outcomes in a series of 100 consecutive cases of robot-assisted transhiatal esophagectomies[J]. Dis Esophagus, 2017,30(10):1-7.
27 van der Sluis PC, van der Horst S, May AM, et al. Robot-assisted Minimally invasive thoracolaparoscopic esophagectomy versus open transthoracic esophagectomy for resectable esophageal cancer: a randomized controlled trial[J]. Ann Surg, 2018,10.doi: 10.1097/SLA.0000000000003031.
28 van der Sluis PC, Ruurda JP, van der Horst S, et al. Robot-assisted minimally invasive thoraco-laparoscopic esophagectomy versus open transthoracic esophagectomy for resectable esophageal cancer, a randomized controlled trial (ROBOT trial)[J]. Trials, 2012,13:230.
29 Yerokun BA, Sun Z, Yang CJ, et al. Minimally invasive versus open esophagectomy for esophageal cancer: a population-based analysis[J]. Ann Thorac Surg, 2016,102(2):416-423.
30 Espinoza-Mercado F, Imai TA, Borgella JD, et al. Does the approach matter? Comparing survival in robotic, minimally invasive, and open esophagectomies[J]. Ann Thorac Surg, 2018, 9. pii: S0003-4975(18)31440-1.

