含氮煤焦还原NO反应路径研究
, , , ,
(1.安徽工业大学 冶金工程学院, 安徽 马鞍山 243002; 2.安徽工业大学 能源与环境学院, 安徽 马鞍山 243002)
在煤粉燃烧过程中,NO还原过程存在同相和异相反应两种。同相反应是煤热解或燃烧过程释放的还原气体HCN和NH3等与NO的同相还原作用;异相反应是氮氧化物吸附在煤焦表面,与煤焦发生异相还原产生N2的过程[1,2]。由于60%以上NOx来源于煤焦氮[3-5],因此,明确NOx在含氮煤焦表面的异相还原尤为关键。
目前,对于煤焦氮还原NO的途径在中国报道极少,是否与氧化过程类似,在煤焦氮还原过程中,首先生成还原性气体HCN或NH3[6],还原性气体再与NO发生同相还原;还是含氮煤焦直接与NO发生异相作用仍未知。
Zhang等[7]采用密度泛函理论分析比较了含氮煤焦与NO在孤立和连续性活性位点间的反应。Zhang等[8]采用以吡啶氮为代表的含氮焦模型,基于密度泛函理论和过渡态理论对含氮煤焦与NO之间的非均相还原进行了详细的理论计算。Jiao等[9]采用量子化学方法研究CO在煤焦氮异相还原NO的作用,确定了CO参与下煤焦氮异相还原NO的路径。张秀霞[6]采用量子化学对NO与焦炭氮异相作用的微观反应机理进行了研究。
上述研究逐渐发展了含氮煤焦异相还原NO的机理,但NO在含氮煤焦表面的反应过程相对复杂,两者反应机理的研究仍不够全面。本研究采用量子化学密度泛函理论和过渡态理论对NO在七环zigzag煤焦氮表面的反应进行了理论计算,设计了两条NO还原途径:第一条为含氮煤焦通过氢加成先产生NH2,生成的NH2中间体进而与NO均相还原生成N2(含氮煤焦间接还原NO过程);第二条路径为所选模型直接与NO发生非均相还原产生N2。通过比较两条路径决速步能垒消耗,并对两条反应路径从热力学和动力学角度进行比较分析,进而从分子水平上揭示煤焦最易还原NO的途径。
1 计算理论
1.1 模型选择
煤焦模型是由三至七个六元环组成的单层石墨烯模型[10]。理论和实验研究表明,由于锯齿形煤焦存在未成对电子,导致其化学性质较椅形煤焦更为活跃[11,12],更利于气体在其表面发生吸附。由X射线电子光谱(XPS)分析可知,煤焦中的氮官能团主要为吡咯、吡啶和季氮[13],吡啶-N在高温下有较高的稳定性[14]。因此,本研究采用含吡啶氮的锯齿形结构(如图1所示)作为含氮煤焦模型。Kyotani等[15]和Montoya等[16]采用该含氮煤焦模型,分别对NO在煤焦表面的非均相还原路径进行了探究,其计算结果与实验数据吻合较好。

图 1 锯齿形含氮煤焦模型
1.2 理论方法
计算方法和基组的选取直接决定了量子化学计算的精度和耗时。本研究采用密度泛函理论中的B3LYP/6-31G(d)研究含氮煤焦模型还原NO途经。已有研究表明,B3LYP/6-31G(d)不仅可以获得良好的计算精度,对能量性质的影响很小,而且可以减少化学反应中的计算时间[17-22]。由于碳基模型是包含低能电子自旋态的自由基体系,反应过程中基态的过渡态和中间体所对应的自旋会有所不同,为减小自旋交叉所引起的能量偏差对反应过程中热力学和动力学计算的影响,本研究采用B3LYP/6-31G(d)计算每个中间体和过渡态结构在不同自旋下的单点能,进而比较确定每个分子结构的基态能量。Chen等[23]采用B3LYP/6-31G(d)研究了不同氧浓度对煤焦非均相还原NO的影响机制。Sendt等[20]采用B3LYP/6-31G(d)研究了O2在扶手型煤焦表面的化学吸附。在频率计算时考虑修正因子,以评估具有非谐效应的热化学性质。采用二次同步传输(QST)的方法确定过渡态的可能位置。过渡态的特征在于有且仅有一个虚频,进而进行內禀反应坐标(IRC)的计算,以验证最小能量路径,并确保过渡态在能势面上连接相应的反应物和产物。本研究电子结构和热化学计算采用Gaussian09[24]软件完成。
本研究利用经典过渡态理论计算了800-1800 K的反应速率,隧道修正因[25]Γ和温度相关的速率常数k(T)由下面具体公式给出。
(1)
(2)
进而得到研究温度范围内每步反应的动力学速率常数的阿伦尼乌斯公式:
(3)
平衡常数计算公式[26]如下:
ΔG=GB-GA=-RTlnK
(4)
2 结果与讨论
2.1 含氮煤焦间接还原NO
锯齿形含氮煤焦(R)间接还原NO的过程中间体IM、过渡态TS和产物的优化结构见图2,相应的反应过程能量变化见图3。此外,将含氮煤焦间接还原NO的过程分为两个阶段:第一阶段为NH2的形成;第二阶段为NO同相还原。
2.1.1NH2的形成
R到IM1为六元环的开环过程,过程需克服454.56 kJ/mol的高能垒。基于C1-N1间键能逐渐削弱及C1-C2间键能的增强,使得N1从六元环中剥离,C1-C2键长由0.263 nm(TS1)减小到0.147 nm(IM1)而形成五元闭环。IM1→IM2为N1-C3-C4-C5四元环的形成过程。

图 2 间接还原过程中各驻点结构 (键长单位为nm)
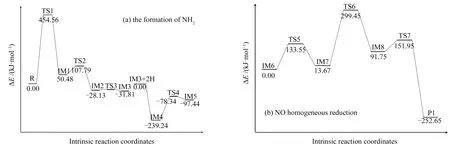
图 3 间接还原过程的能量示意图
由图4电荷布居分布可知,N1原子的电荷分布由-0.441(TS2)降低到-0.529(IM2),C5原子由-0.117增加到0.313,表明C5可以向N1提供电子,促进N1与C5原子键合。过程仅需克服57.31 kJ/mol的能垒,同时放出78.61 kJ/mol的热量,表明IM2较IM1稳定。IM2中N1原子旋转经TS3形成中间体IM3,继而经氢原子加成形成中间体IM4,氢原子加成为形成自由NH2创造了条件。由图3(a)可知,NH2从IM4表面脱附需翻越160.9 kJ/mol的能垒,且IM5较IM4位置高141.18 kJ/mol,表明煤焦表面NH2脱附后不稳定,会继续参与随后的异相反应。

图 4 TS2和IM2的电荷布居分布
2.1.2NO同相还原
首先,NH2中N1原子与NO分子中N2原子逐渐靠近形成中间体IM6,过程无需克服能垒,并放出194.28 kJ/mol的高热量。IM6到IM7为H原子迁移过程,过程需克服133.55 kJ/mol的能垒。H原子迁移为氨基上H2原子迁移到NO分子中O1原子的过程,过程中N1-H2键长增大至连接键断裂,O1-H2间作用力逐渐增强。随后,氨基中另一H1原子迁移至NO分子中N2原子附近,H1原子向N2原子转移电子,致使N2原子与H1原子发生键合,同时伴随着NO分子内部N2-O1连接键的断裂。由NBO计算的自然群体密度可知(如表1所示),H1原子价电子从0.62531下降到0.61231,N2原子由4.80537增加到5.00058,表明H1可以向N2提供电子,促进N2原子与H1原子发生键合。由过程能量示意图3(b)可知,过程经TS6到IM8需翻越285.78 kJ/mol的高能垒。最后,IM8到P1为N2和H2O分子的形成过程,过程中H1迁移仅需克服较小能垒(60.2 kJ/mol)即可形成H2O和N2。由图3(b)可知,P1较IM8能量低344.4 kJ/mol,表明H1迁移至O1原子的过程为放热反应,且N2和H2O为稳定存在的产物。

表 1 由NBO计算的一些重要原子的自然居群
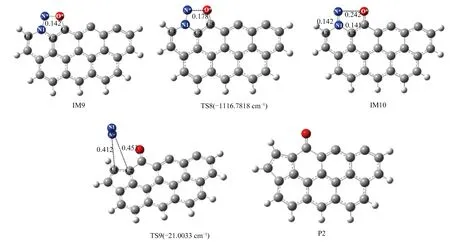
图 5 直接异相还原NO过程中各驻点结构 (键长单位为nm)
2.2 直接异相还原
首先,随着NO与R1的靠近,NO分子以side-on的形式平行吸附在N1、C3自由活性位点,放出302.08 kJ/mol的热量,表明吸附结构较稳定。随着N*-O*间作用力逐渐越弱,N*-O*连接键断裂。N*-O*键长由0.142 nm (IM9) 增大到0.178 nm (TS8) 再到0.242 nm (IM10)而断裂,N*-O*键断裂需克服50.48 kJ/mol的能垒。IM10→P2,N2的脱附过程,过程需翻越270.8 kJ/mol的能垒。由过程能量变化图6可知,P2较IM10位置低208.48 kJ/mol,表明P2结构较稳定,实际反应过程中存在时间较长。利用Multiwfn软件[27]计算并绘制P2的电子自旋密度图(见图7)。可知,P2中上部两碳原子(C5和C7)的电子自旋密度大于其他位置处碳原子的电子自旋密度,表明C5和C7原子的化学活性更高,可以为后续NO的还原提供活性位点。
含氮煤焦还原NO途径的研究结果可知,对于含氮煤焦间接还原NO的过程而言,所需克服能垒分别为454.56和285.78 kJ/mol的R→IM1和IM7→IM8过程为间接还原过程的限速步,且NH2形成过程在间接还原NO中占主导作用,其所需克服能垒消耗较NO同相还原高出37.13%,本研究与Zhang等[28]采用第一性原理研究燃煤过程中氮暴露过程决速步能垒消耗的结果一致。表明氮从六元环的剥离过程(R→IM1)为含氮煤焦间接还原NO过程的决速步。对于含氮煤焦直接异相还原NO的反应而言,N2从煤焦表面脱附(IM10→P2)为异相反应的决速步。含氮煤焦先产生还原基团NH2,NH2再与NO发生同相还原的间接还原过程决速步能垒(454.56 kJ/mol)高于含氮煤焦与NO直接发生异相还原决速步能垒(270.8 kJ/mol),表明含氮煤焦与NO直接发生异相还原的过程更容易发生。
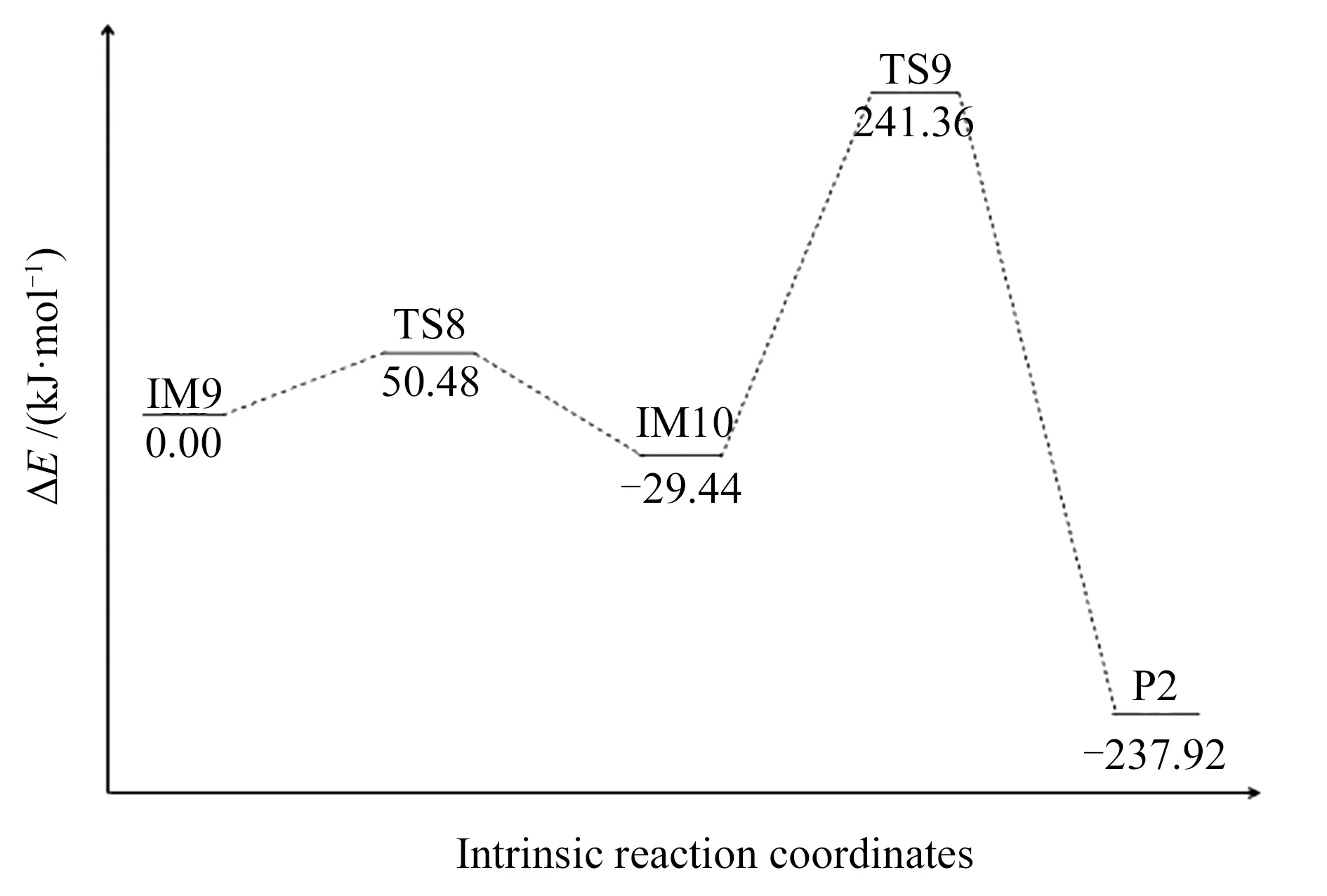
图 6 直接异相还原NO的能量示意图
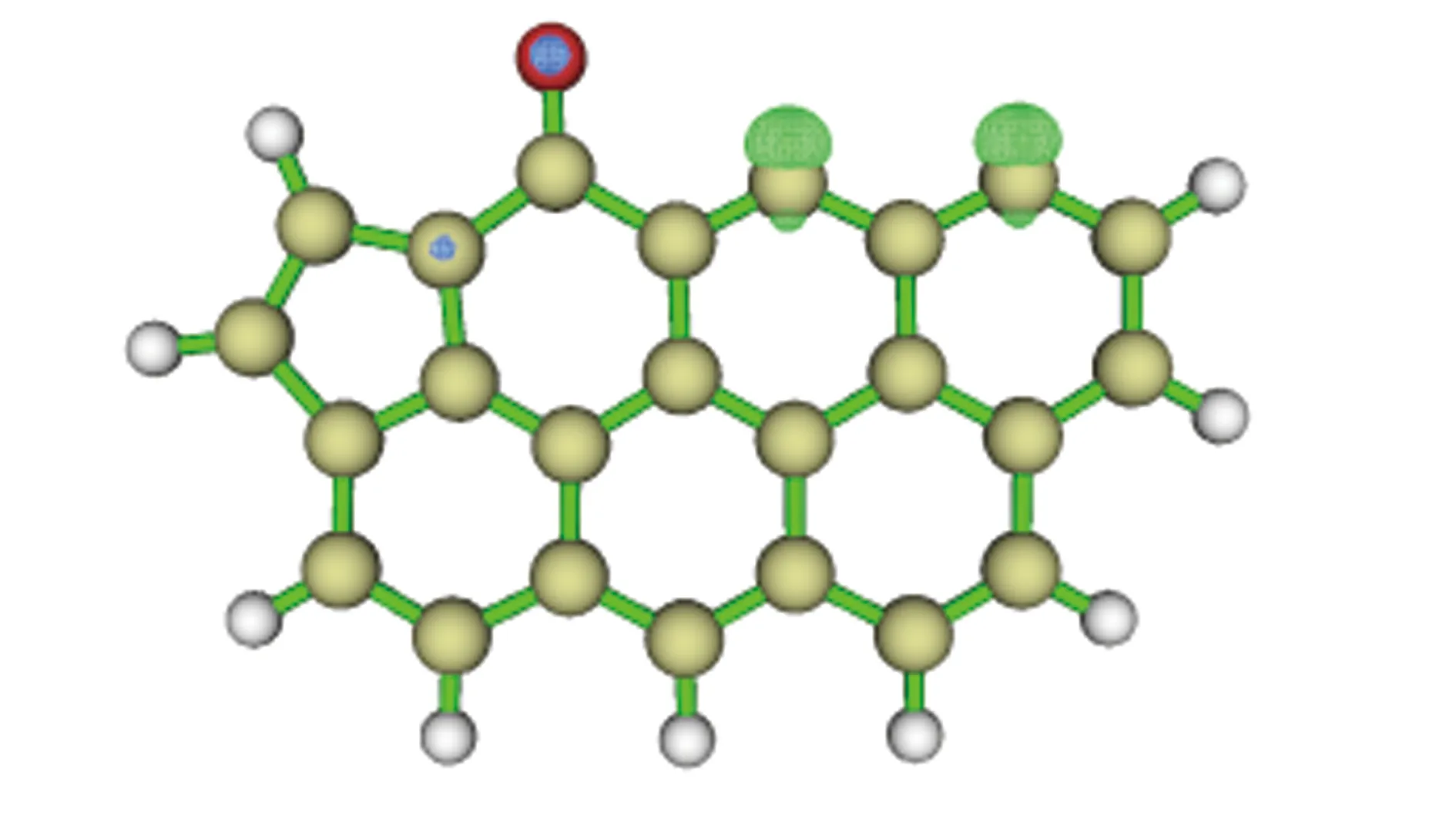
图 7 P2的电子自旋密度图
2.3 热力学分析
研究热力学参数如焓、吉布斯自由能和平衡常数,有利于理解含氮煤焦还原NO的反应性质。本研究选择800-1800 K计算含氮煤焦还原NO的重要热力学参数,具体见图8。
由图8可知,含氮煤焦间接还原NO过程中,ΔH基本不受温度影响,在研究的温度范围内,ΔH基本无变化;直接异相还原NO的反应过程中,ΔH随温度的升高略增大。但无论间接还原还是直接异相还原NO,过程ΔH均小于0,表明在研究温度范围内,NO在煤燃烧系统中的还原反应均为放热反应。当T>900 K时,间接还原NO过程中ΔG大于0,表明含氮煤焦间接还原NO的过程不可自发进行;含氮煤焦直接异相还原NO的反应在研究温度范围内ΔG均小于0,表明在整个煤燃烧系统中,煤焦直接异相还原NO可自发进行。间接还原NO的过程在研究温度范围内K明显小于105,表明含氮煤焦间接还原NO的过程基本不会发生;含氮煤焦直接异相还原NO反应的K受温度影响较大,随温度的升高K明显降低,但在研究温度范围内,K均大于105,表明在整个煤燃烧系统中,含氮煤焦直接异相还原NO的反应可以完全进行,可认为是单向反应。
含氮煤焦还原NO的热力学分析可知,含氮煤焦先转化为NH2,NH2再同相还原NO的反应不可自发进行,在煤燃烧系统中基本不会发生。含氮煤焦直接异相还原NO的反应在煤燃烧系统中为可自发进行的单向放热反应。因此,热力学分析表明,含氮煤焦还原NO的途径为直接异相还原过程。

图 8 不同温度下的热力学参数
2.4 动力学分析
含氮煤焦还原NO的反应速率常数由式(1)、式(2)求出,结合式(3)得出每步反应的活化能Ea。图9为不同温度下各步反应的速率常数,表2列出了各步反应的活化能Ea和指前因子A。由图9可知,含氮煤焦还原NO的反应对温度有较强的依赖性。含氮煤焦间接还原NO的过程决速步(R→IM1)速率常数比其他各步反应至少慢六个数量级(见图9(a)),基于N从六元环的剥离过程(R→IM1)所需翻越能垒较高。因此,动力学分析可知,含氮煤焦间接还原NO的速率取决于NH2形成过程中氮从六元环的剥离(R→IM1)。由图9(b)可知,N2从煤焦表面的脱附速率(IM10→P2)较IM9→IM10低,则为含氮煤焦直接异相还原NO的决速步。
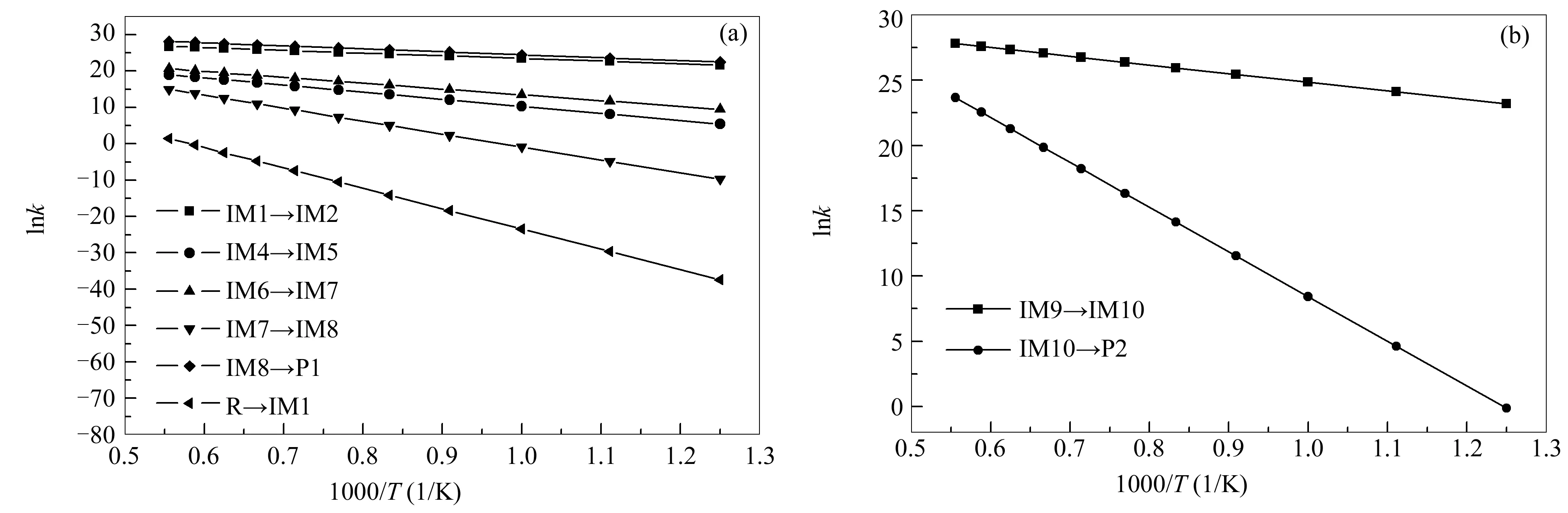
图 9 800-1800 K两种途径的各步反应速率常数
不同温度下含氮煤焦间接还原NO和直接异相还原NO两过程中限速步速率常数见图10。
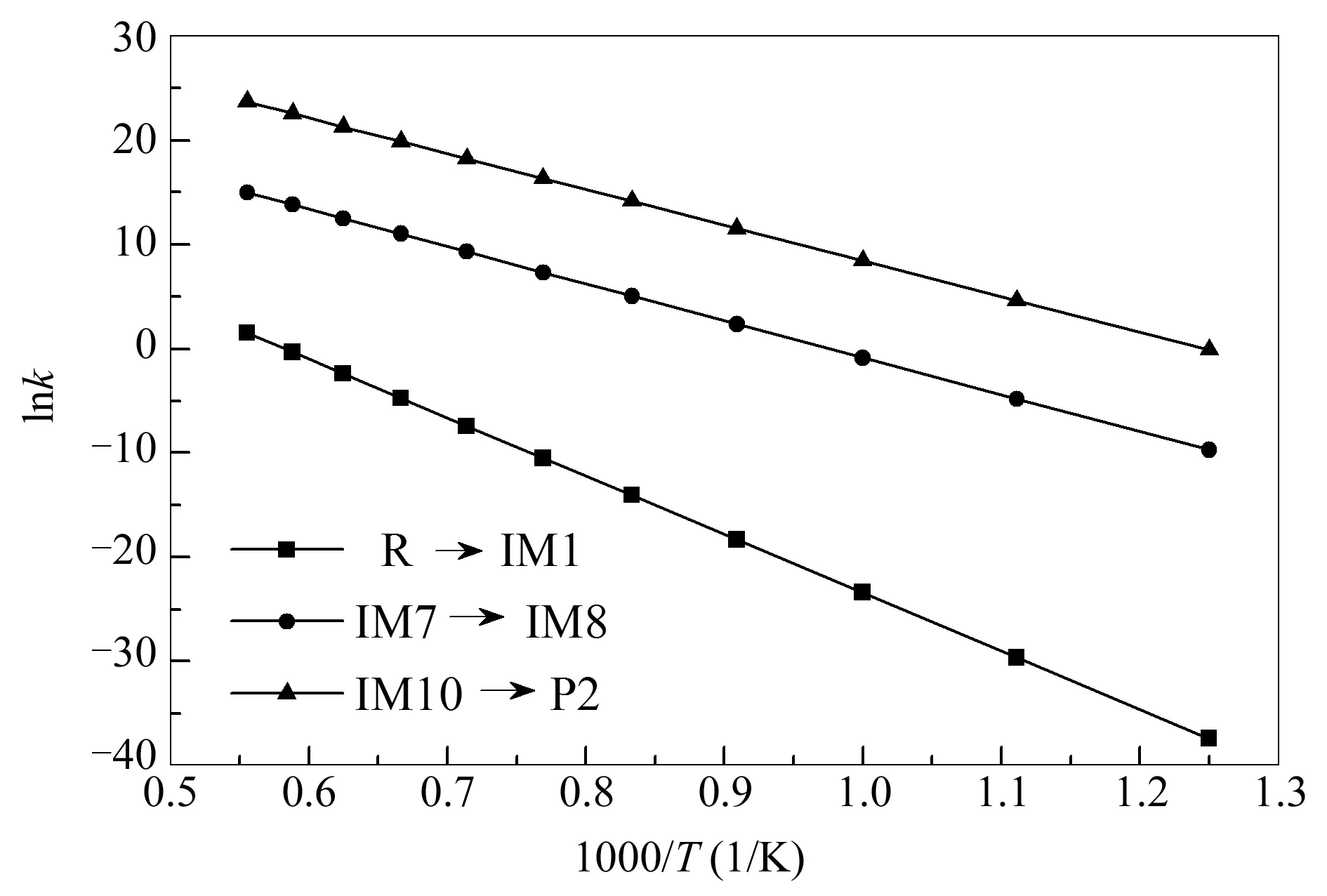
图 10 800-1800 K温度条件下限速步速率常数
与含氮煤焦直接异相还原NO相比,其间接还原NO的反应在较高温度下(>1700 K)才开始发生反应,表现出较强的温度依赖性。由图10可知,无论低温或高温下,含氮煤焦间接还原NO的决速步R→IM1的速率常数均明显小于含氮煤焦直接异相还原NO决速步IM10→P2的速率常数,表明含氮煤焦间接还原NO的反应在动力学上不太有利。综合含氮煤焦还原NO的路径、热力学分析以及动力学分析可知:含氮煤焦间接还原NO的决速步能垒值较直接异相还原决速步能垒值高183.76 kJ/mol,由能垒角度分析不利于其间接还原NO的过程;热力学分析可知在整个煤燃烧系统中,含氮煤焦间接还原NO的过程不可自发进行,其直接异相还原NO的平衡常数较大(>105),为可自发进行的单向放热反应;动力学分析可知,含氮煤焦间接还原NO过程的决速步速率常数较直接异相还原NO的决速步速率常数至少低10个数量级,表明含氮煤焦直接异相还原NO更容易发生。综合上述分析,在煤燃烧系统中,含氮煤焦直接异相还原NO产生N2的途径更容易发生。

表 2 各步反应动力学参数
3 结 论
含氮煤焦间接还原NO的反应包括NH2的形成和NO同相还原两个阶段。NH2形成过程中氮从六元环的剥离(R→IM1)所需活化能最大(465.48 kJ/mol),为含氮煤焦间接还原NO的反应决速步。其决速步能垒值较含氮煤焦直接异相还原NO决速步能垒值高183.76 kJ/mol,由能垒角度分析更利于含氮煤焦与NO直接发生异相还原的过程。
热力学分析表明,含氮煤焦间接还原NO的过程不可自发进行,含氮煤焦直接异相还原NO的平衡常数较大(>105),为可自发进行的单向放热反应。
动力学分析表明,含氮煤焦间接还原NO过程的决速步速率常数较直接异相还原NO的决速步速率常数至少低10个数量级,因此,含氮煤焦直接异相还原NO更容易发生。

