丛枝菌根真菌对紫茎泽兰生长与繁殖的影响
宋洁蕾, 李 胜, 林 莹, 罗石文, 段艳茹, 桂富荣,3*
1云南农业大学植物保护学院,云南省生物资源保护与利用国家重点实验室,云南 昆明 650201; 2广西田园生化股份有限公司,广西 南宁 530007; 3云南省高原特色农业产业研究院,云南 昆明 650201
紫茎泽兰Ageratinaadenophora(Sprengel) R. K. H.是一种繁殖能力强、具群居性、生态适应性广、利用价值低、生长速度快的世界性恶性入侵杂草(尹俊,2006),也是我国外来入侵物种中危害最严重的物种之一(强胜,1998)。紫茎泽兰原产于中美洲的墨西哥与哥斯达黎加地区,后作为园林植物被带入欧洲,随后又被作为观赏植物引入澳洲和亚洲,之后迅速扩散蔓延,现在在热带和亚热带的30多个国家与地区广泛分布(万方浩等,2011)。紫茎泽兰大约于20世纪40年代从中缅边境侵入我国云南,现已广泛分布在我国长江以南各地,其中,云南、四川、广西、贵州、重庆、西藏等地发生较严重。紫茎泽兰可以通过有性和无性2种方式繁殖,但主要以种子繁殖为主。其种子产量高,一株紫茎泽兰每年可产3万~4.5万粒种子,瘦果细小,千粒重仅0.045 g(王银朝等,2005),顶端具冠毛,可随风、水流等传播,萌发率高(杨蓉西,2003)。紫茎泽兰目前仍在以每年大约20 km的速度随季风向内地扩散,严重制约了入侵地的农业、林业、畜牧业的发展,并且对入侵地的生物多样性和自然生态环境也造成了极大影响(万方浩等,2011)。
目前研究发现,在外来植物竞争排斥本地植物入侵机制方面,入侵地的土壤微生物群落在促进外来植物入侵的植物群落演替方面具有重要作用(Callawayetal.,2004; Inderjit & van der Putten,2010)。菌根真菌在高等植物出现以前就已经同古老的陆生植物形成共生体。丛枝菌根(arbuscular mycorrhiza,AM)也是最早出现的一类菌根类型。丛枝菌根是球囊门真菌侵染植物根系形成的共生体,共生体的形成极大提高了植物对环境和生态系统的适应能力,在植物物种形成及进化的过程中扮演着重要角色(石兆勇等,2003)。丛枝菌根真菌(arbuscular mycorrhiza fungi,AMF)可以直接吸收或增强寄主植物根系对水分和营养物质的吸收,增加植物对营养物质的利用效率,调节植物体内酶活性,诱导寄主合成次生代谢物质,改变植物内源激素平衡情况,进而改良植物体内营养和水分状况,促进生长,提高植株的抗旱性、抗病性。不仅如此,AMF还可以促进植物结实量,改善品质(李东彦,2007)。
研究发现,紫茎泽兰可以通过改变土壤微生物群落结构和提高土壤肥力来创造对自身有利的土壤环境,从而形成自我促进的入侵机制(李会娜等,2009; 牛红榜等,2007; Niuetal.,2007),但AMF对紫茎泽兰的反馈效应亟待全面研究(于文清,2012)。本研究采用室内盆栽接种方法,通过测定分析紫茎泽兰形态分化、生物量等指标,探索接种AMF对紫茎泽兰生长、繁殖的影响,以期为利用菌根控制技术防治紫茎泽兰提供参考。
1 材料与方法
1.1 材料
供试土壤:采自云南农业大学后山无紫茎泽兰和本地杂草生长的红壤土,土壤自然风干后过2 mm网筛,经高温高压灭菌2次(温度121 ℃、压力0.14 MPa、时长2 h),7 d后,取部分灭菌后的土壤测定基本理化性质:全氮、全磷和全钾含量分别为0.34、1.08、5.42 g·kg-1,碱解氮、速效磷、速效钾含量分别为41.03、9.34、171.75 mg·kg-1,有机质含量8.73 g·kg-1,pH 6.25。另取建筑工地的河沙淘洗干净、烘干后,采用高温高压灭菌2次(温度121 ℃、压力0.14 MPa、时长2 h)。灭菌的红壤土与灭菌的河沙2/1(V/V)混合后作为供试土备用。塑料花盆洗净后,用75%乙醇溶液浸泡消毒后备用。
供试菌种:参考于文清等(2012)、王鹏鹏等(2015)的研究,选用幼套球囊霉GlomusdiaphanumMorton Walker进行实验。幼套球囊菌购自甘肃省武威市林业综合服务中心,以玉米幼苗纯化、扩繁。
供试植株:紫茎泽兰种子采自云南省昆明市盘龙区茨坝镇,挑选大小一致、颗粒饱满的种子,用10% H2O2浸泡10 min,再用无菌水冲洗数遍沥干后备用。灭过菌的培养土装至育苗盘的2/3处,将种子撒播于培养土表面,再均匀覆盖一层1 cm的培养土,苗期每隔2周浇50% Hoagland营养液100 mL。接种实验时选用长势一致、株高约10 cm的紫茎泽兰无菌苗进行移栽。
1.2 实验设计
实验处理:将灭过菌的培养土装至花盆的2/3处,加入10 g菌剂,再均匀覆盖一层1 cm的培养土,每盆装入培养土1 kg。对照组为添加10 g灭菌的AMF菌剂和经微孔无菌滤膜滤除真菌后的土壤细菌群落滤液10 mL,其他处理和培养方法与接种处理一致。每个处理重复5次,共10盆。花盆随机摆放于温室中,每隔1周变换一次位置,并补充100 mL Hoagland 营养液,每3 d浇一次无菌水。
1.3 生长繁殖指标的测定
实验于2017年4月7日开始,2018年4月30日结束。紫茎泽兰生物量的测定于种子完全成熟后进行,从盆中完整地取出紫茎泽兰,洗去根部泥土,尽量减少细根的损失,收获整株。分别测定株高、叶片数、总叶面积、节间距、地径,并统计单株花序数、单花序种子量、种子量、种子千粒重、含水率、发芽率、发芽势、发芽指数。称重使用电子天平(精度0.0001 g);叶面积采用扫描像素法(于守超等,2012)测定,即用扫描仪扫描叶片后利用Photoshop CS6分析图片计算出叶面积并记录。各指标测定后在105 ℃下杀青处理5 min,置于70 ℃烘箱烘干72 h至恒重,再分别测定叶、茎、根的干重,计算生物量(紫茎泽兰总干重)、根冠比(root mass/crown mass,根干重/地上部干重)、根生物量比(root mass ratio,根重/植株总重)、茎生物量比(stem mass ratio,茎重/植株总重)、叶生物量比(leaf mass ratio,叶重/植株总重)。种子在实验前用75%酒精消毒15 min,5%次氯酸钠消毒5 min,灭菌蒸馏水冲洗一遍,将消毒过的种子放在垫有2层定性滤纸的培养皿中,加适量灭菌蒸馏水,放入预先设置好温度[(27±1) ℃]和湿度[(90±5)%]的光照培养箱中,每日记录样品种子的发芽数。以胚根冲破种皮为发芽标准,每天记录发芽种子的数量(韩利红等,2010)。
1.4 数据处理
所有数据均使用Excel 2007和SPSS 17.0软件进行单因素方差分析,LSD法多重比较分析,对发芽率与侵染率数据反正弦转换后进行方差分析。
发芽势/%=前3 d发芽/总种子数×100;发芽势是指种子开始萌发后,某天之前所有的种子数占所测样品种子总数的百分率。
发芽率/%=发芽种子总数/供试种子总数×100;发芽率是指样品种子测试结束时所有发芽的种子占样品种子总数的百分率。
发芽指数(GI)=∑(Gt/Dt);Gt为在t日内的发芽数,Dt为发芽日数。
2 结果与分析
2.1 紫茎泽兰的菌根侵染率
对照组紫茎泽兰未被AMF侵染,接种处理的紫茎泽兰生长一年后菌根侵染率达89.53%,显著高于未接种。
2.2 AMF对紫茎泽兰生长的影响
接种AMF显著促进紫茎泽兰地上部分生长(表1)。与对照相比,接种处理的紫茎泽兰植株各茎叶生长指标均极显著增加(P<0.01);其中,接种处理的紫茎泽兰株高和茎粗分别是未接种植株的2.63、1.90倍。接种处理的紫茎泽兰叶片数、总叶面积、分枝数和节间距分别是未接种植株的3.28、4.14、2.71、1.86倍,差异极显著(P<0.01)。

表1 AMF对紫茎泽兰生长的影响Table 1 Effect of AMF on growth of A. adenophora
同列数据(平均值±标准误)后不同大写字母者表示在1%水平上差异极显著。
The data (means±SD) in the same column with the different capital letters mean significant differences at 1% level.
2.3 AMF对紫茎泽兰干物质量及生物量分配的影响
如图1所示,接种AMF极显著增加了紫茎泽兰的生物量积累(P<0.01)。在整个生长期内,接种处理的紫茎泽兰叶、根、茎器官的干物质量分别是对照组的3.79、6.37、7.42倍,差异极显著(P<0.01)。接种处理的紫茎泽兰地上生物量和总生物分别为对照的6.75、6.53倍。单株干物质总积累量,接种植株为16.50 g,对照植株为2.53 g,干重相差13.97 g。从生物量分配比可以看出(图2),接种处理的生物量比,仅茎生物量比高于对照,差异不显著(P>0.05),叶生物量比显著低于对照(P<0.05),根生物量比、根冠比也均低于对照,但差异不显著。
2.4 AMF对紫茎泽兰花序数与种子量的影响
与对照相比,接种AMF显著提高了紫茎泽兰种子产量及种子质量。接种AMF后紫茎泽兰的单株花序数、单花序种子数和产籽量为对照植株的5.03、1.51、7.64倍,差异达极显著(P<0.01)。其种子长度、宽度以及千粒重均显著高于对照。通过测量种子含水率,接种植株的含水率较未接种植株增加了3.18倍,差异显著(P<0.05)(表2)。
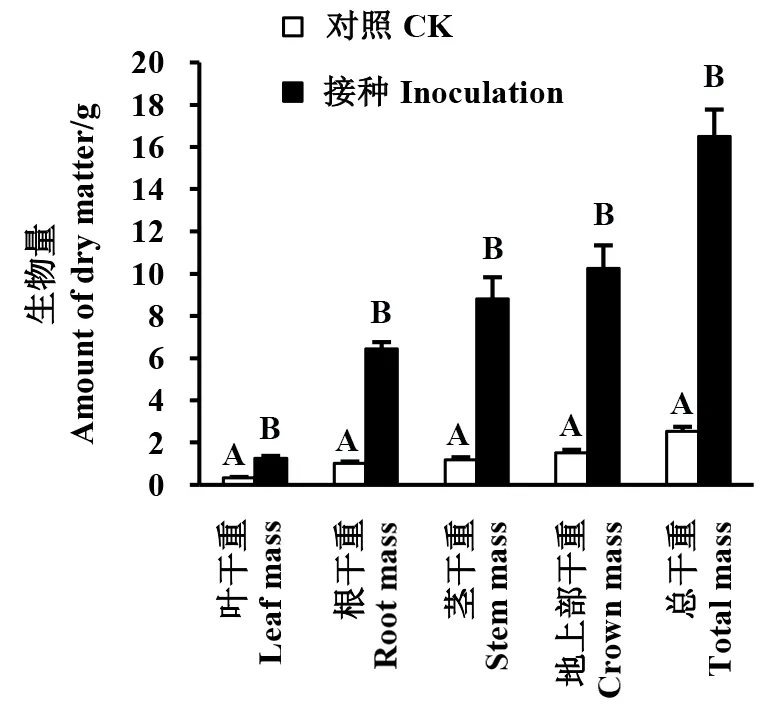
图1 AMF对紫茎泽兰干物质量的影响Fig.1 Effects of AMF on biomass of A. adenophorum不同大写字母者表示在1%水平上差异显著。The different capital letters mean significant differences at 1% level.
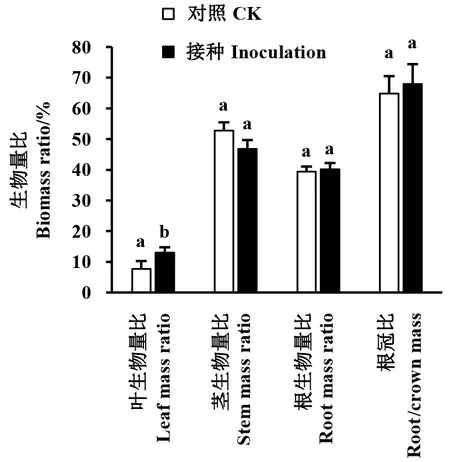
图2 AMF对紫茎泽兰生物量分配的影响Fig.2 Effects of AMF on biomass ratio of A. adenophorum不同小写字母者表示在5%水平上差异显著。The different small letters mean significant differences at 5% level.
2.5 种子发芽率等参数的比较
接种AMF的紫茎泽兰发芽率显著高于未接种。发芽势反应的是种子质量优劣程度,接种AMF的种子发芽势达18.56%,未接种的为3.78% ,显著高于未接种(P<0.05)。发芽指数反应的是种子活力,接种AMF的发芽指数为43.13,未接种的为15.21,差异极显著(P<0.01),说明接种过的种子发芽速度快,发芽能力好。
3 讨论与结论
AMF与土壤养分之间存在相互影响的关系,而紫茎泽兰的入侵会改变土壤养分情况(Blank & Young,2002),如N、P、K的供应发生变化,这种变化必然会对本地植物造成伤害,外来植物由此改变土壤化学和土壤生态,创造利于入侵的条件(Annapurna & Singh,2003; Dudaetal.,2003),增强其扩散能力、繁殖能力、竞争能力等(万方浩,2015)。
AMF对紫茎泽兰的生长具有极大的促进作用,实验结果表明,接种处理植株的株高、叶面积分别是对照的2.63、4.14倍;接种处理植株显著增强了紫茎泽兰的干物质量的积累,接种后,其地上部干重、地下部干重与总干重分别是对照植株的6.75、6.38、6.53倍。
种子萌发对物种的更新至关重要,种子萌发率会直接影响一个物种在一个种群中所占的数量和比例(刘志磊等,2006)。AMF可以促进植物生长和结实(李东彦,2007),接种AMF可以显著提高棉花(刘润进和沈崇彦,1994)、西瓜(杨兴洪和刘润进,1994)和柚子(杨晓红等,2002)等植物的产量和不同部位的生物量。本研究结果显示,接种AMF增加了紫茎泽兰的有性繁殖能力,植株头状花序数、产籽量及种子发芽能力显著增高。

表2 AMF对紫茎泽兰花序数及种子量的影响Table 2 Effect of AMF on anthotaxy and seed number of A. adenophora
同列数据(平均值±标准误)后不同大、小写字母者分别表示在1%、5%水平上差异显著。
The data (means±SD) in the same column with the different capital, small letters mean significant differences at 1%, 5% level, respectively.
种子传播是紫茎泽兰扩散蔓延的主要方式(刘伦辉和刘文耀,1989)。铲除大面积的植株后,土壤中已有的种子仍会大量萌发,而且残留的少量紫茎泽兰也能产生大量种子。张丽坤等(2014)研究结果显示,紫茎泽兰的植株高度与种子传播速度和种子形态相关,植株越高,种子传播的越远。紫茎泽兰接种AMF后,其株高比对照高63.52 cm。相比于对照,接种植株的种子借助风力或人为因素,能更迅速传播,且范围更广,对于其建立种群发挥了重要作用,对防治工作也带来了极大困难。因此,减少紫茎泽兰结实量以减小种子产量和种子发芽率,被认为是有效防控紫茎泽兰危害和扩散蔓延的主要方法之一(李爱芳等,2006)。是否能够通过降低土壤中丛枝菌根含量以降低紫茎泽兰开花结实量还有待进一步的研究。

