低氧耐性胃癌细胞系的建立及生物学特征分析
车晓芳 师霄楠 郑春雷 杨子长 张晓洁 曲秀娟 刘云鹏

[摘要] 目的 建立低氧耐性胃癌細胞系,并分析其生物学特征,为胃癌低氧微环境研究提供良好的模型。 方法 通过逐渐降低氧气浓度建立耐受2%O2的低氧耐性胃癌细胞系MGC803/hypo和BGC823/hypo。采用倒置显微镜观察细胞形态;采用Transwell小室检测细胞迁移能力;采用MTT法检测细胞增殖能力;采用免疫印迹法检测其蛋白表达;比较其与亲本胃癌细胞系的生物学特征差异。 结果 与亲本胃癌细胞系比较,低氧耐性胃癌细胞系呈梭形改变,且排列松散,培养液颜色易变黄,迁移能力明显增强(P < 0.05),增殖能力减弱(P > 0.05);低氧相关指标HIF-2α明显上调,糖酵解相关指标Glut1显著上调,上皮间充质转化(EMT)相关指标ZO-1下调,vimentin上调;转移相关指标MUC1、integrin α5、integrin β1上调。 结论 本研究建立了可耐受2%O2浓度的低氧耐性胃癌细胞系MGC803/hypo和BGC823/hypo,其转移能力明显增强,增殖能力相对减弱,这为探索低氧微环境促进肿瘤转移机制建立了良好的模型。
[关键词] 胃癌细胞系;低氧耐性;生物学特征;转移能力;增殖能力
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-7210(2019)02(b)-0014-05
[Abstract] Objective To establish a hypoxic-resistant gastric cancer cell line and analyze its biological characteristics to provide a good model for the study of hypoxic microenvironment in gastric cancer. Methods The hypoxic-resistant gastric cancer cell lines MGC803/hypo and BGC823/hypo, which were tolerant to 2% O2, were established by gradually decreasing the oxygen concentration. The morphology of the cells was observed by inverted microscope. The cell metastasis ability was detected by Transwell chamber. The cell proliferation ability was detected by MTT assay. The protein expression was detected by Western blot. The biological characteristics of the gastric cancer cell lines were compared with those of their parents. Results Compared with the parental gastric cancer cell line, the hypoxic-resistant gastric cancer cell line showed spindle-shaped changes and loosely arranged. The color of the culture medium was easy to turn yellow, the migration ability was significantly enhanced (P < 0.05), and the proliferation ability was weakened (P > 0.05). Hypoxia-related index HIF-2α was significantly up-regulated, Glut1 was up-regulated in glycolytic index, ZO-1 was down-regulated in epithelial mesenchymal transition (EMT), vimentin was up-regulated, and metastasis-related indicators MUC1, integrin α5, and integrin β1 were up-regulated. Conclusion This study established hypoxic-resistant gastric cancer cell lines MGC803/hypo and BGC823/hypo which can tolerate 2% O2 concentration. The Metastasis ability is obviously enhanced and the proliferative ability is relatively weakened. This provides a good model for exploring the mechanism of hypoxic microenvironment promoting tumor metastasis.
[Key words] Gastric cancer cell line; Hypoxia-resistance; Biological characteristics; Metastasis ability; Proliferation ability
我国胃癌发病率在各类肿瘤中位居第二位,每年因胃癌死亡的人数约20余万[1],约占世界胃癌死亡人数的一半。75%的胃癌患者发现时已是晚期,其预后极差。转移是导致胃癌患者死亡的主要原因之一,而低氧微环境在肿瘤转移过程中发挥着重要的促进作用。然而,目前大多数肿瘤低氧微环境的相关研究中,其肿瘤细胞通常暴露于0.1%~1%的O2条件下培养24~72 h[2]。这种短期、急性低氧处理并不能完全反映肿瘤内部的真实情况,且常规培养的肿瘤细胞在体外低氧条件下仅能存活几天,严重限制了肿瘤低氧微环境的深入研究。为更真实地模拟肿瘤低氧微环境,本研究利用逐渐降低O2浓度的方法建立低氧耐性胃癌细胞系,并比较亲本胃癌细胞和低氧耐性胃癌细胞的基本生物学特性异同。以期为胃癌低氧微环境研究提供良好的模型。
1 材料与方法
1.1 试剂
RPMI1640、DMEM培養基(均购自Gibco公司)、胎牛血清(购自Biological Industries公司)HIF-1α、HIF-2α、Glut1、ZO-1、vimentin、MUC1、integrinα5、integrinβ1、β-actin抗体(购自Santa Cruz公司或Cell Signaling Technology公司)、羊抗鼠和羊抗兔辣根过氧化物酶标记的二抗(购自北京中杉金桥生物技术有限公司)、ECL检测试剂盒(购自PIERCE公司)。
1.2 细胞培养
人胃癌细胞系MGC803和BGC823购自国家细胞资源库,37℃、5%CO2条件下培养于含10%胎牛血清(FBS)、青链霉素各100 U/mL的RPMI 1640培养液中,2~3 d传代1次,取对数生长期的胃癌细胞用于实验。
1.3 低氧耐性胃癌细胞系的建立
通过逐步降低O2浓度的方法建立低氧耐性胃癌细胞系MGC803/hypo和BGC823/hypo(图1)。亲本胃癌细胞MGC803和BGC823依次培养于10%、5%O2浓度条件下,筛选活细胞继续培养1个月;最后将O2浓度降低至2%,筛选活细胞培养2个月,至完全适应2%O2低氧状态。已建立的低氧耐性胃癌细胞系MGC803/hypo和BGC823/hypo在37℃、5%CO2和2%O2条件下常规培养于含10%FBS、青链霉素各100 U/mL的DMEM培养液中。
1.4 细胞形态观察
在倒置显微镜下观察细胞形态并拍照。
1.5 细胞迁移实验
取对数生长期的胃癌细胞,制备成1×105个/mL的细胞悬液。细胞迁移(Transwell)小室的下室加入500 μL含2.5% FBS的培养液,上室加入200 μL细胞悬液,继续培养24 h后,取出小室,吉姆萨(Giemsa)染色40 min,显微镜下观察并计数迁移至小室下层的细胞个数。实验重复3次。
1.6 MTT法测定细胞增殖能力
取对数生长期的胃癌细胞,制备成1×105个/mL的细胞悬液。调整细胞浓度3000个/孔,接种于96孔板中,分别培养24、48、72、96 h,其后每孔加入20 μL浓度为5 mg/mL的MTT溶液,培养4 h,吸净上清,每孔加入200 μL二甲基亚砜(DMSO),震荡10 min,采用酶标仪于570 nm处测定其吸光值。
1.7 蛋白质免疫印迹测定蛋白表达
利用细胞裂解液将胃癌细胞裂解,其后进行蛋白定量。取20 μg蛋白样本,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行电泳分离;转至聚偏氟乙烯(PVDF)膜后,室温封闭1 h;一抗孵育4°C过夜;TBST洗4次,每次10 min;二抗室温孵育1 h,TBST洗4次,增强化学发光法(ECL)显色。
1.8 统计学方法
所有数据均为3次独立实验结果。采用SPSS 16.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果
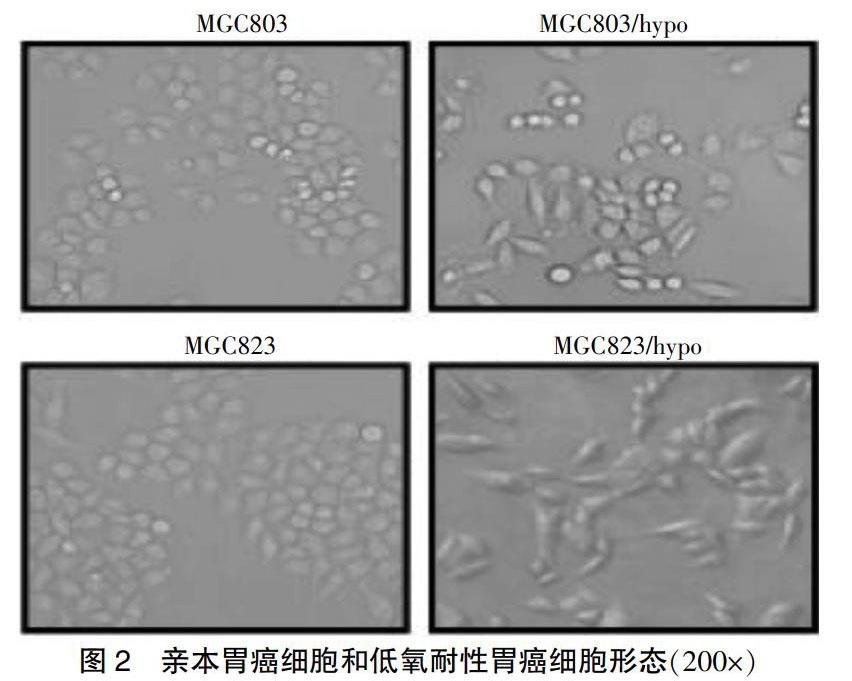
2.1 低氧耐性胃癌细胞的形态改变
倒置显微镜观察下低氧耐性胃癌细胞和亲本胃癌细胞的形态。与亲本胃癌细胞系比较,低氧耐性胃癌细胞系呈梭形改变、且排列松散,提示低氧耐性胃癌细胞发生了上皮间充质转化(EMT)样改变(图2)。
2.2 低氧耐性胃癌细胞培养液改变
培养皿中分别接种相同数量的亲本胃癌细胞和低氧耐性胃癌细胞,培养3 d后观察培养液颜色,可见低氧耐性胃癌细胞培养液更易变黄,呈酸性,提示低氧耐性胃癌细胞糖酵解能力增强。见图3(封三)。
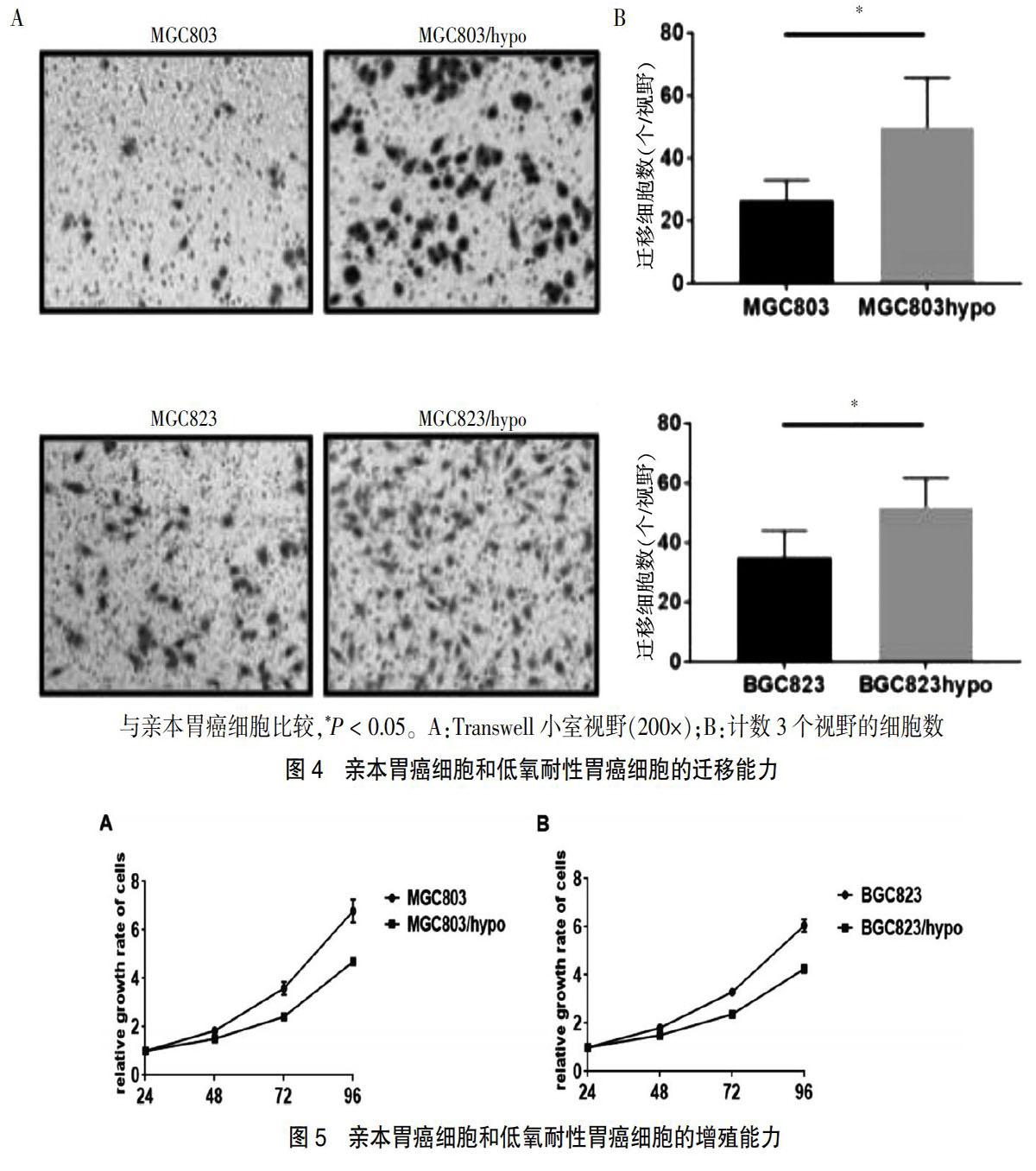
2.3 低氧耐性胃癌细胞的迁移能力改变
Trnaswell小室法比较亲本胃癌细胞和低氧耐性胃癌细胞的迁移能力改变,发现与亲本胃癌细胞比较,穿过Transwell小室的低氧耐性胃癌细胞数量明显增加,提示低氧耐性胃癌细胞迁移能力明显增强(图4)。
2.4 低氧耐性胃癌细胞的增殖能力变化
低氧耐性胃癌细胞的增殖速率比亲本胃癌细胞慢,但差异无统计学意义(P > 0.05)。见图5。
2.5 低氧耐性胃癌细胞的蛋白表达改变
与亲本胃癌细胞比较,低氧耐性胃癌细胞中HIF-2α明显升高,提示长期低氧条件下,HIF-2α可能对转录起着重要的调节作用;Glut1明显上调,提示长期低氧增加了胃癌细胞的糖摄取和糖酵解能力(图6A)。上皮表型标志物ZO-1下调,而间质表型标志物vimentin明显上调,进一步证明低氧耐性胃癌细胞发生了EMT样改变;与转移相关的MUC1、integrin α5、integrin β1的表达明显增加,提示长期低氧诱导的MUC1、integrin α5、integrin β1等促进了低氧耐性胃癌细胞转移(图6B);另外,G1期相关蛋白cyclinD1和cyclinE在低氧耐性胃癌细胞中明显下调,而cyclinA和cyclinB1无明显变化,提示长期低氧条件下cyclinD1和cyclinE下调可能通过减慢G1期导致胃癌细胞增殖能力减弱(图6C)。
3 讨论
肿瘤微环境在肿瘤发生进展中发挥着不可忽视的作用[3],而缺氧是包括胃癌在内的实体瘤微环境的关键特征之一[4]。随着肿瘤细胞的快速增殖,肿瘤局部耗氧量增加,使肿瘤细胞处于乏氧状态。虽然代偿性血管新生可部分恢复肿瘤细胞氧供,但由于新生血管结构和功能异常,不能满足肿瘤进一步生长所需,使其再次处于乏氧状态[5-6]。如此反复,肿瘤细胞在高度乏氧和中度乏氧状态间波动,直到适应这种循环性低氧微环境。因此,本研究中通过逐步降低O2浓度建立的可耐受2%O2浓度的低氧耐性胃癌细胞MGC803/hypo和BGC823/hypo,更能真实反映肿瘤的低氧微环境,更有助于深入探讨低氧微环境促进胃癌转移的机制。
既往研究[7]认为,HIF-1α是细胞适应低氧环境的主要转录因子。在正常氧气浓度下,細胞中HIF-1α与E3泛素连接酶(VHL)结合后导致泛素化降解,故其在细胞中的表达水平很低;而在低氧情况下,HIF-1α因不能与VHL结合导致降解受抑而稳定表达,入核后与HIF-1β形成复合物,并结合至靶基因的缺氧反应元件(HRE),促进靶基因的转录,调节细胞增殖、转移和血管生成等过程[8-11]。然而,在长期缺氧条件下,通常HIF-1α并不增高,而是HIF-2α蛋白稳定表达[12]。HIF-2α调控的靶基因除部分与HIF-1α相同外,有其特异性靶基因,且大部分靶基因尚不明确。因此,HIF-1α可能主要参与癌症的早期阶段,而HIF-2α主要参与晚期阶段[13]。在本研究中,与亲本胃癌细胞比较,低氧耐性胃癌细胞HIF-2α明显上调,而非HIF-1α,提示长期低氧时HIF-2α发挥着非常重要的作用。HIF-2α如何参与低氧微环境促进胃癌转移还需深入研究。
与亲本胃癌细胞比较,本研究中低氧耐性胃癌细胞转移能力明显增强,且发生了EMT样的改变。缺氧时HIF-1可通过上调EMT转录因子Snail[14]、TWIST[15]、ZEB[16]和SLUG[17]等的表达诱导EMT的发生。EMT是肿瘤转移的关键过程。此外,本研究中低氧耐性胃癌细胞增殖减慢,且cyclinE和cyclinD1表达明显降低,提示长期低氧可能通过降低细胞周期调控蛋白表达抑制增殖。缺氧可以抑制多种肿瘤细胞的增殖[18-19],HIF-1α可通过影响MYC的活性诱导p21和p27基因转录[20],HIF-1α和HIF-2α都直接结合细胞分裂周期蛋白6(Cdc6)而导致DNA复制减少,抑制细胞周期进程[18]。另外,低氧耐性胃癌细胞中Glut1、MUC1、integrin α5和integrin β1均明显上调,提示低氧微环境促进肿瘤转移是非常复杂的过程,除EMT外,糖酵解、细胞外基质重塑等因素也参与其中。长期低氧促进胃癌转移的具体机制还有待于进一步深入研究。
综上所述,本研究建立的低氧耐性胃癌细胞系代谢更快、转移能力更强、更具间质表型,可更加真实地反映体内肿瘤低氧微环境,为以后低氧微环境促进胃癌细胞转移的研究提供了重要的模型。
[参考文献]
[1] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015[J]. Ca Cancer J Clin,2016,66(2):115-132.
[2] Yang S,Zhang Z,Hao Y,et al. HIF-1α induces the epithelial-mesenchymal transition in gastric cancer stem cells through the Snail pathway [J]. Oncotarget,2017,8(6):9535.
[3] Xuan Y,Wang YN. Hypoxia/IL-1α axis promotes gastric cancer progression and drug resistance [J]. J Digest Dis,2017,18(9):511-520.
[4] Vaupel P,H?觟ckel M,Mayer A. Detection and characterization of tumor hypoxia using pO2 histography [J]. Antioxiad Redox Sign,2007,9(8):1221-1235.
[5] Dewhirst MW,Navia IC,Brizel DM,et al. Multiple etiologies of tumor hypoxia require multifaceted solutions [J]. Clin Cancer Res,2007,13(1):375-377.
[6] Laitala A,Erler JT. Hypoxic Signalling in Tumour Stroma [J]. Front Oncol,2018,8:189.
[7] Dengler VL,Galbraith M,Espinosa JM. Transcriptional Regulation by Hypoxia Inducible Factors [J]. Crit Rev Biochem Mol,2014,49(1):1-15.
[8] Jaakkola P,Mole DR,Tian YM,et al. Targeting of HIF-α to the von Hippel-Lindau Ubiquitylation Complex by O2-Regulated Prolyl Hydroxylation [J]. Science,2001,292(5516):468-472.
[9] Schumacker PT. Hypoxia-inducible factor-1 (HIF-1) [J]. Mol Pharmacol,2006,70(5):1469-1480.
[10] Semenza GL. Oxygen sensing, hypoxia-inducible factors,and disease pathophysiology [J]. Annu Rev Pathol,2014, 9(1):47-71.
[11] Schofield CJ,Ratcliffe PJ. Oxygen sensing by HIF hydroxylases [J]. Nat Rev Mol Cell Biol,2004,5(5):343-354.
[12] Holmquist-Mengelbier L,Fredlund E,L fstedt T,et al. Recruitment of HIF-1alpha and HIF-2alpha to common target genes is differentially regulated in neuroblastoma:HIF-2alpha promotes an aggressive phenotype [J]. Cancer Cell,2006,10(5):413-423.
[13] Murugesan T,Rajajeyabalachandran G,Kumar S,et al. Targeting HIF-2α as therapy for advanced cancers [J]. Drug Discov Today,2018,23(7):1444-1451.
[14] Chen S,Xi C,Wei L,et al. Conversion of epithelial-to-mesenchymal transition to mesenchymal-to-epithelial transition is mediated by oxygen concentration in pancreatic cancer cells [J]. Oncol Lett,2018,15(5):7144-7152.
[15] Chen S,Chen JZ,Zhang JQ,et al. Hypoxia induces TWIST-activated epithelial-mesenchymal transition and proliferation of pancreatic cancer cells in vitro and in nude mice [J]. Cancer Lett,2016,383(1):73-84.
[16] Leone L,Mazzetta F,Martinelli D,et al. Klebsiella pneumoniae Is Able to Trigger Epithelial-Mesenchymal Transition Process in Cultured Airway Epithelial Cells [J]. PLos One,2016,11(1):e0 146 365.
[17] Zhang J,Cheng Q,Zhou Y,et al. Slug is a key mediator of hypoxia induced cadherin switch in HNSCC: correlations with poor prognosis [J]. Oral Oncol,2013,49(11):1043-1050.
[18] Hubbi ME,Kshitiz Gilkes DM,et al. A nontranscriptional role for HIF-1α as a direct inhibitor of DNA replication [J]. Sci Signal,2013,6(262):ra10.
[19] Eliasson P,J?觟nsson JI. The hematopoietic stem cell niche:low in oxygen but a nice place to be [J]. J Cell Physiol,2010,222(1):17-22.
[20] Hubbi ME,Semenza GL. Regulation of Cell Proliferation by Hypoxia-Inducible Factors [J]. Am J Physiol Cell Physiol,2015,309(12): C775-C782.
(收稿日期:2018-07-09 本文編辑:王 蕾)

