核桃蛋白组分的营养价值、功能特性及抗氧化性研究
韩海涛,宴正明,张润光,戚登斐,杨 涛,张有林
(1.陕西师范大学 食品工程与营养科学学院,西安 710119; 2.陕西省林业科学院,西安 710082)
核桃(JuglanslegiaL.)又名胡桃,起源于亚洲西部[1],在我国种植面积广泛,截至2015年底,栽培面积320万hm2,年产量290万t[2],居世界首位。核桃除直接食用外,还用来榨取核桃油。核桃仁冷榨取油后的核桃饼,依然保留大部分营养物质,其中蛋白质含量高达50%,且18种氨基酸齐全,精氨酸含量很高[3-5],这些成分对人体具有良好的保健功能[6-8]。但目前我国核桃饼粕多用作肥料或饲料,造成优质蛋白资源极大浪费[9]。
蛋白质中可溶性组分与蛋白质的功能特性密切相关。大豆蛋白中的7S球蛋白具有良好的乳化性,决定了大豆蛋白的凝胶特性[10]。绿豆清蛋白、玉米醇溶蛋白、燕麦球蛋白等因其特殊的理化性质被广泛应用于食品加工。蛋白的溶解度影响其功能特性,一般溶解性好的蛋白质更有利于广泛应用。添加溶解度高的蛋白可提高饮料制品的营养价值,且具有透明度好、黏度高等优点[11]。目前,利用植物蛋白分离组分的特殊功能生产多元功能产品已屡见不鲜。
在蛋白保健功能研究方面,多种蛋白以及相关的多肽产品被广泛应用。从绿豆蛋白中分离抗氧化活性肽[12],大豆多肽具有降血压、降胆固醇等功能[13],从海地瓜蛋白、金枪鱼蛋白中分离ACE抑制肽[14-15]。核桃蛋白具有一定的抗氧化性,并能有效防御心血管疾病、肥胖症、糖尿病等多种疾病[16-18]。核桃蛋白具有药食同源性,且可以改善食品原有品质,但针对其组分分离的研究少有报道。本研究分离与纯化核桃粕中的主要蛋白质,并研究这些蛋白质的营养价值、功能特性及抗氧化性,旨在为核桃蛋白的综合利用提供理论依据。
1 材料与方法
1.1 试验材料
“清香”核桃,购于安康市汉滨区瀛湖镇。
硫酸、硫酸钾、硫酸铜、石油醚、乙醇、铁氰化钾、三氯乙酸、氯化铁、氯化亚铁、冰乙酸、磷酸二氢钠、磷酸氢二钠、氢氧化钠、氯化钠、考马斯亮蓝G250、牛血清白蛋白、8-苯胺-1-萘磺酸(ANS)、1,1-二苯基-2-三硝基苯肼(DPPH),均为分析纯。
Kjeltec2300型全自动凯氏定氮仪,瑞典福斯公司;L-8900全自动氨基酸分析仪,日本Hitachi公司;DL-4C低速大容量离心机,奥林巴斯公司;XHF-D高速分散器;RF-6000荧光分光光度计,日本岛津公司;PHS-3C精密pH计;QL-866旋涡混合器。
1.2 试验方法
1.2.1 核桃蛋白的分离与纯化
将核桃仁粉碎,用液压榨油机冷榨50 min取油后得到核桃饼,粉碎。取一定量核桃饼粉,按料液比1∶5加入石油醚,振荡3 h,抽滤,重复两次,45℃烘干得到脱脂核桃粕。采用Kumar等[19]的方法,收集核桃总蛋白。采用王美玉等[20]的方法,分别收集清蛋白、球蛋白、醇溶蛋白、谷蛋白-1、谷蛋白-2溶液。将总蛋白、球蛋白、谷蛋白-1及谷蛋白-2溶液透析48 h。将所有蛋白组分冻干,-20℃下保存备用。
1.2.2 氨基酸组成测定
利用凯氏定氮法测定各组分的蛋白质含量,按照谢蓝华等[21]的方法测定氨基酸含量。并计算非极性氨基酸含量(NPS)和极性氨基酸含量与非极性氨基酸含量的比率(P)。
1.2.3 溶解度测定
用pH 7.0的PB缓冲液(0.01 mol/L)将核桃蛋白配制成1 mg/mL溶液,搅拌30 min,于4℃、8 000 r/min离心20 min,收集上清液,用凯氏定氮法测定上清液及样品中蛋白质含量并计算氮溶指数(NSI)。
NSI=上清液蛋白质含量/样品中蛋白质含量×100%
1.2.4 表面疏水性测定
疏水性的测定采用ANS荧光探针法[22]。以蛋白质质量浓度为横坐标,荧光强度为纵坐标作图,所得曲线的斜率即为核桃蛋白组分的表面疏水性指数。
1.2.5 乳化性及乳化稳定性测定
采用浊度法测定5种核桃蛋白组分在不同NaCl浓度下的乳化性及乳化稳定性。
乳化性(EAI)=2.303×2×A0×稀释因子/(C×Φ×10 000)
乳化稳定性(ESI)=At/A0×100%
式中:C为蛋白质质量浓度,1 mg/mL;Φ为组分蛋白对应乳状液的油体积(0.25);稀释因子为50;A0为500 nm下稀释的乳状液的吸光值;At为500 nm下稀释的乳状液10 min后的吸光值。
1.2.6 起泡性及泡沫稳定性测定
取30 mL 0.5 mg/mL的蛋白样品,NaCl浓度分别为0.1、0.2、0.3、0.4、0.5、0.6 mol/L,均质(10 000 r/min,1 min),记录均质停止时体积(V0)以及10 min后泡沫的体积(Vt),计算起泡性及泡沫稳定性。
起泡性(FC)=V0/30×100%
泡沫稳定性(FS)=Vt/V0×100%
1.2.7 DPPH自由基清除率测定
参照文献[23]测定核桃蛋白组分的DPPH自由基清除率,以0.4 mg/mL丁羟甲苯(BHT)作对照。
1.2.8 还原力测定
量取1 mL样品溶液(0.5 mg/mL)、2.5 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)、2.5 mL铁氰化钾溶液(10 mg/mL,0.1%)混匀,将混合物在50℃下水浴20 min。在混合物中加入2.5 mL TCA(100 mg/mL),4 000 r/min下离心10 min。取上清液、蒸馏水和氯化铁(10 mg/mL,0.1%)各2.5 mL混合,反应10 min后测定700 nm处吸光值。空白对照不加氯化铁,空白对照为0.1 mg/mL丁羟甲苯(BHT),以吸光值反映还原力。
1.2.9 羟基自由基清除率测定
参照文献[24]测定核桃蛋白组分的羟基自由基清除率。
1.2.10 超氧阴离子自由基清除率测定
参照文献[25]测定核桃蛋白组分的超氧阴离子自由基清除率。
1.2.11 金属螯合性测定
将1 mL的样品(0.5 mg/mL)加入蒸馏水至2.8 mL,并添加50 μL 2 mmol/L的FeCl2和150 μL 2 mmol/L的菲啰嗪,10 min后在波长562 nm处测吸光值At,以1 mL蒸馏水代替样品作为空白对照,测其吸光值A0。计算金属离子整合率。
螯合率=(1-At/A0)×100%
1.2.12 营养价值评价
蛋白质营养价值的评价方法主要有生物学法和氨基酸分析评价法。根据核桃所含主要蛋白质的类型,本文采用氨基酸分析评价法[26],通过测定核桃粕蛋白质体外消化率(IVPD)、必需氨基酸含量等参数,并与FAO/WHO推荐的氨基酸含量对比评价其营养价值[27]。体外消化率采用双酶法测定。
2 结果与分析
2.1 核桃饼粕中主要成分及含量(见表1)

表1 核桃饼粕中主要成分及含量 %
由表1可知,核桃饼中蛋白质含量为48.64%,脱脂核桃粕中蛋白质含量为60.05%。此外,脱脂核桃粕提取可溶性蛋白质组分得到6.63%清蛋白、14.89%球蛋白、5.81%醇溶蛋白、21.9%酸性谷蛋白(谷蛋白-1)和50.77%碱性谷蛋白(谷蛋白-2),由此看出谷蛋白是核桃蛋白的主要成分,尤其是碱性谷蛋白,这与Sze-Tao等[28]研究结果略有不同,可能是原料差异所致。
2.2 核桃蛋白组分营养价值与理化性质
2.2.1 核桃蛋白组分氨基酸组成与营养特征(见表2)
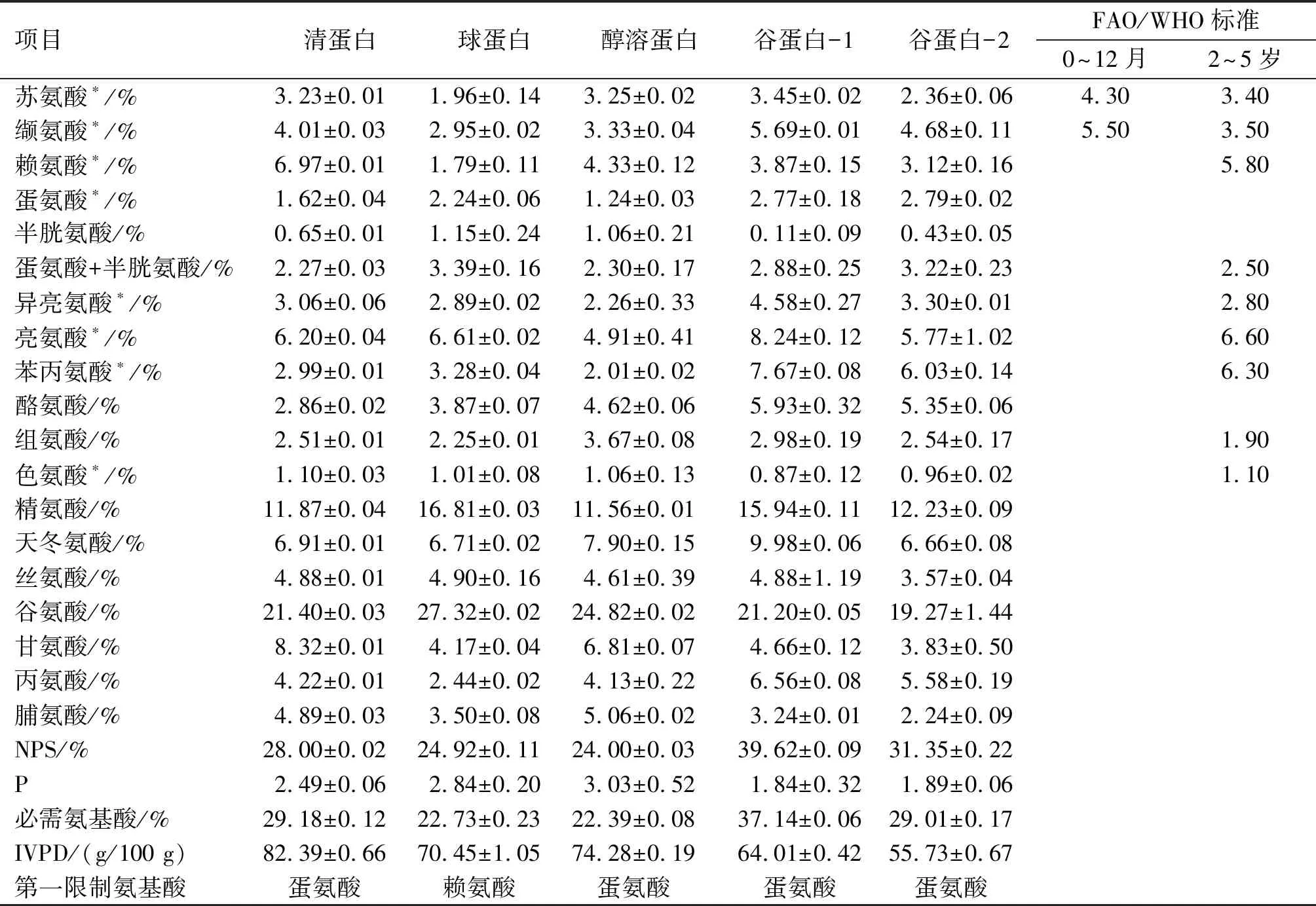
表2 核桃蛋白组分氨基酸组成及营养特征
注:*代表必需氨基酸;非极性氨基酸包括缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、色氨酸、丙氨酸、脯氨酸;其他为极性氨基酸。
由表2可以看出,5种蛋白质组分中氨基酸含量最高的为谷氨酸,其次为精氨酸。清蛋白和醇溶蛋白的氨基酸组成类似,两者的体外消化率(IVPD)虽然较高,但是由于氨基酸组成不够均衡,营养价值整体偏低。谷蛋白-1与醇溶蛋白天冬氨酸含量较高,谷蛋白-1的芳香族氨基酸(酪氨酸、苯丙氨酸和色氨酸)含量和必需氨基酸含量在5种蛋白组分中最高,谷蛋白-1的NPS值最高,P值最低。
2.2.2 核桃蛋白组分的功能特性
在室温、pH 7.0条件下测定核桃蛋白各组分的溶解度。在室温、NaCl浓度0 mol/L下测定核桃蛋白各组分的乳化特性和起泡特性,结果见表3。
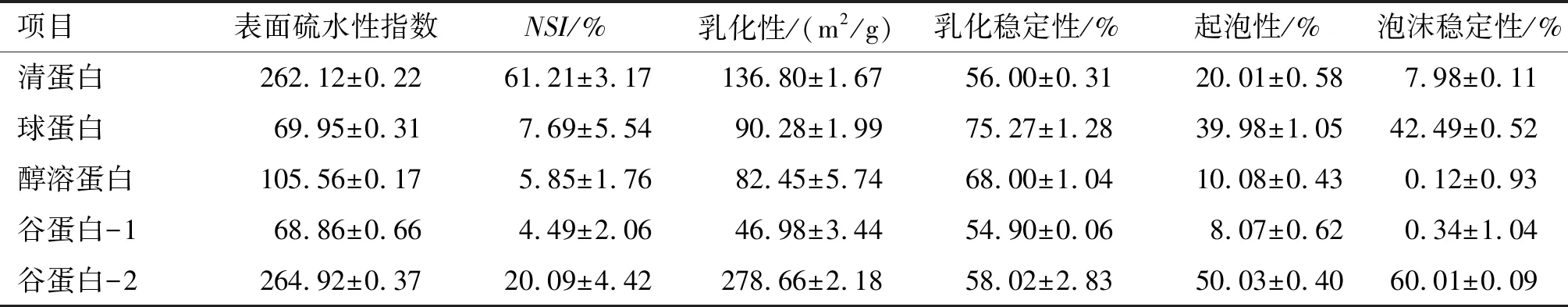
表3 核桃蛋白组分的功能特性
由表3可以看出,5种核桃蛋白组分中,清蛋白、谷蛋白-2以及醇溶蛋白的表面疏水性较高,谷蛋白-1最低。清蛋白的氮溶指数最高,为61.21%,从整体上看,核桃蛋白组分的溶解性较差,原因可能是原料中存在酚类与单宁类物质。5种蛋白均显示出良好的乳化性和乳化稳定性,其中谷蛋白-2的乳化性最高,其次是清蛋白,5种蛋白良好的乳化性可能与其较高的表面疏水性有关,蛋白质分子可以快速进入油相和水相界面形成乳化层,表现出良好的乳化性。球蛋白的乳化稳定性最高,其次是醇溶蛋白。谷蛋白-2和球蛋白具有相对较好的起泡性和泡沫稳定性,醇溶蛋白和谷蛋白-1起泡性和泡沫稳定性较差。
2.2.3 NaCl浓度对核桃蛋白组分乳化特性、起泡特性的影响(见图1~图4)
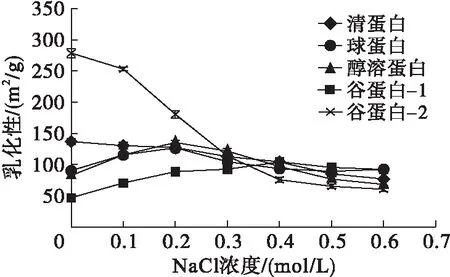
图1 核桃蛋白组分的乳化性与NaCl浓度之间的关系
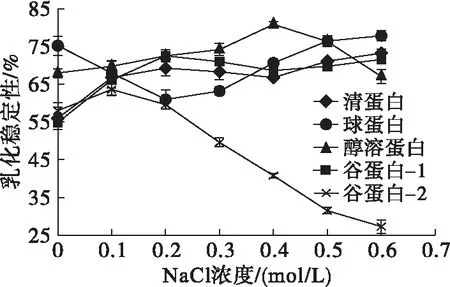
图2 核桃蛋白组分的乳化稳定性与NaCl浓度之间的关系
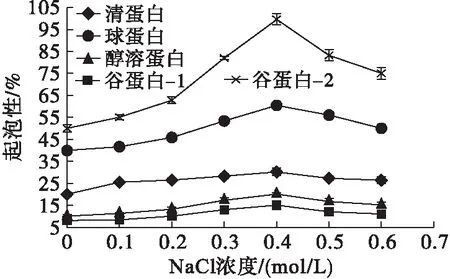
图3 核桃蛋白组分的起泡性与NaCl浓度之间的关系
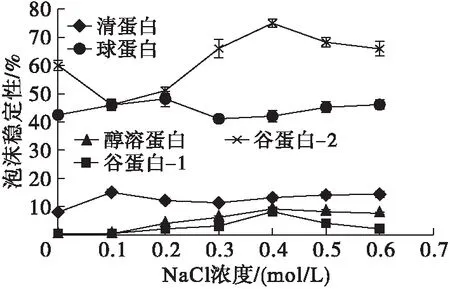
图4 核桃蛋白组分的泡沫稳定性与NaCl浓度之间的关系
由图1、图2可以看出,不同核桃蛋白组分,NaCl浓度对其乳化特性的影响不同。谷蛋白-2的乳化性随着NaCl浓度的增加急剧降低,清蛋白的乳化性随NaCl浓度的增加而缓慢下降,谷蛋白-1的乳化性在NaCl浓度0~0.4 mol/L随NaCl浓度增加而升高,在0.4~0.6 mol/L随NaCl浓度增加而下降,球蛋白与醇溶蛋白的乳化性在NaCl浓度0~0.2 mol/L随浓度增加而升高,在0.2~0.4 mol/L随浓度增加而下降,在0.4~0.6 mol/L趋于平稳。清蛋白与谷蛋白-1的乳化稳定性在NaCl浓度0~0.2 mol/L随浓度增加而升高,在0.2~0.4 mol/L随浓度增加而下降,在0.4~0.6 mol/L随浓度增加而上升。球蛋白的乳化稳定性在NaCl浓度0~0.2 mol/L随浓度增加而下降,在0.2~0.6 mol/L随浓度增加而升高,醇溶蛋白的乳化稳定性在NaCl浓度0~0.4 mol/L随浓度增加而升高,在0.4~0.6 mol/L随浓度增加而下降。原因可能是不同NaCl浓度下各蛋白组分的表面疏水性发生了变化,从而影响了乳化性与乳化稳定性。
由图3、图4可以看出,5种核桃蛋白组分中,谷蛋白-2和球蛋白具有相对较好的起泡性和泡沫稳定性,二者的起泡性在NaCl浓度0~0.4 mol/L时随浓度增加而升高,在NaCl浓度0.4~0.6 mol/L时随浓度增加而降低。谷蛋白-2的泡沫稳定性在NaCl浓度0~0.1 mol/L随浓度增加而下降,在0.1~0.4 mol/L随浓度增加而升高,在0.4~0.6 mol/L随浓度增加而下降。球蛋白的泡沫稳定性在NaCl浓度0~0.2 mol/L随浓度增加而升高,在0.2~0.3 mol/L随浓度增加而下降,在0.3~0.6 mol/L随浓度增加而缓慢升高。醇溶蛋白、清蛋白、谷蛋白-1的起泡性和泡沫稳定性较差。原因可能是不同NaCl浓度下蛋白质发生“盐溶”“盐析”的结果。
2.3 核桃蛋白组分的抗氧化性(见表4)
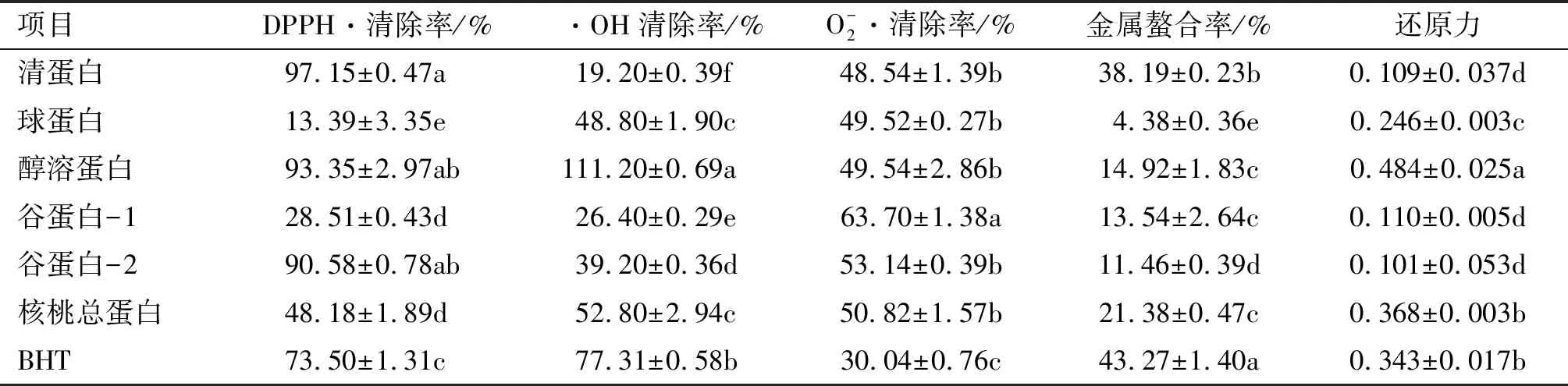
表4 核桃蛋白组分的抗氧化性
注:同列不同字母表示差异显著(p<0.05)。
由表4可知,在相同质量浓度下,清蛋白、醇溶蛋白和谷蛋白-2的DPPH自由基清除能力最高,分别是97.15%、93.35%和90.58%,明显高于BHT的(73.50%),很可能是因为这3种蛋白具有较高的表面疏水性。而球蛋白和谷蛋白-1的DPPH自由基清除率较低,可能是因为其表面疏水性较低。
有研究[29]表明,抗氧化活性和还原力之间可能存在正相关性,可以通过还原力的大小来表示抗氧化活性的强弱。由表4可知,醇溶蛋白的还原力最高,且显著高于BHT的,可以作为良好的抗氧化剂,其次是球蛋白。
在相同质量浓度下,5种核桃蛋白组分的羟基自由基清除活性大小顺序为醇溶蛋白>球蛋白>谷蛋白-2>谷蛋白-1>清蛋白。其中,醇溶蛋白对羟基自由基的清除能力(111.2%)明显超过BHT的(77.31%)。羟基自由基清除活性与一些生理活性有直接关系,具有一定的羟基自由基清除活性,很有可能具有ACE抑制活性[30]。
5种核桃蛋白组分的超氧阴离子自由基清除率大小顺序为谷蛋白-1>谷蛋白-2 >醇溶蛋白>球蛋白>清蛋白,并且均高于BHT的。
金属离子在自由基氧化过程中充当催化剂,因此将其螯合可降低其催化作用。由表4可知,5种核桃蛋白组分对金属离子的螯合能力均低于对照BHT的。
3 结 论
从核桃粕中提取5种核桃蛋白组分,对其营养价值、功能特性及抗氧化性进行测定。5种蛋白质氨基酸组成中,谷氨酸含量最高,精氨酸次之。谷蛋白-2的乳化性、起泡性和泡沫稳定性最佳,分别为278.66 m2/g、50.03%、60.01%。球蛋白乳化稳定性最高,为75.27%。清蛋白对DPPH自由基清除能力最高,清除率为97.15%,其次为醇溶蛋白,清除率为93.35%,均高于BHT的(73.50%),醇溶蛋白金属螯合性虽低于BHT,但还原力高于BHT,抗氧化活性和还原力之间存在正相关性,说明醇溶蛋白可以作为良好的抗氧化剂。

