东北三省棕黑锦蛇(Elaphe schrenckii)与赤峰锦蛇(Elaphe anomala)基于Cyt b基因的序列多态性及遗传多样性
苏思博,黄 松,董丙君
(1.沈阳师范大学生命科学学院,辽宁沈阳110034;2.黄山学院生命与环境科学学院,安徽黄山245041)
棕黑锦蛇(Elapheschrenckii)和赤峰锦蛇(Elapheanomala)现隶属于爬行纲(Reptilia)、双孔亚纲(Diapsida)、有鳞目(Squamata)、蛇亚目(Serpentes)、游蛇科(Colubridae)、锦蛇属(Elaphe)。棕黑锦蛇在中国主要分布于黑龙江省和吉林省,辽宁省东部山地也有分布且为分布最南限,境外分布于朝鲜和俄罗斯西伯利亚。赤峰锦蛇在中国主要分布于长江以北,在长江流域也有发现,内蒙古为分布最北限,境外主要分布于朝鲜。二者重叠分布于我国辽宁省和朝鲜。主要栖息于平原、丘陵、山区、田园、草丛、桥下、塘边、林边、柴草垛、破旧房屋乃至住宅的屋顶。能攀树,食鼠类为主,亦食鸟类和鸟卵[1-4]。近年来,由于受到气候变化、栖息地的破坏和环境的污染等因素影响,二者的野生种群数量已呈现下降的趋势,对棕黑锦蛇和赤峰锦蛇现存种群进行遗传多样性研究分析,并据此开展有效的保护已成为迫在眉睫的问题[5-6]。
Strauch(1873)[7]依据西伯利亚东部兴安军邮站标本,发表棕黑锦蛇Elaphisschrenckii;Stejneger(1907)[8]将锦蛇属属名Elaphis改为Elaphe;Boulenger(1916)[9]将采自中国内蒙古赤峰的标本命名为赤峰游蛇Coluberanomalus;Pope(1935)[10]将赤峰游蛇Coluberanomalus改隶锦蛇属Elaphe,并依据河北东陵兴隆山、山西葫芦里、青岛的标本提出赤峰游蛇Coluberanomalus应为棕黑锦蛇Elapheschrenckii的亚种,并指出分布于俄罗斯西伯利亚东部、中国东北及朝鲜的为棕黑锦蛇指名亚种Elapheschrenckiischrenckii,而分布于中国内蒙古赤峰及华北的为棕黑锦蛇赤峰亚种Elapheschrenckiianomala[1-4,11-12]。此后许多学者都沿用这一观点[13-21]。季达明(1994)提出将后一亚种恢复为种级,仍称赤峰锦蛇(Elapheanomala)[11-12],该意见为黄美华(1998)在《中国动物志》中所采用,也被一些其他学者所采纳[2,4,22-26]。
目前关于棕黑锦蛇和赤峰锦蛇的研究多集中于形态解剖学、细胞遗传学、保护生物学等学科领域[3,6,19-21,26-29],而在其基因序列多态性及种群遗传多样性等方面的研究尚未得到充分开展。本研究收集了分布于我国东三省地区的棕黑锦蛇和赤峰锦蛇12个种群(棕黑锦蛇6个种群,赤峰锦蛇6个种群)共41个样品(棕黑锦蛇18个样品,赤峰锦蛇23个样品),利用线粒体DNA(Mitochondrial DNA,mtDNA)细胞色素b(Cytochromeb,Cytb)基因部分序列分析,分别探究棕黑锦蛇和赤峰锦蛇遗传多样性及种群遗传结构。
1 材料与方法
1.1 样品采集
本研究在9个采样区共采集41个棕黑锦蛇和赤峰锦蛇标本(图1)。棕黑锦蛇采样点按照地区及距离分为黑龙江大佳河乡(DJH)、牡丹江(MDJ),吉林露水河镇(LSH),辽宁沈阳(SY)、新宾(XB)、本溪(BX)6个地理区域;赤峰锦蛇采样点按照地区及距离分为辽宁沈阳(SY)、新宾(XB)、本溪(BX)、抚顺(FS)、岫岩(XY)、营口(YK)6个地理区域(表1)。以地理区系就近为原则,每两个采样点之间的直线距离不超过60 km为依据来进行现有采样点的分组。采集个体通过外部形态鉴别并做好记录,野外活体剪取尾部肌肉组织至装有95%酒精的组织管中固定,带回实验室置于-20℃冰箱备用,样本采集后活体放生。

图1 棕黑锦蛇与赤峰锦蛇采样区分布图
注:正方形代表棕黑锦蛇的采样分布,圆形代表赤峰锦蛇的采样分布。图中每个圆形或者正方形代表一个分组分布地,圆形或者正方形面积相等,圆形或者正方形内的单倍型代表颜色的占有面积与单倍型对应的个体数目成正比。

38SU36辽宁新宾满族自治县新宾(XB)39SU38辽宁新宾满族自治县新宾(XB)40SU39辽宁新宾满族自治县新宾(XB)41SU40辽宁铁岭凡河新区沈阳(SY)
1.2 基因组DNA提取及PCR扩增
样品基因组DNA使用天根基因组提取试剂盒(北京天根生化科技有限公司)提取。线粒体Cytb基因序列采用通用引物L14919(5’-AACCACCGTTGTTATTCAACT-3’)和H16064(5’-CTTTGGTTTACAAGAACAATGCTTTA-3’)[30-32]进行PCR扩增,引物由上海生工生物工程股份有限公司合成。PCR扩增反应总体系为25 μL,其中2×Mix(Taq PCR Master Mix 2x,blue dye,上海生工生物工程股份有限公司)12.5 μL,上游引物、下游引物各1 μL,模板DNA 1 μL,双蒸水9.5 μL。PCR反应条件为:94℃预变性7 min;94℃变性40 s,46℃退火30 s,72℃延伸1 min,共40个循环;最后在72℃延伸8 min。扩增产物经琼脂糖凝胶电泳检测后,送上海生工生物工程股份有限公司进行纯化回收及双向测序。
1.3 数据处理与分析
用DNASTAR软件包对所得序列进行编辑、校对和排序。用DNASP软件统计单倍型数目、多态位点、插入/缺失等分子多态指数,并进行Fs中性检验。用MEGA软件基于Kimura双参数模型计算群体间遗传距离。用ARLEQUIN软件计算两两群体FST值,并进行AMOVA分析。用MRBAYES软件基于AIC准则的HKY+I模型构建贝叶斯系统树。用NETWORK软件构建中介网络图(median-joining network)。
2 结果与分析
2.1 序列变异
对41条棕黑锦蛇、赤峰锦蛇的Cytb基因序列进行分析,删除首尾测序不准确的部分片段,将序列的起始位置设置在密码子的第一位,共获得用于分析的DNA序列长度为1086 bp。在棕黑锦蛇的18条序列中,变异位点3个,无碱基的缺失或插入,转换/颠换比为148.645。A、T、G、C碱基平均含量分别为33.4%、27.3%、11.0%、28.3%。在赤峰锦蛇的23条DNA序列中,变异位点3个,无碱基的缺失或插入,转换/颠换比为0.006。A、T、G、C碱基平均含量分别为33.5%、27.3%、10.9%、28.3%。
棕黑锦蛇18条序列共定义了4个单倍型,其中单倍型Hap1为MDJ、LSH、SY、XB、BX共5个种群共享,在5个种群中分别占4/5、1/1、2/3、6/6、2/2;Hap2为DJH种群特有,占1/1;Hap3为SY种群特有,占1/3;Hap4为MDJ种群特有,占1/5(表2)。赤峰锦蛇的23条序列共定义了3个单倍型,其中单倍型Hap1为SY、XB、BX、FS、XY、YK共6个种群共享,在6个种群中分别占1/2、2/2、7/7、7/7、1/2、3/3;Hap2为SY种群特有,占1/2;Hap3为XY种群特有,占1/2(表3)。

表2 棕黑锦蛇线粒体Cyt b基因的变异位点及单倍型在6个种群中的分布

表3 赤峰锦蛇线粒体Cyt b基因的变异位点及单倍型在6个种群中的分布
2.2 遗传多样性与群体遗传结构
棕黑锦蛇与赤峰锦蛇12个地理种群的遗传多样性参数如表4所示,种群内样本数N大于1才可进行遗传多样性相关参数的分析,故舍去DHJ种群(N=1)和LSH(N=1)的分析结果。棕黑锦蛇总体单倍型数为4,单倍型多样性为0.314,核苷酸多样性为0.01894,平均核苷酸差异数为0.3333。赤峰锦蛇总体单倍型数为3,单倍型多样性为0.170,核苷酸多样性为0.00024,平均核苷酸差异数为0.2609。
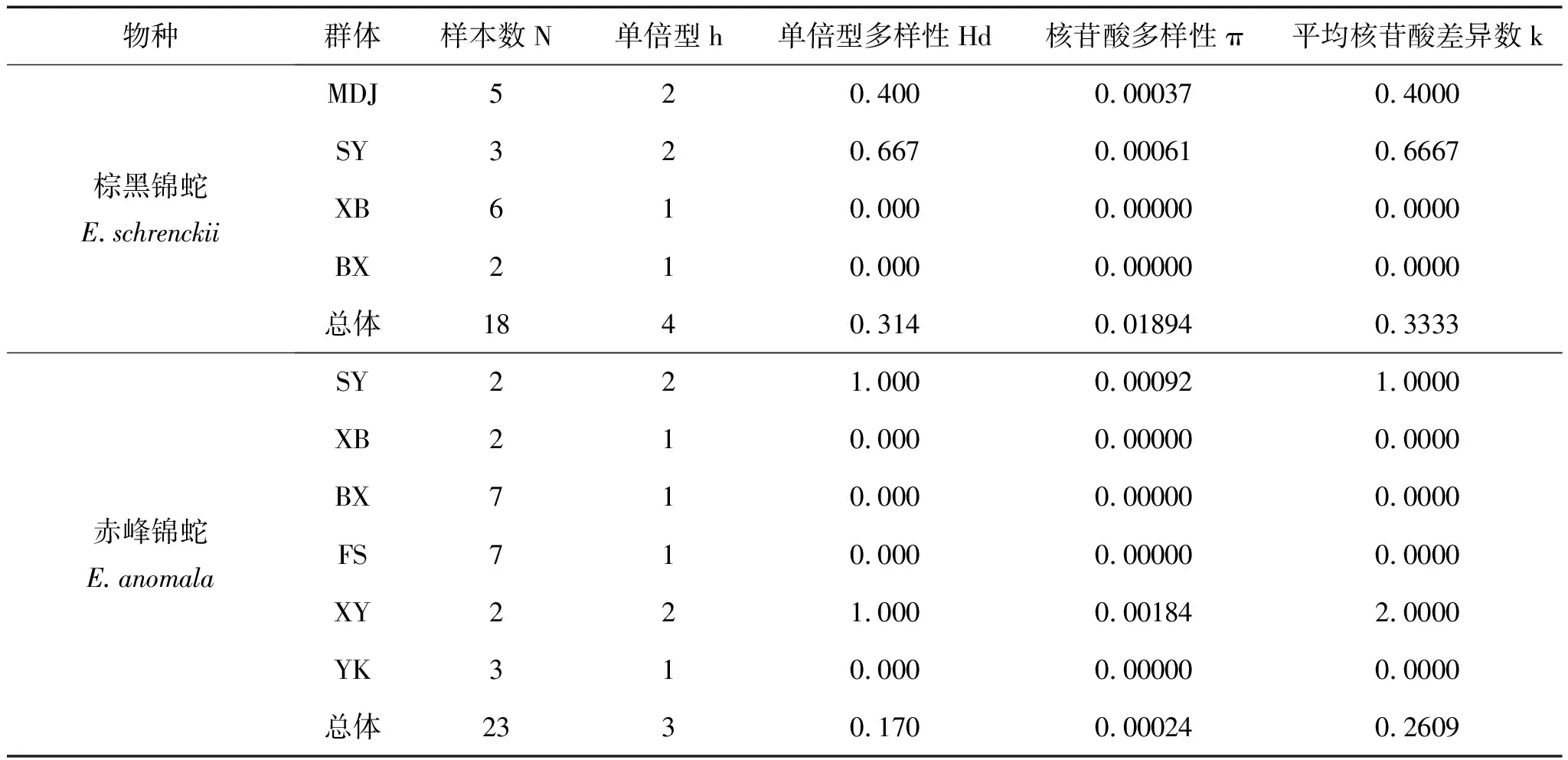
表4 基于Cyt b基因序列的棕黑锦蛇与赤峰锦蛇群体的遗传多样性参数
使用ARLEQUIN软件统计群体间遗传分化指数(FST),以判断不同地理群体之间是否存在遗传分化(表5,表6)。对棕黑锦蛇的分析结果表明,DJH与LSH、XB、BX群体间的FST值最大(1.00000),其他群体间的FST值存在负值(表5);对赤峰锦蛇的分析结果表明,SY与BX、FS群体间、XY与BX、FS群体间的FST值最大(0.58824),其他群体间的FST值较小(表6)。棕黑锦蛇与赤峰锦蛇的各个群体间分别对应于FST值的基因流值(Nm)如表5,表6所示。对棕黑锦蛇的分析结果显示,MDJ与XB群体间的Nm值最大(6.00000),MDJ与SY群体间的Nm值次之(5.89251),其他群体间的Nm值为无限大或较小(表5)。对赤峰锦蛇的分析结果显示,YK与SY、XY群体间的Nm值最大(0.75000),其他群体间的Nm值较小(表6)。

表5 棕黑锦蛇群体间的基因流值Nm(对角线下方)和遗传分化指数FST(对角线上方)
注:n.a.=not applicable,代表不适用。Inf=infinite,代表无限大。

表6 赤峰锦蛇群体间的基因流值Nm(对角线下方)和遗传分化指数FST(对角线上方)
注:n.a.=not applicable,代表不适用。
运用MEGA软件基于Kimura双参数模型分别计算棕黑锦蛇与赤峰锦蛇群体间遗传距离(GD)(表7)。棕黑锦蛇的GD值在0.00000~0.00123之间,其中SY与DJH群体间的GD值最大(0.00123);赤峰锦蛇的GD值在0.00000~0.00138之间,其中XY与SY群体间的GD值最大(0.00138)。

表7 棕黑锦蛇与赤峰锦蛇群体间的遗传距离GD值
注:对角线下方为棕黑锦蛇群体间的GD值,对角线上方为赤峰锦蛇群体间的GD值。
据分子方差分析(Analysis of molecular variance,AMOVA)显示,棕黑锦蛇6个种群之间的遗传变异占总变异的30.97%,种群内的遗传变异占总变异的69.03%;赤峰锦蛇6个种群之间的遗传变异占总变异的37.12%,种群内的遗传变异占总变异的62.88%(表8)。

表8 棕黑锦蛇与赤峰锦蛇种群的分子变异分析(AMOVA)表
2.3 系统发育关系
以日本锦蛇Elapheclimacophora和日本四线锦蛇Elaphequadrivirgata做为外群基于Cytb基因构建的贝叶斯系统发育树显示,棕黑锦蛇与赤峰锦蛇12个种群的41个个体形成2个支系(图2);其中,第一族群包括赤峰锦蛇的23个个体,第二族群则由棕黑锦蛇的18个个体组成。单倍型间分子系统树中棕黑锦蛇与赤峰锦蛇的单倍型各自聚类,与物种树结果相一致。
2.4 单倍型间关系
棕黑锦蛇的网络关系图呈放射状结构,存在一个主体单倍型Hap1,Hap1由5个种群共享,不包含DJH种群;Hap2为DJH种群特有单倍型,Hap3为SY种群特有单倍型,Hap4为MDJ种群特有单倍型;在共享Hap1的5个种群中,Hap1的频率均为最高;各单倍型之间关系较近,主体单倍型之外的其他单倍型均经过两步突变完成。赤峰锦蛇的网络关系图呈放射状结构,存在一个主体单倍型Hap1,Hap1由全部的6个种群共享;Hap2为SY种群特有单倍型,Hap3为XY种群特有单倍型;在全部的种群中,Hap1的频率均为最高;各单倍型之间关系较近,主体单倍型之外的其他单倍型不均是经过两步突变完成的,最多的也只经过三步突变(图3)。
2.5 种群历史动态
利用线粒体DNA序列分析种群历史的分析方法主要有中性检验和岐点分布分析等[33]。由DNASP软件对棕黑锦蛇与赤峰锦蛇群体的Cytb基因序列的中性检验值进行分析,其中赤峰锦蛇总群体的Fu and Li’s F*参数值为负的显著值,其他总群体的参数值均为不显著负值。对棕黑锦蛇与赤峰锦蛇群体的基因序列的岐点分布进行分析,得到棕黑锦蛇与赤峰锦蛇总群体的Cytb基因的岐点分布图(图4)。

图2 基于线粒体Cyt b基因序列构建的棕黑锦蛇与赤峰锦蛇的贝叶斯系统发育树注:支持率小于0.95的节点未标注。对应单倍型关系的个体已标注。

图3 棕黑锦蛇与赤峰锦蛇的单倍型网络图注:图中每个圆代表一个单倍型,圆圈面积与单倍型频率成正比。单倍型之间的连线显示了它们的进化关系,连线上的数字表示核苷酸突变位点,数字的个数表示两单倍型之间的突变步数。

图4 棕黑锦蛇与赤峰锦蛇总群体的Cyt b基因岐点分布图
3 讨论
3.1 遗传多样性
探究物种遗传变异有助于揭示物种起源与进化历史[34]。遗传多样性是物种适应环境和进化的基础,丰富的遗传多样性可以维持种群的多样性,遗传多样性的缺失会威胁到种群的生存。一般而言,一个种群在相当长的时间内比较稳定且资源量丰富时,该种群可能会维持较高的遗传多样性;当种群遭受瓶颈效应时,种群遗传多样性将会受遗传漂变的影响而降低[35]。
对采自黑龙江省、吉林省、辽宁省的棕黑锦蛇与赤峰锦蛇12个种群41个个体样品的Cytb序列进行了相关分析,棕黑锦蛇群体中仅发现4个单倍型,6个种群中没有所有种群共享的单倍型;赤峰锦蛇群体中仅发现3个单倍型,6个种群中有所有种群共享的单倍型为Hap1。棕黑锦蛇的不同地理群体间总体单倍型多样性Hd值和核苷酸多样性π值分别为0.314和1.894%,总体上表现出较低的单倍型多样性(Hd=0.314<0.5)和较高的核苷酸多样性(π=1.894%>0.5%)。赤峰锦蛇的不同地理群体间总体单倍型多样性Hd值和核苷酸多样性π值分别为0.170和0.024%,总体上表现出较低的单倍型多样性(Hd=0.170<0.5)和较低的核苷酸多样性(π=0.024%<0.5%)。棕黑锦蛇低单倍型多样性、高核苷酸多样性的结果表明,棕黑锦蛇种群可能经历过瓶颈效应或奠基者效应[36];线粒体基因进化速率快、物种生命周期不长、样本量较少、分布不均匀等因素也可能影响其遗传多样性。赤峰锦蛇低单倍型多样性、低核苷酸多样性的结果表明,短时间内的少量突变不能积累足够的核苷酸多样性,从而导致种群核苷酸多样性较低;此外,过度抓捕、环境污染和栖息地破坏等人为因素也可能加剧遗传多样性的丧失。
3.2 遗传分化
由于长期地理隔离,同一物种的不同地理种群可能产生遗传分化[37]。遗传分化可以衡量群体间或群体内的分化程度,研究遗传分化变异的主要参数有遗传分化指数(FST)、基因流(Nm)、遗传距离(GD)与构建系统进化树等,同时分子方差分析(AMOVA)也是研究种群间遗传分化的重要指标。
遗传分化指数(FST)表示的是不同地理种群之间等位基因数目的差异情况,能够反映所研究种群的分化程度及种群结构。FST值越高,表示两个地理种群之间的基因交流越少,遗传分化越高。若种群FST值在0~0.05之间,说明不存在分化;FST值在0.05~0.15之间,为低度分化;FST值在0.15~0.25之间,为中度分化;FST值大于0.25,则为高度分化[38]。据此标准,本研究中的棕黑锦蛇6个种群中的DJH种群与其他5个种群间的FST值均大于0.25,即其间存在高度遗传分化;SY与XB种群间的FST值在0.15~0.25之间,即其间存在中度遗传分化;其他种群两两之间的FST值均在0~0.05之间或为负值,即其间均不存在遗传分化。赤峰锦蛇的6个种群中的SY与BX、FS种群间,XY与BX、FS种群间的FST值均大于0.25,表明其间存在高度的遗传分化;YK与SY、XY种群间的FST值在0.15~0.25之间,表明其间存在中度遗传分化;其他种群两两之间的FST值均在0~0.05之间或为负值,即其间均不存在遗传分化。整体来看,棕黑锦蛇与赤峰锦蛇各自的大部分种群间没有明显的遗传分化,个别种群之间存在分化。从地理分布上来看,地理距离相对较近的采样点之间的群体比较容易存在交流,而地理距离相对较远的采样点之间的群体交流容易受到限制,则这些地点的群体两两之间的遗传分化就比较大,FST值就比较大;棕黑锦蛇与赤峰锦蛇的大部分群体之间不存在分化,这可能与地理距离相对较小有关,另外样本量较少、采样点个体数目分布不均匀等因素可能是影响其遗传分化指数的原因。
基因流(Nm)表示两个地理种群之间每代平均交换的个体数目,与遗传分化指数相反,Nm值越大,表示地理种群间基因交流越多,遗传分化越少。从Nm值来看,当Nm<1时,表明种群间的基因交流受到一定程度的限制,遗传分化明显;Nm值在1~4之间,表示种群之间存在中等程度的基因交流,群体间遗传分化较小;当Nm>4时,表示种群间的基因交流更为充分,遗传分化非常小[39]。据此标准,棕黑锦蛇的MDJ与SY、XB种群间的Nm值均大于4,表示其间遗传分化非常小;DJH种群与其他5个种群间以及SY与XB种群间的Nm值均小于1,即其间遗传分化明显。赤峰锦蛇的SY与BX、FS、YK种群间,XY与BX、FS、YK种群间的Nm值均小于1,表示其间遗传分化明显。整体来看棕黑锦蛇与赤峰锦蛇各自只有少部分种群之间的基因交流受到一定程度的限制,说明只有少数的种群间存在明显的分化,与上述遗传分化指数所反映的结果一致。
基于线粒体Cytb基因序列构建的棕黑锦蛇与赤峰锦蛇的贝叶斯系统发育树显示,12个种群的41个个体整体分成2支,支持棕黑锦蛇与赤峰锦蛇是两个物种的结论。7个单倍型个体关系也形成2个族群,表明可能其发生关系与系统进化树相照应;个体之间的关系是完全二分的格局,单倍型个体之间的关系很近,不能按照地理分布各自聚类,而是相互混杂聚在一起。遗传距离(GD)大于0.01表明变异较大,反之则表明变异较小[33]。棕黑锦蛇与赤峰锦蛇12个种群间各自的遗传距离(GD)值偏低,均小于0.01,表明棕黑锦蛇与赤峰锦蛇不同地理群体之间的遗传变异比较小。另据AMOVA分析表明,棕黑锦蛇群体的分子变异主要来自于种群内(69.03%),而非种群间(30.97%);赤峰锦蛇群体的分子变异主要存在于种群内(62.88%),高于种群间(37.12%),且不同群体间的遗传距离与地理距离没有呈显著的相关性。尽管FST值检验和Nm分析表明棕黑锦蛇和赤峰锦蛇各自的少部分群体之间存在分化,但是GD值和AMOVA分析均表明各个群体之间的遗传变异较小,且变异来源于群体内;造成这一现象的原因可能是由于种群处于分化的早期,单倍型之间的关系较近,各群体之间分化主要由单倍型频率的差异引起;也可能与所采集样本分布不均匀有关;此外,所采集样本的地理分布相对狭窄和样本量偏少也可能会有一定的影响。
3.3 群体历史
在种群动态分析中,Tajima’s D和Fu’s Fs值是两种比较常用的通过中性检验研究种群在历史上是否发生过扩张的参数。当种群中性检验Tajima’s D值和Fu’s Fs值接近零时,表明种群处于稳定状态;出现负的D值、Fs值以及差异显著的P值(P<0.05)时,则认为种群在历史上有扩张迹象[40]。但相对而言,Fu’s Fs检验对种群扩张更加敏感,种群的扩张会使Fs得到更大的负值。此外,Tajima’s D检验更倾向于检测古老的突变和揭示古老种群发生扩张的历史,而Fu’s Fs检验则对近期种群扩张的检测更为敏感[41]。本研究中棕黑锦蛇与赤峰锦蛇的中性检验值表明,整体上棕黑锦蛇种群的Fu and Li’s D*值和Fu and Li’s F*值均为负数,未达到显著性水平,Tajima’s D、Fu’s Fs也均为负值,且未达到显著性水平;赤峰锦蛇种群整体的Fu and Li’s D*值和Fu and Li’s F*值均为负数,且Fu and Li’s F*值达到了显著性水平,但是Tajima’s D、Fu’s Fs也均为负值,且未达到显著性水平;同时,棕黑锦蛇与赤峰锦蛇的单个群体的Fu’s Fs也均未达到显著性水平。说明棕黑锦蛇与赤峰锦蛇整体上各群体近期积累的低频基因突变均不明显,所以认为棕黑锦蛇与赤峰锦蛇群体种群大小相对稳定,在短时间内均未经历过显著的区域扩张。
岐点分布分析是检测在历史进化过程中种群动态的有效方法,表示在不同的单倍型间碱基的变异相对频率的分析。如果是平衡的地理种群,岐点分布图呈钟形曲线、单峰图形,说明该种群曾经经历过种群扩张;若结果为“L”形曲线、双峰或者多峰图形,则说明种群处于平衡或稳定状态[42-43]。本研究中棕黑锦蛇与赤峰锦蛇的岐点分布图总体均呈现“L”形曲线,表明整体上棕黑锦蛇和赤峰锦蛇种群的大小相对稳定,均没有发生过明显的种群扩张,与Fu’s Fs值的检验结果一致。
4 结论
Cytb分析两种锦蛇种群的序列多态性较低,遗传多样性水平也较低,但棕黑锦蛇略高于赤峰锦蛇。棕黑锦蛇与赤峰锦蛇各自的少部分群体之间存在分化,种群大小相对稳定,均没有发生过明显的种群扩张。建议将两个物种分开进行管理,保护其遗传多样性。

