新剂型药物血浆中游离药物浓度研究方法概述
摘 要 新剂型药物改善了血浆中游离药物浓度比率,从而降低毒性提高药效,因而检测血浆中游离药物浓度具有重要意义。新剂型药物游离浓度测定和药物血浆蛋白结合率测定有一定差别,主要在于新剂型药物引入的新的外源性蛋白(或其他影响药物游离率的辅料),存在血浆中蛋白特异性差异大、蛋白浓度变化大和游离药物浓度较低三方面问题。因而一般血浆蛋白结合率试验的方法不一定都适用于新剂型药物游离浓度测定。本文就常见的游离药物浓度测定方法(超速离心法、超滤法、平衡透析法和快速平衡透析法)及其优缺点和适用范围做一个概要介绍,为新剂型药物的研发提供帮助。
关键词 游离药物浓度 超速离心 超滤 平衡透析
中图分类号:R969.1 文献标志码:A 文章编号:1006-1533(2019)07-0074-04
Summary of research methods for free concentration of new dosage forms drug in plasma
MA Zhiyu*
(Shanghai Pharmaceuticals Holding Co., Ltd., Shanghai 201203, China)
ABSTRACT New dosage forms such as albumin binding and micelles can improve the solubility and targeting of drugs, reduce the adverse drug reactions drugs and increase the dose tolerance. These are all achieved by improving the ratio of free drug concentration in plasma, so it is important to determinate the concentration of free drug in plasma. In this paper, the common methods such as ultracentrifugation, ultrafiltration, equilibrium dialysis and rapid equilibrium dialysis for the determination of free drug concentration and their advantages and disadvantages and the scope of application are briefly introduced so as to provide assistance for the development of new dosage forms.
KEY WORDS free drug concentration; ultracentrifugation; ultrafiltration; equilibrium dialysis
近年來,随着药物新剂型的不断发展创新,许多如紫杉醇一类的溶解度差的、毒性大的药物越来越多被制成了白蛋白结合型、胶束等新剂型。这些新剂型增加了药物的溶解性和靶向性,从而降低药物本身及其助溶剂带来的不良反应,提高给药耐受剂量从而增加疗效,并通过缓释延长药物半衰期以延长给药间隔,提高患者的用药依从性。而以上这些优势,都是因为新剂型改变了药物在血浆中游离比才实现的[1-3]。
众所周知,药物进入体循环发挥药效,需在体内溶解和吸收。药物吸收进入血液后,存在两种状态,一种是血浆蛋白结合型,一种是血浆蛋白未结合型(即游离型)。而药物在体内的组织分布方式,主要是由血浆中游离药物完成的。因此,研究游离药物浓度,对评价新剂型药物的药效和毒性都具有重要意义[4-6]。
虽然研究新剂型药物的游离药物浓度和研究药物血浆蛋白结合率有一定相似之处,但也有明显差别:①新剂型药物中往往含有外源性白蛋白之类助溶或靶向作用辅料,与人体内源性血浆蛋白会有一点差异;②新剂型药物在体内的血浆蛋白结合率往往随着给药后时间而变化,这是由于外源性白蛋白逐渐被降解,药物释放改变或药物周边蛋白浓度改变造成的;③游离药物浓度往往比较低,常常小于1 ng/ml。故许多适用于蛋白结合率测定的方法,诸如毛细管电泳、圆二色谱法等,由于蛋白特异性差异大、蛋白浓度变化大和游离药物浓度较低的问题,并不适用测定游离浓度[7-9]。
目前用于测定血浆中游离药物浓度的处理方法主要有以下四种:超速离心法、超滤法、平衡透析法和快速平衡透析法。本文将对这四种常见方法进行详细概述,为游离药物浓度的测定提供帮助,从而为新剂型药物的研究和毒性评价提供帮助。
1 超速离心法
即含药物的血浆样品放专用的离心管中,用超速离心机于100 000 g、37 ℃离心15 h。离心后取上清液测定。
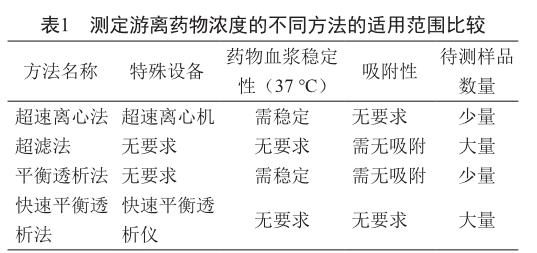
此方法优点为:①操作步骤简单,直接取样离心即可;②由于样品不经过任何膜,仅在离心管中,故不存在样品吸附问题。其缺点也较为明显:①由于样品需要在37 ℃下离心15 h,故血浆应在37 ℃、15 h内稳定;②需要借助昂贵的专用的超速离心机,且每次只能离心10~24个左右样品,每次离心需要15 h,对于拥有大量样品的药动学和等效性试验不适用;③由于新剂型中存在白蛋白之类非血浆内源性蛋白,离心后的血浆样品存在一个浓度梯度,即最下层为结合蛋白的药物,最上层为游离药物,而中间层则两种状态药物都存在。故在最终取样测定时,取样位置会显著影响测定结果。
此方法适用于血浆稳定性好、样品数量少、用其他方法会存在吸附药物的游离浓度测定。r(游离药物)=最上层游离药物浓度[10-11]。
2 超滤法
即在超滤膜样品侧加入含药物的血浆,用离心力之类外力使血浆部分通过超滤膜(于37 ℃离心),超滤膜有特定的分子质量截止值(如30 kDa),最终游离的药物进入超滤膜的另一侧,而蛋白结合型的药物则留在样品侧。
此方法的优点如下:①超滤膜装置相对于超速离心机易于获得,且价格相对便宜;②样品制备时间短,通常一次约20 min左右,适用于大量样品测试;③由于制备时间短,适合血浆稳定性较差的药物。其缺点如下:①不适用于吸附性药物,即药物若在超滤膜上吸附,则该方法不适用;②超滤膜使用前需活化,相对比较麻烦;③不同厂家和材料的超滤膜重现性相对较差。
此方法应用的前提是药物在超滤膜上不被吸附。若样品吸附性验证通过,且对药物血浆稳定性的要求较低,可用于大量样品的测试。r(游离药物)=滤过层的药物浓度[9-15]。
3 平衡透析法
即用平衡透析膜分开等体积的含药物血浆和缓冲液,由于平衡透析膜有特定的分子质量截止值(如30 kDa)。通过24 h(37 ℃)平衡孵化,蛋白结合型药物无法通过透析膜,而游离型药物侧分布到了缓冲液一侧。
此方法的优点如下:①平衡透析法为游离药物测定最基本的方法,因此测定结果最能体现游离药物浓度。②平衡装置相对经济便宜,平衡透析膜也比较常见。缺点如下:①孵化时间长,需24 h,不适合血浆稳定性差的药物;②因时间长,且每次孵化样品量少,故不适合大量样品的测试;③由于样品要接触透析膜,故不适合吸附性强的药物;④透析膜厂家和材质较多,不同透析膜对试验结果有影响;⑤透析膜使用前需活化。
此方法需化合物血浆稳定性好,样品在透析膜上不吸附,且只适用于少量样品。r(游离药物)=缓冲液层的药物浓度[7-11, 16-19]。
4 快速平衡透析仪法
即用快速平衡透析仪进行游离药物的测定。是平衡透析法的改进版,由于涡旋力存在和透析面积的扩大,平衡透析时间从24 h缩短至4 h。透析膜两侧,即血浆样品侧和缓冲液侧的试验加入体积不同,目的在于扣除药物吸附的问题。
此方法的优点如下:①此装置一次可以制备48个样品,且孵化時间仅为4 h,适用于大量样品测试;②该仪器两侧(血浆和缓冲液)体积不同,已排除吸附干扰,故适合吸附性强药物;③孵化时间相对短,且最终计算方式为测定两侧浓度,已扣除稳定性干扰,故适合血浆稳定性差的药物;④该透析膜已经批量生产,试验温度和CO2浓度固定,故其重现性较好;⑤该透析膜可同时测定已知结果的阳性药物作为对照,保证试验过程的可靠性。缺点如下:①快速平衡透析膜为消耗品,单个膜价格相对较高;②需要使用专门的孵化设备和快速平衡透析仪。
此方法适合大多数药物游离浓度测定,但需要专门的仪器设备。r(游离药物)=药物血浆总浓度×(缓冲液层的药物浓度/血浆层药物浓度×100%)[20-24]。
5 结语
目前常用的测定游离药物浓度的方法的优缺点如上所述,可根据不同药物的特点和试验条件进行选择。在进行选择之前,我们应了解是否有特殊设备、药物本身的血浆稳定性(37 ℃)、吸附性和待测样品的数量。每种方法的适用范围见表1。
游离药物浓度的检测对于新剂型药物的临床用药、药效评价、安全性监测等都有重要意义,而更准确实用的游离药物浓度测定方法也将对新剂型药物的研发提供重要依据。
致谢:对中科院上海药物研究所药物代谢研究中心的全体领导、同事和学生对此综述的完稿所提供的帮助表示衷心感谢!
参考文献
[1] Gardner ER, Dahut W, Figg WD. Quantitative determination of total and unbound paclitaxel in human plasma following abraxane treatment[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2008, 862(1-2): 213-218.
[2] Sun J, Dai WB, Liang Z, et al. Advances in the formulation and delivery technology of paclitaxel for injection [J]. J Chin Pharm Sci, 2015, 24(8): 487-500.
[3] 毋海兰, 马智宇, 张淑秋, 等. 紫杉醇不同剂型对大鼠血浆中游离药物浓度的影响[J]. 中国医药工业杂志, 2016, 47(11): 1430-1435.
[4] Trainor GL. The importance of plasma protein binding in drug discovery[J]. J Expert Opin Drug Discov, 2007, 2(1): 51-64.
[5] Howard ML, Hill JJ, Galluppi GR, et al. Plasma protein binding in drug discovery and development[J]. J Comb Chem High Throughput Screen, 2010, 13(2): 170-187.
[6] 陈冰, 蔡卫民. 游离药物浓度监测及其应用研究进展[J].中国临床药理学杂志, 2008, 24(3): 255-259.
[7] Nevídalová H, Michalcová L, Glatz Z. In-depth insight into the methods of plasma protein-drug interaction studies: Comparison of capillary electrophoresis-frontal analysis, isothermal titration calorimetry, circular dichroism and equilibrium dialysis[J]. J Electrophoresis, 2018, 39(4): 581-589.
[8] Nilsson LB. The bioanalytical challenge of determining unbound concentration and protein binding for drugs[J]. J Bioanalysis, 2013, 5(24): 3033-3050.
[9] Sebille B. Methods of drug protein binding determinations[J]. Fundam Clin Pharmacol, 1990, 4(Suppl 2): 151s-161s.
[10] Kurz H, Trunk H, Weitz B. Evaluation of methods to determine protein-binding of drugs. Equilibrium dialysis, ultrafiltration, ultracentrifugation, gel filtration[J]. J Arzneimittelforschung, 1977, 27(7): 1373-1380.
[11] Barré J, Chamouard JM, Houin G, et al. Equilibrium dialysis, ultrafiltration,and ultracentrifugation compared for determining the plasma-protein-binding characteristics of valproic acid[J]. J Clin Chem, 1985, 31(1): 60-64.
[12] Eisenried A, Wehrfritz A, Ihmsen H, et al. Determination of total and unbound propofol in patients during intensive care sedation by ultrafiltration and LC-MS/MS [J]. J Pharm Biomed Anal, 2016, 126: 148-155.
[13] Saari TI, Fechner J, Ihmsen H, et al. Determination of total and unbound sufentanil in human plasma by ultrafiltration and LC-MS/MS: application to clinical pharmacokinetic study[J]. J Pharm Biomed Anal, 2012, 66: 306-313.
[14] Mortier KA, Lambert WE. Determination of unbound docetaxel and paclitaxel in plasma by ultrafiltration and liquid chromatography-tandem mass spectrometry[J]. J Chromatogr A, 2006, 1108(2): 195-201.
[15] Du P, Han X, Li N, et al. Development and validation of an ultrafiltration-UPLC-MS/MS method for rapid quantification of unbound docetaxel in human plasma[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2014, 967: 28-35.
[16] Metsu D, Lanot T, Fraissinet F, et al. Determination of dolutegravirs unbound fraction in human plasma using validated equilibrium dialysis and LC-MS/MS methods[J]. J Clin Chim Acta, 2018, 479: 56-65.
[17] Ray JA, Kushnir MM, Rockwood AL, et al. Direct measurement of free estradiol in human serum and plasma by equilibrium dialysis-liquid chromatography-tandem mass spectrometry[J]. J Methods Mol Biol, 2016, 1378: 99-108.
[18] 李瑞光, 陳历俊, 姜铁民, 等. 应用平衡透析法分析药物小分子与蛋白质相互作用[J]. 生物技术通报, 2010(6): 80-84.
[19] 杨海艳, 王公轲, 陈得军, 等. 平衡透析法用于有机小分子和蛋白质相互作用研究进展[J]. 河南师范大学学报(自然科学版), 2008, 36(4): 93-97.
[20] Thermo Scientific, Instructions of Red Device Inserts[EB/ OL]. [2018-06-31]. https://www.thermofisher.com/order/ catalog/product/89810?SID=srch-srp-89810.
[21] Ye Z, Zetterberg C, Gao H. Automation of plasma protein binding assay using rapid equilibrium dialysis device and Tecan workstation[J]. J Pharm Biomed Anal, 2017, 140: 210-214.
[22] Waters NJ, Jones R, Williams G, et al. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding [J]. J Pharm Sci, 2008, 97(10): 4586-4595.
[23] Vanstraelen K, Wauters J, De Loor H, et al. Proteinbinding characteristics of voriconazole determined by highthroughput equilibrium dialysis [J]. J Pharm Sci, 2014, 103(8): 2565-2570.
[24] Garcia-Martínez S, Rico E, Casal E, et al. Bioanalytical validation study for the determination of unbound ambrisentan in human plasma using rapid equilibrium dialysis followed by ultra performance liquid chromatography coupled to mass spectrometry [J]. J Pharm Biomed Anal. harm Biomed Anal, 2018, 150: 427-435.

