液相色谱-串联质谱测定食醋中生物胺含量
魏泉增,汤 雅,李伟民
(1.许昌学院 食品与生物工程学院,河南 许昌 461000;2.河南省食品安全生物标识快检技术重点实验室,河南 许昌 461000)
食醋是我国重要的调味品,有两千多年的悠久历史。酿造的地理环境、原料与工艺的差异,生产出具有不同风味的食醋。酿造食醋的原料有大米、小麦、高粱、小米、麸皮、含糖分的果类等[1]。在微生物氨基酸脱羧酶作用下将氨基酸脱羧生成生物胺,通过氨基化和转胺作用也能使醛和酮转化为生物胺[2]。适量生物胺可促进人体的正常生理活动,但生物胺的浓度超过一定的限度会对人体产生严重的危害[3-4],损伤人体的神经系统和心血管系统。因此,建立快速简便地检测食醋中生物胺含量的方法,对保证食醋食用安全具有重要意义。
由于生物胺分子中缺少发色基团,无紫外吸收、也无荧光及电化学活性,因此,分离及测定各类生物胺的含量存在一定的困难。目前,检测生物胺的方法主要为衍生化-高效液相色谱(high performance liquid chromatography,HPLC)[5-7]法。也有用生物传感器法[8]、毛细管电泳法[9]、薄层色谱法[10]等测定食品中生物胺。唐晗等[11]利用化学发光传感器检测食品中生物胺含量。刘方震[12]利用毛细管电泳技术检测尿样、酱油等样品中的生物胺,分离速度快、效能高并且消耗样品量极少,但选择性差。李燕君[13]改良了传统的薄层色谱检测方法并成功定性、定量检测黄酒中生物胺的含量。黄祖新[14]采用高效液相色谱法检测了福建红曲醋中各生物胺含量。瞿凤梅等[15]采用丹磺酰氯衍生化结合HPLC的方法检测泡菜中的生物胺含量。HPLC方法是常用的检测方法,但需要进行柱前或柱后衍生,具有反应条件苛刻、衍生产物不稳定及前处理耗时较长等不足。本研究采用液相色谱-串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)法测定食醋中多种生物胺的含量,为食醋企业提供可靠数据,以期控制食醋生产过程中生物胺的产生,保证食醋的安全。
1 材料与方法
1.1 材料与试剂
食醋样品均购买于许昌市时代广场,样品1,老陈醋(山西);样品2,黑米醋(广东);样品3,老陈醋(山西);样品4,老陈醋(江苏);样品5,香醋(上海);样品6,老陈醋(山西);样品7,香醋(江苏);样品8,香醋(江苏)。
精胺、亚精胺、酪胺、组胺二盐酸盐、腐胺、尸胺、色胺:阿拉丁公司;甲酸、乙腈(均为色谱纯):美国西格玛公司。
1.2 仪器与设备
Agilent 6460型串联三重四极杆质谱仪、Agilent 1290型液相色谱仪:美国安捷伦公司;Mili-Q型超纯水仪:密理博公司;ME104T/02电子天平:梅特勒-托利多集团。
1.3 方法
1.3.1 生物胺标准系列溶液的配制
7种生物胺标准储备溶液制备:分别称取色胺3.4 mg、酪胺2.6mg、组胺二盐酸盐3.4mg、精胺5.1mg、亚精胺4.6mg、腐胺1.8 mg、尸胺1.7 mg于10 mL的容量瓶中,定容,配成340 mg/L(色胺)、260 mg/L(酪胺)、205 mg/L(组胺)、510 mg/L(精胺)、460 mg/L(亚精胺)、180 mg/L(腐胺)、170 mg/L(尸胺)标准储备溶液。使用超纯水将混合标准溶液按1∶2的稀释度稀释成系列浓度标准溶液。
1.3.2 样品的前处理
准确量取1mL各品牌的食醋样品,超纯水定容至10mL,0.45 μm滤膜过滤,直接进样分析。
1.3.3 色谱条件与质谱条件
色谱条件:Agilent XDB-C3(4.6 mm×250 mm,5 μm)色谱柱,柱温30℃,进样量5μL,流动相A为0.1%甲酸水溶液,流动相B为0.1%的甲酸乙腈溶液;0~5 min时,5%~20%的B溶液;流速为0.3mL/min。
质谱条件:电喷雾离子源(electrosprayionization,ESI),正离子扫描;干燥气为氮气(N2),干燥气温度为300℃,干燥气流量为8 L/min;雾化气压力为30 psi,鞘气温度为300℃,鞘气流量为11 L/min;毛细管电压为4000 V(正离子模式);锥孔电压为500V(正离子模式);检测方式为多反应监测模式(multiple reaction monitoring,MRM)。
取生物胺标准品,进行子离子优化。母离子为M+1,毛细管出口电压50~150 V,步长为5 V,碰撞能量5~50 V,步长为4 V,加速电压为4 V。
1.3.4 数据处理
定性分析:在相同的色谱和质谱条件下,对照7种生物胺标准品定性离子,以及出峰时间,对样品中各生物胺进行定性分析。
定量分析:通过不同生物胺定量离子的峰面积,根据7种生物胺标准曲线的回归方程,计算食醋样品中各生物胺的含量。
试验结果采用Minitable(17.0版)计算平均值与相关性分析[16]。
2 结果与分析
2.1 质谱条件的选择结果
生物胺是一类具有生物活性的小分子碱类化合物,极性较大,因此,实验中选用C3柱,以此实现7种生物胺的分离和检测。优化后的子离子见表1,加速电压为4V。其中,丰度最大为定量离子,丰度次大为定性离子。5min内7种生物胺全部岀峰(见图1)。生物胺色谱出峰顺序为亚精胺、腐胺、尸胺、组胺、精胺、酪胺、色胺,出峰时间分别为0.959min、0.996 min、1.004 min、1.012 min、1.098 min、1.892 min、4.064 min。

图17 种生物胺dMRM色谱图Fig.1 Chromatogram of dMRM for 7 kinds of biogenic amines
2.2 标准曲线回归方程、检出限和定量限
按照各标准品峰面积(y)对相应的标准溶液质量浓度(x)作标准曲线,得到标准曲线的回归方程及相关系数。以信噪比(S/N)=3作为检出限,信噪比(S/N)=10作为定量限,7种生物胺的最低检出限见表2。各生物胺线性回归方程在0.50~20 mg/L范围内,线性相关系数R2均≥0.990,符合测定的要求。结果表明,该方法对生物胺灵敏度高,可以满足样品测定的要求。

表2 生物胺标准曲线的回归方程、相关系数、线性范围及检出限Table 2 Regression equations of the standard curve,correlation coefficients,linearity range and limits of detection of biogenic amines
2.3 方法的回收率
方法的回收率试验结果见表3。从表3可看出,7种生物胺的相对标准偏差(relative standard deviation,RSD)在0.31%~3.29%,表明具有良好的重复性,7种生物胺的回收率也均在91.1%~102.17%。可见该方法回收率高,可用于检测食醋中生物胺的含量。

表3 生物胺的加标回收率结果Table 3 Results of recovery rate of biogenic amines
2.4 8种食醋样品中生物胺的测定
不同品牌食醋中的生物胺含量见表4。

表4 食醋中的生物胺含量Table 4 Contents of biogenic amines in vinegar samples mg/L
生物胺的种类和含量因食醋的品种和制作方法的不同而有所差别,由表4可知,本研究的每一个样品中至少含有4种生物胺,所有样品中均未检出色胺,表明在酸性条件不利于色胺的形成。少部分食醋样品中未检出组胺和酪胺。
食醋中不同生物胺的含量见图2。由图2可知,8种样品中亚精胺的平均含量高于其他生物胺的平均含量,除色胺外,组胺的平均含量最低。精胺、亚精胺、腐胺和尸胺是食醋中主要的生物胺,所有样品中都能检出上述4种生物胺,组胺、酪胺和色胺的检出率分别为75%、87.5%和0%。已知7种生物胺毒性最强的是组胺[17],而食醋中组胺的含量并不高,表明食醋的低pH抑制了组胺的形成。
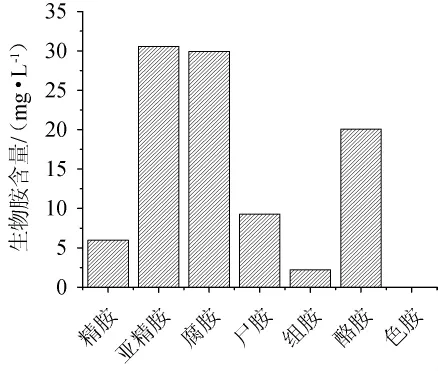
图2 食醋中不同生物胺含量Fig.2 Contents of different biogenic amines in vinegar samples
不同种类食醋样品中生物胺含量测定结果见图3。由图3可知,陈醋、米醋和香醋3类食醋样品中6种生物胺的含量有明显差别。香醋中6种生物胺含量均高于陈醋和米醋,陈醋次之,米醋各生物胺含量最低。3类食醋中总生物胺含量的变化也较大,其中陈醋中总生物胺含量为77.58 mg/L,米醋总生物胺含量为13.48 mg/L,香醋的总生物胺含量为150.87 mg/L,这可能是与3类食醋的生产工艺和微生物种类不同有关。

图3 不同种类食醋样品中生物胺含量Fig.3 Contents of biogenic amines in different kinds of vinegar samples
2.5 样品中生物胺含量的相关性分析
为寻找生物胺相互之间的关系,采用Minitable软件对食醋中不同种类生物胺含量之间的相关性进行分析,结果见表5。由表5可知,组胺除了与酪胺显著相关外(P<0.01),与其他5种生物胺之间均没有显著相关性(P>0.01);腐胺与尸胺之间具有显著相关性(P<0.01),与其他5种生物胺也均没有显著相关性(P>0.01)。其他生物胺之间没有显著的相关性(P>0.01)。原因可能是不同酿造工艺中产生的游离氨基酸含量不同,各底物浓度之间没有相关性;产脱羧酶具有多种底物[18-19],如一些乳杆菌(Lactobacilli)发酵可生成组胺、酪胺,这就造成了酪胺和组胺具有一定的相关性,而肠杆菌科(Enterobacteriaceae)微生物则有同时生成腐胺和尸胺的能力[20]。一些外界因素也会影响组胺的形成,此外,温度也会影响生成生物胺各个不同的组分,如合成组氨酸脱羧酶的最适温度为30℃,产生组胺的嗜温细菌生存所需要的温度须高于14℃,低温冷藏不利于组胺的形成。

表5 生物胺各组分之间的相关性Table 5 Correlation between components of the biogenic amines mg/L
3 结论
采用液相色谱-串联质谱(LC-MS/MS)测定8种食醋品牌中7种生物胺含量,所有样品中均检出精胺、亚精胺、腐胺和尸胺,酪胺和组胺存在于大多数食醋中,部分样品中未检出,此外,食醋样品中均未检出色胺。结果表明,食醋中所含生物胺的种类及含量因食醋的品种而异,除色胺外,其他6种生物胺总量的范围为47.88~244.58mg/L,亚精胺,腐胺和酪胺的含量较高。组胺与酪胺,腐胺与尸胺含量具有显著的相关性。

