板栗过氧化氢酶基因CmCAT的克隆与原核表达
刘裕峰,朱天辉,刘应高,谯天敏,李姝江,龙旭梅,韩 珊
(四川农业大学林学院,成都 611130)
首次发现动植物组织能够分解过氧化氢产生氧气可追溯到1811年,后被发现可能是某种酶起作用,直到1901年,该酶被命名为过氧化氢酶(hudrogen peroxidase),又名触酶(catalase,CAT)[1]。现已发现在动物、植物及微生物体内均含有大量的CAT。病原菌的入侵会打破超氧阴离子(O2-)、过氧化氢(H2O2)和羟自由基(·OH)等活性氧类(reactive oxygen species,ROS)物质的动态平衡,导致活性氧物质在植物体内大量积累,长时间的积累而得不到有效的清除,会损伤植物细胞膜系统,破坏蛋白质功能,严重时导致植株死亡[2]。CAT 作为植物体内主要的抗氧化酶之一,它能够催化植物光呼吸、线粒体电子传递及脂肪酸氧化等过程中产生的H2O2生成O2和H2O[3]。有报道称[4],一分子CAT 每分钟能将大约6×106个H2O2分子转化成H2O 和O2。因此,CAT 对H2O2的清除具有较高的特异性,并且在去除H2O2过量中起关键作用[5],使得植物不受伤害。
大量研究表明,CAT 与植物的抗病性存在着紧密的联系。Pei Z.M.等[6]研究发现,缺失CAT 基因的烟草体内H2O2含量增加,导致细胞死亡;Jiang M.等[7]发现,植物的CAT 活性能够被水杨酸抗病因子抑制,导致过多的ROS 产生,进而引起植物系统性的防御反应;病原菌浸染植物的初期阶段,CAT 催化H2O2生成O2,触发苯甲酸生成水杨酸,导致系统性防卫反应的发生[8];转玉米CAT2 基因的烟草遭受病原菌侵染后,诱发严重的超敏反应,进而有效地控制细菌的进一步感染[9];转基因烟草植株体内酵母CAT1 基因的过量表达,能够提高转基因植株的抗病毒侵染能力[10]。
植物CAT 基因家族由多个基因编码,其表达受病原、温度、光照、干旱等多种因子的调控[11]。目前,已从火龙果[12]、人参[13]、甘薯[14]、南瓜[15]、水稻[16]、坛紫菜[17]等多种植物中克隆获得CAT 基因并进行相关分析。但目前关于板栗CAT 基因的相关研究较少,异源表达方面的研究尚属空白。本研究在板栗转录组学研究[18]的基础上,利用RT-PCR 技术克隆获得板栗CAT 基因全长cDNA 序列,并进行了相关生物信息学分析,同时构建pET28a-CmCAT 原核表达载体,在大肠杆菌中进行了融合表达,旨在了解其基因结构和功能,为进一步研究板栗抗病的分子机理奠定基础。
1 材料和方法
1.1 试验材料
供试板栗品种为“石丰”,种植于四川农业大学林学院崇州基地;植物RNA 提取试剂盒购自北京华越洋生物科技有限公司;PCR 反转录试剂盒、pMD19-T 载体购自大连TaKaRa 公司;DNA 纯化回收试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司;表达载体pET-28a 由四川农业大学林学院林木病理学实验室提供;大肠杆菌DH5α、BL21(DE3)购自北京全式金生物技术有限公司;限制性内切酶EcoRI、XhoI、T4DNA 连接酶购自NEB(北京)有限公司;其他试剂为进口或国产分析纯。
1.2 总RNA 的提取与cDNA 的合成
以板栗幼叶作为RNA 提取材料,使用植物多糖多酚RNA 提取试剂盒(北京华越洋生物)提取总RNA。提取的总RNA 经BioMate 3S(BioMate 3S,Thermo Scientific)及1%的琼脂糖凝胶电泳检测其浓度和完整性。cDNA 第一链的合成使用PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit 试剂盒(TaKaRa,大连),具体操作步骤参照说明书进行。合成的cDNA保存于-80 ℃,用于后续试验。
1.3 CmCAT 基因的克隆
根据NCBI 数据库中已公布的其他植物CAT基因核苷酸序列,将其与板栗基因组数据库(http://www.hardwoodgenomics.org/)进行同源比对,寻找并分析板栗CAT 基因EST 序列,使用Primer Premier 5.0 软件设计一对特异性引物CmCAT-F:5'-ATG GATCCCTACAAGTACCG-3',CmCAT-R:5'- TCA CATTGTTGGCCTCAC-3'。以反转录的板栗cDNA为模板,进行PCR 扩增,反应条件为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸2 min,35 个循环;72 ℃终延伸7 min。PCR 产物经1%琼脂糖凝胶电泳检测后进行纯化回收,回收片段连接pMD19-T 载体并转化E.coli DH5α,于氨苄青霉素(ampicillin,Amp)培养基上进行蓝白斑筛选,挑取白色单克隆菌落进行PCR 鉴定,将菌落PCR 检测的阳性克隆送上海英骏生物技术有限公司测序鉴定。
1.4 CmCAT 基因序列的生物信息学分析
通过软件DNAMAN6.0 查找序列的ORF,并将其翻译为氨基酸序列;通过在线NCBI(http://blast.ncbi.nlm.nih.gov/)的Blast 进行核苷酸序列和氨基酸序列相似性分析;应用ClustalX1.81 和ESPript3.0软件对其编码蛋白进行多重对比分析;运用在线蛋白分析工具ProtParam(http://web.expasy.org/protparam/)和ProtScale(http://web.expasy.org/protscale/)对其编码蛋白的理化性质进行预测分析;利用工具ScanProsite(http://prosite.expasy.org/scanprosite)对其编码蛋白的功能位点及功能域进行预测分析;利用软件MEGA6.05 进行系统进化树分析。
1.5 原核表达载体的构建及鉴定
根据前期克隆获得的CmCAT 基因CDS 序列,设计一对含酶切位点的引物CmCAT-EcoRI-F:5'-CGGAATTCATGGATCCCTACAAGTACCG-3'(下划线为EcoRI 酶切位点),CmCAT-XhoI-R:5'-CCGC TCGAGTCACATTGTTGGCCTCAC-3'(下划线为XhoI酶切位点)。以pMD19-T-CmCAT 质粒为模板,进行PCR 扩增,扩增条件同1.3。PCR 产物经1%琼脂糖凝胶电泳检测后,进行纯化回收。回收产物与pET-28a 载体质粒均进行EcoRI 和XhoI 双酶切,酶切产物纯化回收后,使用T4 DNA 连接酶16 ℃连接12 h。连接产物转入大肠杆菌BL21(DE3),于卡那霉素(kanamycin,Kan)培养基上进行抗性筛选,挑取单个菌落于LB 液体培养基扩增培养后进行PCR鉴定,提取鉴定正确的菌液质粒,对质粒进行EcoRI和XhoI 双酶切鉴定后送上海英骏生物技术有限公司测序鉴定。
1.6 重组质粒的诱导表达及SDS-PAGE 检测
将测序正确的重组质粒转化表达宿主菌BL21(DE3)。挑取含有pET28a-CmCAT 重组质粒的BL21(DE3)单菌落,接种于含有Kan(50 μg/mL)LB液体培养基中,37 ℃(200 r/min)过夜振荡培养。次日按1∶100 的接种量进行扩增培养,当菌液OD600值约为0.6~0.8 时,分别进行不同条件的诱导。首先利用不同浓度IPTG(终浓度为0.2、0.4、0.6、0.8、1.0 mmol/L)诱导3 h,收取1 mL 菌液进行SDS-PAGE检测;以上述最优IPTG 浓度进行诱导时间(1、2、3、4、5、6 h)的优化。
最后以最优IPTG 浓度和最优诱导时间进行不同温度(25 ℃、30 ℃、37 ℃)的诱导优化并进行诱导蛋白的可溶性分析。收集1 mL 菌液于1.5 mL 离心管中,12 000 r/min 离心10 min,取沉淀,加入100 μL PBS(pH7.4)悬浮菌体,12 000 r/min 离心1 min,收集菌体,再次加入60 μL PBS(pH 值7.4)悬浮菌体后,4 ℃超生破碎,12 000 r/min 离心10 min。收集超声破碎后的上清液和沉淀(加入60 μL 8 mol/L尿素重悬,4 ℃螯合30 min)。分别加入4×蛋白上样缓冲液20 μL 混匀,煮沸10 min,冰上冷却后,12 000 r/min 离心10 min,取10 μL 上清进行SDSPAGE(5%浓缩胶,12%分离胶)电泳检测。所有的SDS-PAGE 电泳检测均以pET28a-BL21(DE3)以及未诱导的pET28a-CmCAT-BL21(DE3)作为对照。
2 结果与分析
2.1 板栗CmCAT 基因全长cDNA 的扩增与克隆
使用CmCAT-F 和CmCAT-R 特异性引物,对CmCAT 基因完整阅读框(ORF)进行RT-PCR 扩增,扩增产物经1%琼脂糖凝胶电泳检测,发现一条约为1 500 bp 的单一条带,通过pMD19-T 克隆测序,发现获得了长度为1 479 bp 的CmCAT 基因片段(见图1)。

图1 CmCAT 基因PCR 扩增电泳图Figure 1 The electrophoresis of PCR product of CmCAT gene
2.2 板栗CmCAT 基因的核苷酸序列分析
板栗CmCAT 基因全长cDNA 序列为1 479 bp,通过ORF Finder 在线软件进行分析,发现该序列为一个完整的阅读框,无5'非编码区和3'非编码区,编码492 个氨基酸(见图2),将该基因cDNA 序列提交NCBI 数据库,注册登录号:KY312851。CmCAT基因核苷酸序列在GenBank 中进行序列相似性对比,结果显示该序列与核桃(Juglans regia,XM_01 8980866.1)CAT 基因序列一致性最高,为85%,与毛果杨(Populus trichocarpa,XM_002301884.1)、茶(Camellia sinensis、KR819178.1)、萝卜(Raphanus sativus,AF031318.2)等多种植物CAT 基因序列一致性均在77%以上。表明克隆获得的CmCAT 基因属于板栗过氧化氢酶基因家族成员之一。
2.3 板栗CmCAT 蛋白的氨基酸序列分析

图2 CmCAT 基因cDNA 序列及其所推导的氨基酸序列Figure 2 cDNA sequence of CmCAT gene and its deduced amino acid sequence
利用ExPASy ProtParam tool 对CmCAT 蛋白质序列进行相关信息分析,预测CmCAT 蛋白分子质量为56.883 kDa;理论pI 为5.83;在组成CmCAT 蛋白的所有氨基酸中,精氨酸(Arg)为使用频率最高的氨基酸,占总氨基酸量的8.1%,半胱氨酸(Cys)为使用频率最低的氨基酸,占总氨基酸量的1.0%;其含有61个负电性氨基酸残基(Asp + Glu),59 个正电性氨基酸残基(Arg + Lys),分子式为C2550H3865N719O736S16;预测不稳定指数为36.20,属于稳定性蛋白;脂肪族氨基酸指数69.15;总平均疏水指数-0.586,属于亲水性蛋白。使用ClustalX1.81 与ESPript3.0 软件并结合BlastP 对CmCAT 蛋白序列进行多序列相似性分析,结果显示(见图3),CmCAT 蛋白序列与蔓花生(Arachis duranensis,XP_015934030.1)等多种植物CAT 蛋白序列同源性达到82%以上。通过Blastp 和ScanProsite 工具对CmCAT 蛋白功能域进行分析,均发现其含有catalase 保守结构域,位于序列第14-492 位氨基酸之间。可见,CmCAT 属于CAT 蛋白家族成员之一。通过在线工具Motif 发现,CmCAT 蛋白还具有2 个重要的功能位点,分别是过氧化氢酶近端活性位点(catalase proximal active site signature),位于第54-70 位氨基酸之间,序列为FERERIPERVVHARGAS;过氧化物酶近血红素位点(catalase proximal heme-ligand signature),位于第344-352 位氨基酸之间,序列为RIFAYGDTQ(见图2)。进一步说明CAT 蛋白在进化过程中是较为保守的,CmCAT 蛋白与其他植物的CAT 蛋白结构和功能是较为相似的。
2.4 板栗CmCAT 蛋白的进化分析
为了解不同植物CAT 间的进化关系,从NCBI数据库下载了23 个物种CAT 氨基酸序列,利用MEGA6.05 软件,采用邻接法,重复检测1 000 次,构建其与CmCAT 氨基酸序列之间的进化关系(见图4)。系统进化树分析结果表明,24 个物种CAT 聚集为两大类群,草本植物CAT 聚为一簇,木本植物CAT 聚为一簇,符合植物的生物进化规律。板栗CmCAT 与核桃JrCAT 同为一个分支,亲缘关系最近,推测它们可能由同一个祖先进化而来。其次,与蔷薇科(Rosaceae)植物亲缘关系较近,而板栗CmCAT 与葫芦科(Cucurbitaceae)甜瓜、黄瓜、丝瓜等植物亲缘关系较远。

图3 CmCAT 与其他植物CAT 蛋白质序列多重对比Figure 3 Sequence multialignment of the deduced CmCAT protein with other plant CAT proteins

图4 Neighbor-joining(NJ)方法构建CmCAT 蛋白与其他植物CAT 蛋白的系统进化树Figure 4 Neighbor-joining (NJ) method to build CmCAT protein and other plant CAT protein phylogenetic tree
2.5 重组表达载体的构建
以pMD19-T-CmCAT 质粒为模板,使用CmCAT-EcoRI-F/CmCAT-XhoI-R 引物扩增获得带酶切位点的CmCAT 基因片段,将PCR 产物纯化回收后与pET-28a 载体分别进行EcoRI/XhoI 双酶切,分别回收目的片段与载体酶切产物并进行连接转化,挑取单菌落进行PCR 鉴定(见图5),条带与预期大小一致;提取PCR 鉴定正确的阳性菌液质粒,进行双酶切验证(见图6),获得预期大小的酶切片段。将验证正确的阳性重组质粒送上海英骏生物技术有限公司测序鉴定,测序结果比对发现,CmCAT 基因片段与pET-28a 载体成功连接,表明pET28a-CmCAT 重组表达载体构建成功。
2.6 板栗CmCAT 蛋白的原核表达
挑取pET28a-CmCAT-BL21(DE3)单菌落过夜培养作为母液。在37 ℃下进行不同IPTG 浓度诱导表达6 h,以未诱导的pET28a-CmCAT-BL21(DE3)、pET28a-BL21(DE3)以及诱导的pET28a-BL21(DE3)(IPTG 终浓度为0.6 mmol/L,诱导3 h)空载体作为对照。结果表明,对照组无目的蛋白表达,实验组在各IPTG 浓度下均能诱导大量表达,组间表达量并无多大差异,分子量约为60 kDa,与预期大小一致(见图7)。因此,以终浓度0.2 mmol/L 作为IPTG 最优诱导浓度。

图5 pET28a-CmCAT-DH5α PCR 检测Figure 5 PCR detection of pET28a-CmCAT-DH5α

图6 pET28a-CmCAT 双酶切鉴定Figure 6 Double enzyme identification of pET28a-CmCAT
使用上述最优表达条件(37 ℃、0.2 mmol/L IPTG),对pET28a-CmCAT-BL21(DE3)最优表达时间进行进一步优化。将OD600 值为0.6~0.8 区间的pET28a-CmCAT-BL21(DE3)菌液在37 ℃、0.2 mmol/L IPTG 下进行不同时间的诱导(分别为诱导1、2、3、4、5、6 h)。从图8中可以看出,随着诱导时间的增加,目的蛋白的量也在逐渐增加,诱导6 h 获得的目的蛋白量最大。而对照中载体与pET28a-CmCATBL21(DE3)未诱导均未有目的蛋白出现。因此,以诱导6 h 作为pET28a-CmCAT-BL21(DE3)在37 ℃、0.2 mmol/L IPTG 下最优诱导时间长度。
最后对pET28a-CmCAT-BL21(DE3)进行不同温度(25 ℃、30 ℃、37 ℃)诱导,同时检测表达的目的蛋白的可溶性。SDS-PAGE 蛋白电泳分析显示,3个温度下均有大量目的蛋白出现,且对照无此条带(见图9),在30 ℃下诱导获得的目的蛋白最为丰富。在上清中无明显目的蛋白出现,其主要以包涵体的形式存在。

图7 pET28a-CmCAT-BL21(DE3)诱导浓度优化Figure 7 Concentration optimization of pET28a-CmCATBL21(DE3) IPTG induction

图8 pET28a-CmCAT-BL21(DE3)诱导时间优化Figure 8 Induction time optimization of pET28a-CmCATBL21(DE3)
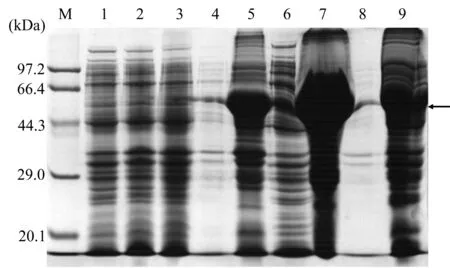
图9 pET28a-CmCAT-BL21(DE3)诱导温度优化及可溶性检测Figure 9 Optimization of the induction temperature of pET28a-CmCAT-BL21(DE3)and its solubility detection
3 讨论与结论
植物中复合抗氧化防御体系主要由抗氧化酶组成。其中,CAT 是第一个被发现和描述的[12]。植物遭受病原微生物侵染后会产生大量的H2O2[19],而H2O2的积累会对植物组织、细胞产生巨大的伤害。CAT 对H2O2具有较高的亲和性[20],能有效清除过多的H2O2,在防御逆境胁迫和维持植物细胞氧化还原平衡方面具有重要的意义[21]。通过RT-PCR 方法,成功克隆出板栗CmCAT 基因,该基因全长1 479 bp,为一个完整的ORF,编码492 个氨基酸。Blast 分析表明,CmCAT 基因核苷酸序列及氨基酸序列与其他植物的CAT 基因核苷酸序列及氨基酸序列同源性分别在77%和82%以上,显示其较高的保守性。Motif Scan 分析显示,CmCAT 蛋白序列具有CAT 蛋白家族的catalase 结构域,同时还具有该蛋白家族2个保守的功能位点:过氧化氢酶近端活性位点和过氧化物酶近血红素位点。分析板栗CmCAT 蛋白序列与其他23 个物种CAT 蛋白序列之间的进化关系,发现草本植物和木本植物分为两个大的分支,其中板栗与核桃的亲缘关系最近,与葫芦科草本植物亲缘关系最远。
利用基因工程技术成功获得pET28a-CmCAT重组载体,并转入大肠杆菌BL21(DE3)中,IPTG 诱导后获得分子量约为60 kDa 的目的条带,比预测的CmCAT 蛋白分子量(56.883 kDa)略大,pET28a 载体自带的His-tag 标签序列是造成这种偏差的主要原因之一[22],同时,诱导获得的目的蛋白与大豆GmCAT 基因在大肠杆菌中表达的融合蛋白分子量大小(60 kDa)一致[23]。随后从IPTG 浓度、诱导时间及诱导温度方面进行最优诱导条件的筛选,以期获得更大量的目的蛋白。通过SDS-PAGE 电泳分析发现,30 ℃,0.2 mmol/L IPTG 诱导表达菌株6 h 获得的目的蛋白量最大,但主要以包涵体的形式存在,且在诱导温度降低的条件下(25℃)仍为包涵体。大肠杆菌已经成功地用于表达来自细菌和低等真核生物的活性重组CAT[24]。然而,利用大肠杆菌系统尚未得到可溶性植物CAT 重组蛋白[25]。陈金峰等[23]将大豆3 个CAT 基因连接pET28a 载体后,转入大肠杆菌进行融合表达,获得的融合蛋白也均为包涵体。彭丹等[26]发现,盐穗木CAT 基因在BL21(DE3)中,通过低温诱导能获得可溶性的目的蛋白,但表达量较低。其所用的表达载体为pET32a,可能对植物CAT 基因在大肠杆菌中的可溶性表达具有一定的促进作用。N.Engel 等[25]发现,昆虫细胞系能够作为获得植物来源的活性重组CAT 的替代方法。作为真核生物,昆虫细胞系在遗传上更相容,可以提供足够的蛋白质折叠机器(分子伴侣)的支持,以及足够的血红素代谢池,并入新合成的重组血红素蛋白。
本研究成功从板栗中克隆了一个CAT 基因,通过多种生物信息学软件分析了CmCAT 基因的同源性、蛋白结构以及分子进化等相关信息,初步分析了CmCAT 基因在不同条件下的原核表达情况,为深入研究CmCAT 基因的功能和揭示板栗抗病过程中的分子机制奠定了基础。

