ERK/CT-1通路对氧化应激致H9C2细胞凋亡的影响
杜娜,戴红良,贾桂枝
(1.锦州医科大学附属第一医院 心血管内科二病区,辽宁 锦州 121001;2.锦州医科大学 护理学院,辽宁 锦州 121001;3.锦州医科大学 生理学教研室,辽宁 锦州 121001)
心肌营养因子-1(cardiotrophin-1,CT-1)属白细胞介素6 家族成员,最初从小鼠心脏胚胎干细胞中发现,在体外具有促进心肌细胞肥厚的生物活性[1]。研究显示心肌细胞在缺氧条件可诱导CT-1的过表达[2]。但目前对于CT-1 的功能及其表达上调的病理生理机制尚不明确。鉴于氧化应激在各种心血管疾病中所起的重要作用,本研究拟探讨在氧化应激情况下心肌细胞CT-1 的表达情况及其对心肌细胞凋亡的影响,以及氧化应激诱导CT-1 表达的机制。
1 材料与方法
1.1 主要试剂与仪器
H9C2 心肌细胞(中国科学院上海细胞库),胰蛋白酶、DMEM 培养基、过氧化氢、PD98059(美国Sigma 公司),胎牛血清(fetal bovine serum,FBS)(美国 Gibco 公司),CT-1 抗体(美国Abcam 公司),Cleaved-Caspase-3、ERK、pERK 抗 体(美 国Cell Signaling 公 司),Annexin V-PI 凋亡试剂盒(北京宝赛生物有 限公司),CT-1 siRNA 干扰序列5'-CCAAUUGCUGGAGG AAUAUTT-3'(苏州吉玛基因股份有限公司)。二氧化碳培养箱、酶标仪(美国Thermo Fisher Scientific 公司),倒置荧光显微镜(德国LEICA),流式细胞仪(美国BD公司),电泳仪及转膜仪(美国Bio-Rad 公司)。
1.2 检测方法与指标
1.2.1 Western blotting 检测 根据研究目的,将细胞分为不同组别:为检测过氧化氢对H9C2 细胞CT-1表达及ERK 活化的影响,将细胞分为对照组及不同浓度(50、100、200 μmol/L)过氧化氢组;为检测抗氧化剂对H9C2 细胞CT-1 表达及Caspase-3 活化的影响,将细胞分为对照组、200 μmol/L 过氧化氢组、N- 乙酰半胱氨酸组、N-乙酰半胱氨酸+过氧化氢组;为检测CT-1 对过氧化氢诱导Caspase-3 活化的影响,将细胞分为对照组、200 μmol/L 过氧化氢组、CT-1 siRNA+过氧化氢组;为检测ERK 活化对CT-1 表达的影响,将细胞分为对照组、200 μmol/L 过氧化氢组、PD98059 组、PD98059+过氧化氢组。用细胞裂解液收集刺激完成细胞的总蛋白,离心收集上清后测定蛋白浓度,总蛋白行10%~12% SDS-聚丙烯酰胺凝胶电泳。待电泳完成后电转移至聚偏氟乙烯(PVDF)膜。用1% BSA 封闭1 h,接着加入待检测蛋白的一抗4℃孵育过夜。TBST 充分洗膜后,以辣根过氧化物酶(HRP)标记的二抗室温孵育2 h。TBST 洗膜后,增强化学发光法(enhanced chemiluminescence,ECL)显色,以GAPDH 做为内参。
1.2.2 RNA 干扰 H9C2 细胞于转染前一天以无血清培养基培养24 h。预先将小干扰RNA(siRNA)与Opti-MEMI 按1 ∶16 混合;阳离子脂质体与Opti-MEMI 按照4 ∶11 混合。最后将上述2 个混合体系合并后与4 倍量的DMEM 一起加入到细胞中,在二氧化碳培养箱中继续培养8 h。最后,调整培养体系血清浓度为10%后继续培养72 h,用于后续研究。
1.2.3 流式细胞术检测凋亡细胞 为检测活性氧类(reactive oxygen species,ROS)及CT-1 对 过 氧 化氢诱导H9C2 细胞凋亡的影响,将细胞分为对照组、200 μmol/L 过氧化氢组、N-乙酰半胱氨酸+过氧化氢组及CT-1 siRNA+过氧化氢组。过氧化氢刺激24 h 后,各组细胞用0.25%胰酶消化2 ~3 min 后,以1 000 r/min 离心5 min 收集细胞,用预冷PBS 洗2 次,加入Annexin V-FITC 和碘化丙啶各5 μl,避光室温反应15 min,于1 h 内利用流式细胞仪检测细胞凋亡 情况。
1.3 统计学方法
数据分析采用SPSS 17.0 统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两两比较用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 过氧化氢对H9C2 细胞CT-1 表达的影响
与对照组比较,不同浓度过氧化氢刺激H9C2 细胞24 h 后,Western blotting 检测结果显示CT-1 的表达随着过氧化氢浓度的增加而增加(见表1和图1),说明氧化应激刺激可增加H9C2 细胞CT-1 的表达。
表1 各组H9C2 细胞CT-1 表达水平比较 (±s)
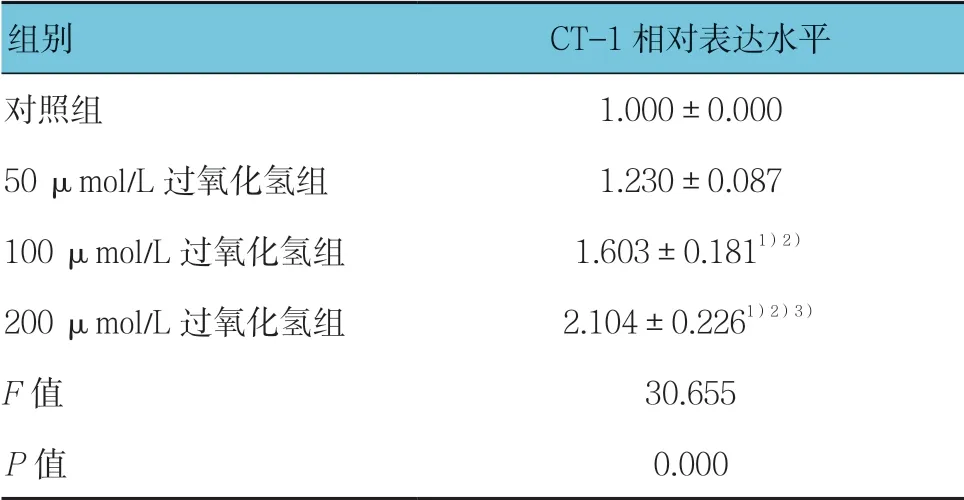
表1 各组H9C2 细胞CT-1 表达水平比较 (±s)
注:1)与对照组比较,P <0.05;2)与50 μmol/L 过氧化氢组比较,P <0.05;3)与100 μmol/L 过氧化氢组比较,P <0.05
组别 CT-1 相对表达水平对照组 1.000±0.000 50 μmol/L 过氧化氢组 1.230±0.087 100 μmol/L 过氧化氢组 1.603±0.1811)2)200 μmol/L 过氧化氢组 2.104±0.2261)2)3)F 值 30.655 P 值 0.000
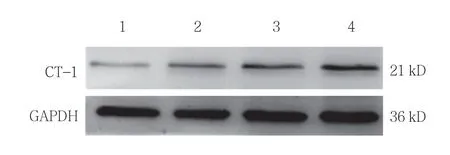
图1 各组H9C2 细胞CT-1 的表达
2.2 N-乙酰半胱氨酸对H9C2 细胞CT-1 表达的影响
经200 μmol/L 过氧化氢刺激后,H9C2 细胞CT-1的表达明显增强,而抗氧化剂N-乙酰半胱氨酸预处理可显著抑制过氧化氢诱导的CT-1 的表达(见表2和图2),表明过氧化氢诱导CT-1 的过表达是通过ROS 介导的。
表2 各组N-乙酰半胱氨酸对过氧化氢诱导的 CT-1 表达影响 (n =3,±s)
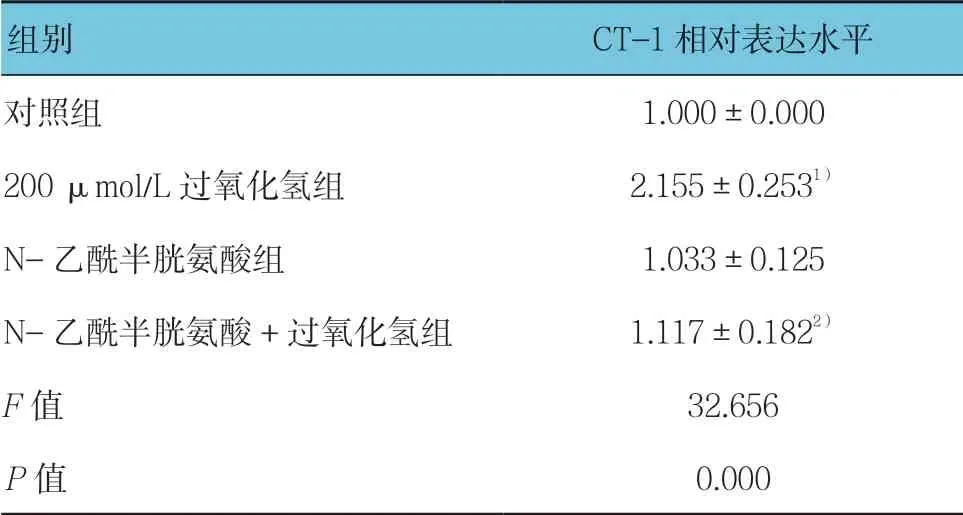
表2 各组N-乙酰半胱氨酸对过氧化氢诱导的 CT-1 表达影响 (n =3,±s)
注:1)与对照组比较,P <0.05;2)与200 μmol/L 过氧化氢组比较,P <0.05
组别 CT-1 相对表达水平对照组 1.000±0.000 200 μmol/L 过氧化氢组 2.155±0.2531)N-乙酰半胱氨酸组 1.033±0.125 N-乙酰半胱氨酸+过氧化氢组 1.117±0.1822)F 值 32.656 P 值 0.000
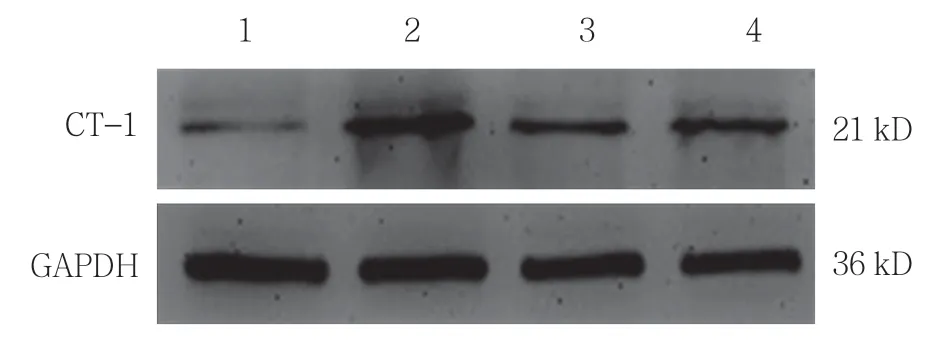
图2 N-乙酰半胱氨酸抑制过氧化氢诱导CT-1 的表达
2.3 N-乙酰半胱氨酸及CT-1 干扰对H9C2 细胞凋亡的影响
经200 μmol/L 过氧化氢刺激后,流式细胞仪检测显示H9C2 细胞的凋亡明显增加,而N-乙酰半胱氨酸预处理则明显抑制过氧化氢引起的细胞凋亡;相反,CT-1 敲低后H9C2 细胞的凋亡更加严重。见表3和图3。
表3 N-乙酰半胱氨酸及CT-1 siRNA 对过氧化氢诱导 H9C2 细胞凋亡的影响 (±s)
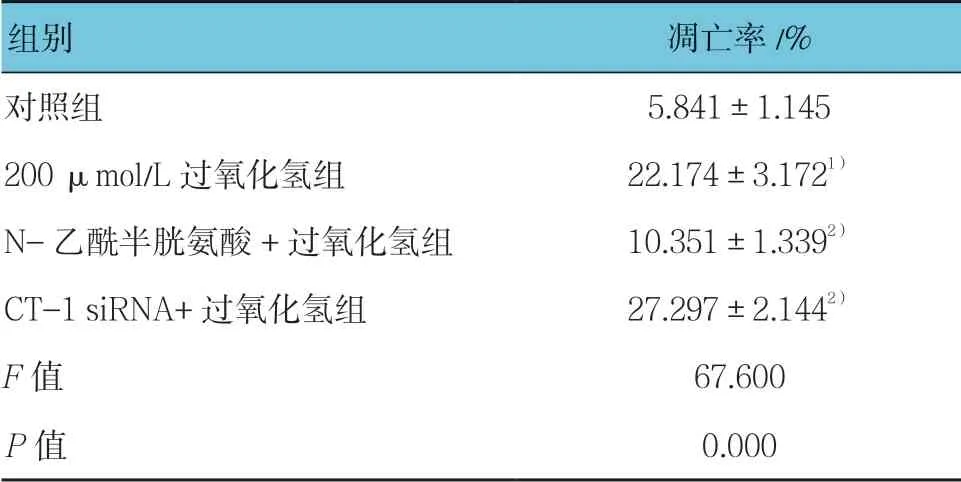
表3 N-乙酰半胱氨酸及CT-1 siRNA 对过氧化氢诱导 H9C2 细胞凋亡的影响 (±s)
注:1)与对照组比较,P <0.05;2)与200 μmol/L 过氧化氢组 比较,P <0.05
组别 凋亡率/%对照组 5.841±1.145 200 μmol/L 过氧化氢组 22.174±3.1721)N-乙酰半胱氨酸+过氧化氢组 10.351±1.3392)CT-1 siRNA+过氧化氢组 27.297±2.1442)F 值 67.600 P 值 0.000
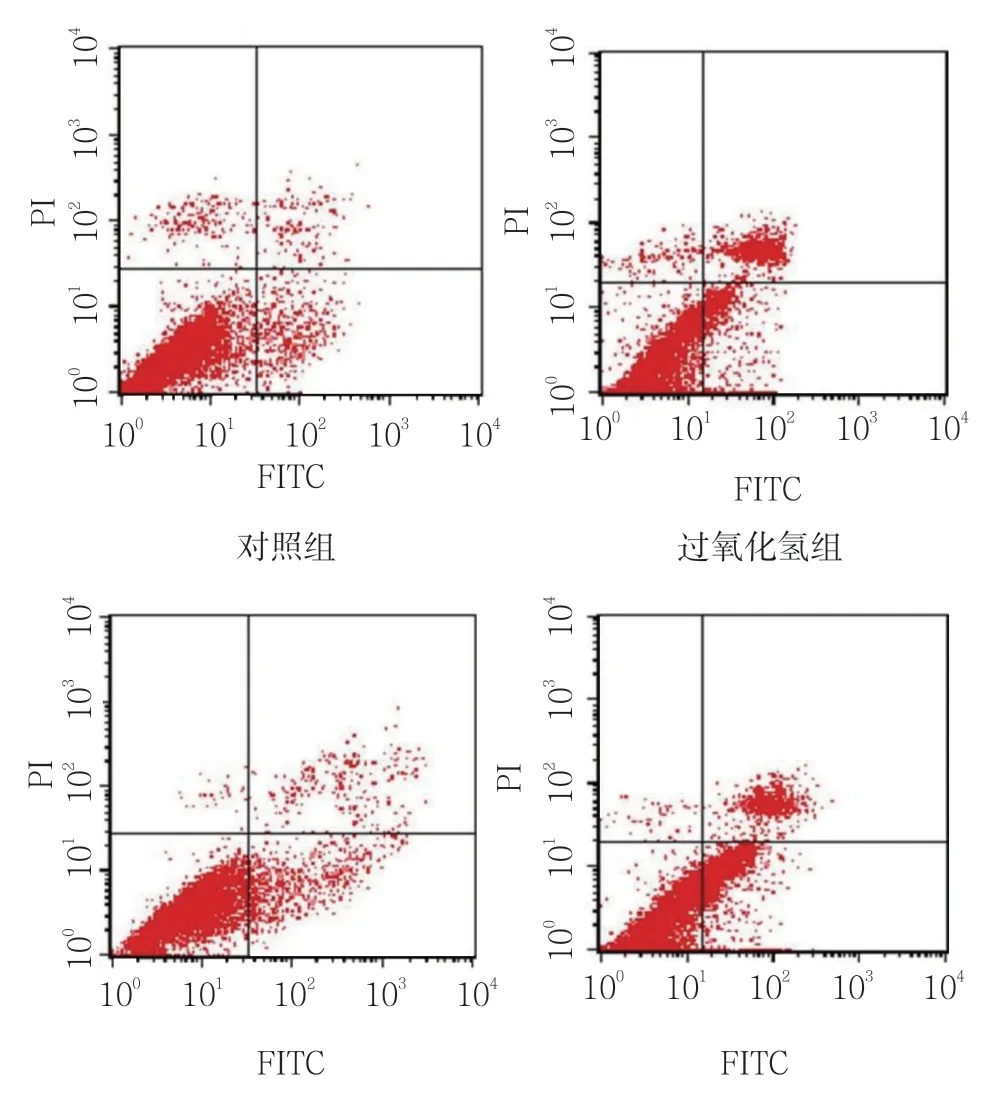
图3 N-乙酰半胱氨酸及CT-1 siRNA 对过氧化氢 诱导H9C2 细胞凋亡的影响
2.4 N-乙酰半胱氨酸对过氧化氢诱导Caspase-3活化的影响
Active Caspase-3 的表达表明过氧化氢可通过对CT-1 的过表达负反馈性地抑制H9C2 细胞的凋亡。见表4、图4和表5、图5。
2.5 PD98059 对过氧化氢诱导的CT-1 表达的影响
与对照组比较,过氧化氢可浓度依赖性地促进H9C2 细胞ERK 的活化(见表6和图6),而丝裂原活化细胞外信号调节激酶(MEK/ERK)特异性抑制剂PD98059 可显著抑制过氧化氢诱导的CT-1 表达上调(见表7和图7)。
表4 N-乙酰半胱氨酸对过氧化氢诱导Caspase-3 活化的影响 (±s)

表4 N-乙酰半胱氨酸对过氧化氢诱导Caspase-3 活化的影响 (±s)
注:1)与对照组比较,P <0.05;2)与200 μmol/L 过氧化氢组 比较,P <0.05
组别 Active Caspase-3 相对表达水平对照组 1.000±0.000 200 μmol/L 过氧化氢组 2.154±0.1941)N-乙酰半胱氨酸组 0.964±0.148 N-乙酰半胱氨酸+过氧化氢组 0.952±0.2082)F 值 40.721 P 值 0.000
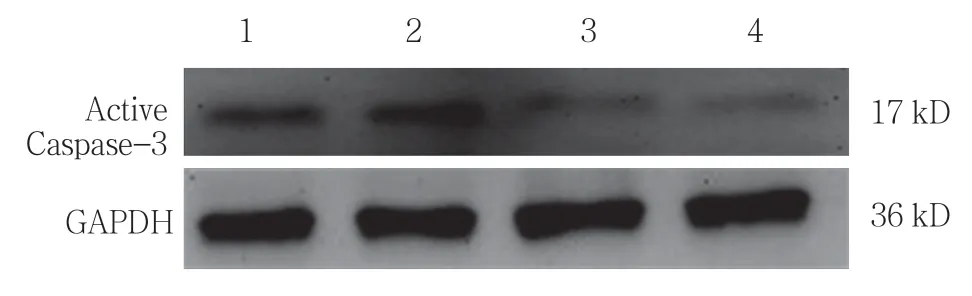
图4 N-乙酰半胱氨酸对过氧化氢诱导 Caspase-3 活化的影响
表5 CT-1 siRNA 对过氧化氢诱导Caspase-3 活化的影响 (±s)

表5 CT-1 siRNA 对过氧化氢诱导Caspase-3 活化的影响 (±s)
注:1)与对照组比较,P <0.05;2)与200 μmol/L 过氧化氢组比较,P <0.05
组别 Active Caspase-3 相对表达水平对照组 1.000 ± 0.000 200 μmol/L 过氧化氢组 1.846 ± 0.1571)CT-1 siRNA+过氧化氢组 2.591 ± 0.2432)F 值 68.059 P 值 0.000

图5 CT-1 siRNA 对过氧化氢诱导Caspase-3 活化的影响
3 讨论
成年心肌细胞属终端分化细胞,不具有再生增殖的能力。因此,心肌细胞的存活在维持心脏的功能和发育中起着极为关键的作用。当遇到各种伤害性刺激时,心肌细胞会通过自分泌或旁分泌等形式释放细胞保护因子,作为负反馈机制对抗各种损伤。
表6 过氧化氢对ERK 活化的影响 (±s)
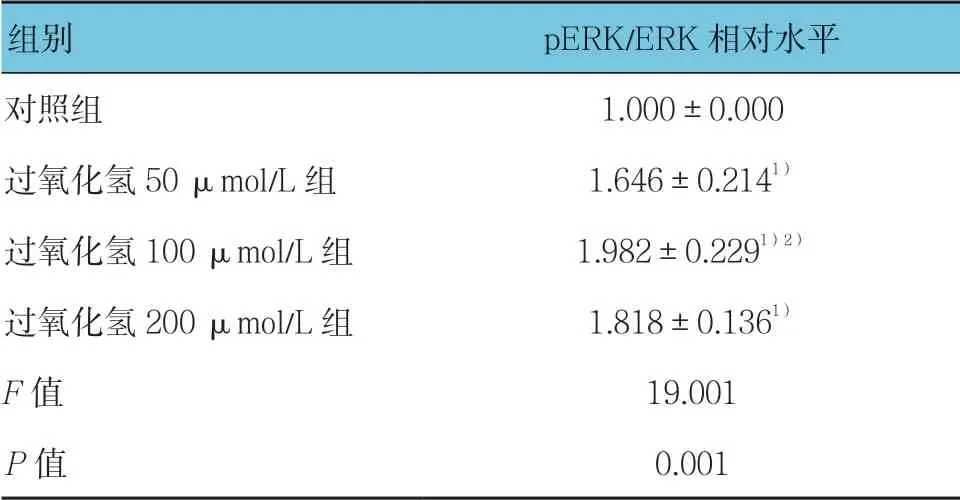
表6 过氧化氢对ERK 活化的影响 (±s)
注:1)与对照组比较,P <0.05;2)与50 μmol/L 过氧化氢组 比较,P <0.05
组别 pERK/ERK 相对水平对照组 1.000±0.000过氧化氢 50 μmol/L 组 1.646±0.2141)过氧化氢 100 μmol/L 组 1.982±0.2291)2)过氧化氢 200 μmol/L 组 1.818±0.1361)F 值 19.001 P 值 0.001
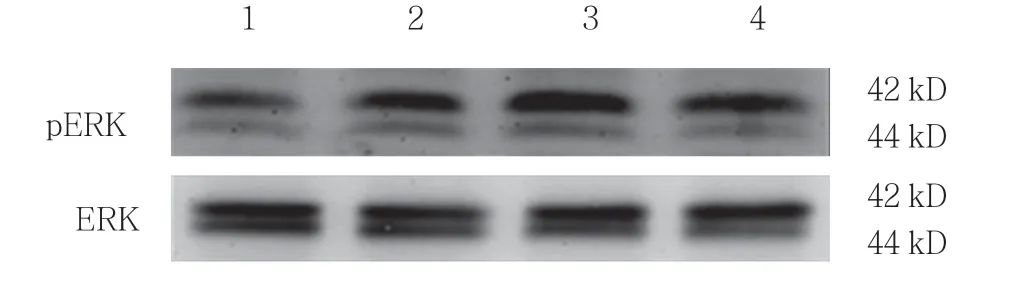
图6 过氧化氢对ERK 活化的影响
表7 PD98059 对过氧化氢诱导CT-1 表达的影响 (±s)
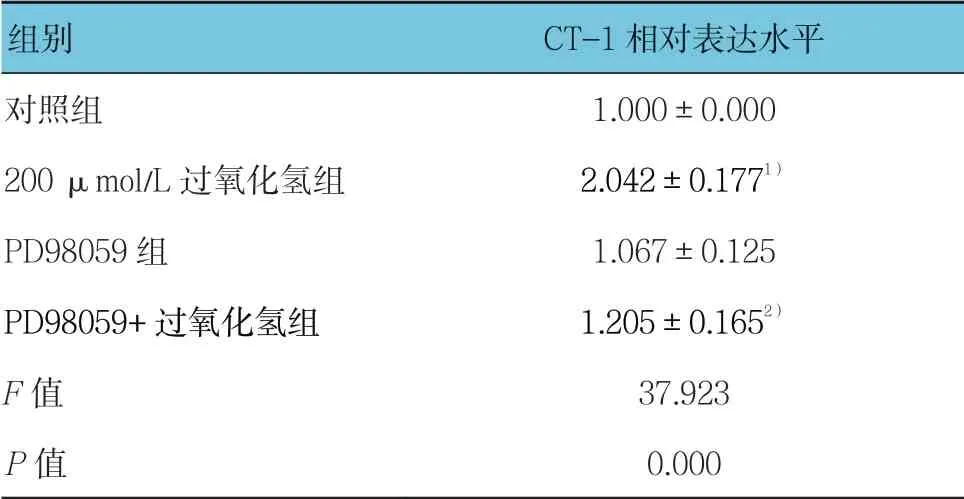
表7 PD98059 对过氧化氢诱导CT-1 表达的影响 (±s)
注:1)与对照组比较,P <0.05;2)与200 μmol/L 过氧化氢组比较,P <0.05
组别 CT-1 相对表达水平对照组 1.000±0.000 200 μmol/L 过氧化氢组 2.042±0.1771)PD98059 组 1.067±0.125 PD98059+过氧化氢组 1.205±0.1652)F 值 37.923 P 值 0.000

图7 PD98059 对过氧化氢诱导CT-1 表达的影响
CT-1 在血清剥夺[3]、热休克[4]、缺血再灌注损伤等[5]损伤中呈现心肌保护的特性。体外研究显示[5],在低氧状态下,心肌细胞CT-1 表达增加;体内研究也发现在不稳定性心绞痛[6]、急性心肌梗死[7]、高血压性心脏病等[8]病理状态下,外周循环中的CT-1 水平是增加的。但对于CT-1 在上述病理条件下如何升高,及其在疾病过程中发挥何种作用,目前尚不完全明确。
在缺血缺氧状态下,心肌组织会产生过量的ROS。这些ROS 攻击细胞的脂质、DNA 及蛋白质等生物大分子,并诱导心肌细胞发生凋亡[9-10]。本研究也发现,抗氧化剂N-乙酰半胱氨酸可显著抑制过氧化氢诱导的H9C2 心肌细胞活化Caspase-3 的表达及凋亡。既然缺血缺氧可以诱导CT-1 的过表达,就有理由推测ROS 增加有可能是诱导CT-1 过表达的的重要机制。本研究发现,过氧化氢可剂量依赖性地诱导CT-1 的过表达。而且,利用特异性siRNA 敲低CT-1 后,无论是活化Caspase-3 的表达还是细胞的凋亡率均较过氧化氢组显著增加,表明上述病理状态下由ROS 激发的CT-1 过表达起到一种负反馈性保护机制,起到对抗氧化性损伤本身所带来的细胞损伤的作用。这与DONG 等[11]报道的CT-1 处理能促进心肌细胞活力的结论相一致。
本研究进一步对过氧化氢诱导CT-1 表达的机制进行初步探讨。有研究显示,过氧化氢预处理能通过激活ERK 保护心肌细胞对抗氧化应激引起的损伤和凋亡[12]。笔者推测过氧化氢诱导的CT-1 过表达有可能与ERK 的活化有关。本研究发现,MEK/ERK 特异性抑制剂PD98059 能显著抑制过氧化氢诱导的CT-1过表达。由此可见,ERK 不光可以作为下游分子介导CT-1 的各种生物学活性[13],本研究也是首次发现ERK 可以作为上游分子介导CT-1 的过表达。对ERK如何能促进CT-1 的表达有待于进一步研究。
综上所述,本研究证实氧化应激在诱导心肌细胞发生凋亡性损伤的同时,可通过激活ERK 反馈性地诱导CT-1 的过表达,从而限制由氧化应激本身带来的心肌细胞损害。本研究不仅有助于进一步理解心血管疾病的病理生理机制,也可为疾病的防治提供新的线索。

