塞来昔布对辐射后鼻咽癌残癌细胞干细胞表型标志物表达影响
李菁菁, 姜 曈, 石 梅
空军军医大学附属第一医院 放射治疗科,陕西 西安 710032
国际癌症研究机构公布的数据显示,世界上每年约有8.65万新的鼻咽癌(nasopharyngeal carcinoma,NPC)患者[1],在东南亚尤其是中国是一种高风险的头颈部肿瘤[2-3]。因NPC解剖位置较深,手术切除复杂,且放射敏感性较高,放射治疗(radiotherapy,RT)已成为NPC的主要治疗方式[4]。随着RT技术和设备的不断提升,NPC患者存活率有所提高,但由于肿瘤的辐射抗性,部分NPC患者在治疗后2年内会出现局部复发及远处转移[5-6]。正常器官和组织中的成体干细胞通过自我更新,长期为最终分化的器官和组织提供细胞,使器官和组织维持其功能[7]。研究表明,许多癌症都是由具有干细胞特性的少量肿瘤细胞驱动,即肿瘤干细胞(cancer stem cells,CSCs)[8]。电离辐射(ionizing radiation,IR)可引起肿瘤微环境(tumor microenvironment,TME)的多种变化[9],可能促进放射抵抗、肿瘤复发和转移,以及其他的恶性表型。同时,炎症细胞刺激产生的细胞因子可启动CSCs的扩增,导致环境诱变和氧化损伤靶向的细胞池扩大,并在消除肿瘤后又重建肿瘤[10]。非甾体抗炎药(nonsteroidal anti-inflammatory drug,NSAIDs)可通过不同的机制抑制肿瘤发生发展[11]。环氧合酶2(cyclooxygenase 2,COX-2)可诱导肿瘤发生,促进肿瘤生长和进展,并与较高的转移风险、较差的存活率密切相关[12]。塞来昔布作为NSAIDs,是COX-2的特异性抑制剂,被认为具有多种潜在的抗肿瘤机制,可经过多重途径在肿瘤的发生、发展中起重要作用[13]。本研究通过2 Gy60钴(60Co) γ射线连续照射NPC的CNE-1细胞获得残癌细胞,并给予塞来昔布处理,探讨其对残癌细胞的干细胞表型标志物表达的影响,为NPC精准靶向治疗提供研究思路。现报道如下。
1 材料与方法
1.1 材料与试剂 人NPC的CNE-1细胞购自中国科学院上海细胞库。1640培养基购自美国Hyclone;胎牛血清(fetal bovine serum,FBS)购自杭州四季青;磷酸盐缓冲液(phosphate buffer saline,PBS)、RIPA裂解液(强)、Tween®20购自北京索莱宝;八聚体结合转录因子4(octamer-binding transcription factor 4,OCT4)引物、性别决定区Y框蛋白2 (SRY related HMG box-2,SOX2)引物、Kruppel样因子4(Kruppel-like factor 4,KLF4)引物、β-actin引物由北京奥科合成;总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒、SuperReal荧光定量预混试剂购自北京天根;塞来昔布购自美国Selleck;二甲基亚砜购自美国Sigma;CCK8试剂盒购自广州沛瑜;BCA蛋白定量试剂盒、蛋白预染marker购自美国Thermo;5倍Loading Buffer购自西安赫特;蛋白凝胶试剂盒购自武汉博士德;脱脂奶粉购自美国Difco;兔单克隆抗体OCT4、KLF4、SOX2购自美国Abcam;鼠单抗β-Actin购自美国CST;辣根过氧化物酶标记山羊抗兔IgG、辣根过氧化物酶标记山羊抗小鼠IgG购自美国Pioneer;ECL化学发光液购自美国Milipore。
1.2 仪器与耗材 CO2细胞培养箱、NanoDrop 2000购自美国Thermo;低温高速离心机购自德国Heraeus;台式常温离心机购自长沙湘仪;实时荧光定量聚合酶链式反应仪购自Bioneer;倒置光学显微镜购自日本Olympus;凝胶成像系统购自Bio-Rad;细胞培养板及培养瓶购自美国Eppendorf;PVDF膜购自美国Millipore。辐射源为60Co,由空军军医大学辐照中心提供。
1.3 研究方法
1.3.1 细胞培养 CNE-1细胞在含10% FBS的1640培养液中进行细胞培养,细胞培养条件为5% CO2、37℃。
1.3.260Co γ射线照射 在25 cm2细胞培养瓶中接种已进入对数生长期的CNE-1细胞,待细胞生长融合至40%~50%瓶底面积时,模拟临床肿瘤RT的分割疗法,单次照射剂量为2 Gy,剂量率1 Gy/min,连续隔日照射。连续7次照射CNE-1细胞获得残癌细胞株E-R7。
1.3.3 CCK-8实验 将接种的细胞按等比稀释成一个细胞浓度梯度,每组4~6个复孔。接种后,培养2~4 h使细胞贴壁,然后每100 μl培养基加10 μl的CCK-8试剂培养后测定光密度(optical density,OD)值,制作出标准曲线。根据标准曲线测定出样品的细胞数量。在96孔板中接种细胞悬液100 μl/孔,将培养板放在培养箱中预培养24 h;向每孔加入10 μl的CCK-8溶液,注意不要产生气泡;将培养板置于培养箱内孵育1~4 h;用酶标仪测定在450 nm处的吸光度;在96孔板中接种细胞悬液100 μl/孔,将培养板放在培养箱中预培养24 h;向培养板加入不同浓度的塞来昔布;将培养板在培养箱孵育适当的时间,向每孔加入10 μl的CCK8溶液;将培养板置于培养箱内孵育1~4 h;用酶标仪测定在450 nm 处的吸光度。
细胞存活率=[(实验孔吸光度-空白孔吸光度)/ (对照孔吸光度-空白孔吸光度)]×100%
1.3.4 实时定量聚合酶链式反应 PBS清洗细胞2次,使用总RNA提取试剂盒,按照天根DP419说明书提取总RNA。使用NanoDrop 2000在260 nm和280 nm处检测提取的RNA样品纯度及浓度。使用FastKing cDNA第一链合成试剂盒,按照天根KR116说明书进行反转录。使用SuperReal荧光定量预混试剂,按照天根FP205说明书进行实时定量聚合酶链式反应。引物序列:OCT4上游(5,-GTGGAGAGCAACTCCGATG-3,),下游(5,-TGCTCCAGCTTCTCCTTCTC-3,);KLF4上游(5,-CCGCTCCATTACCAAGAGCT-3,),下游(5,-ATCGTCTTCCCCTCTTTGGC-3,);SOX2上游(5,-CGAGTGGAAACTTTTGTCGGA-3,),下游(5,-TGTGCAGCGCTCGCAG-3,);β-actin上游(5,-CCTGGGCATGGAGTCCTGTG-3,),下游(5,-TCTTCATTGTGCTGGGTGCC-3,)。以β-actin snRNA为实时定量聚合酶链式反应检测OCT4、KLF4和SOX2表达的内参,通过2-ΔΔCT法计算各组细胞间表达差异。
1.3.5 免疫印迹 将细胞接种于25 m2培养瓶,待细胞融合至80%~90%时,吸弃培养液,用预冷PBS清洗细胞3次,培养皿、培养瓶置于冰上,加入强RIPA裂解液,冰上裂解30 min。细胞刮刷刮取并收集细胞,4℃ 12 000 g离心15 min,吸取部分上清,BCA蛋白定量试剂盒进行蛋白定量,剩余上清加入1/4体积的5倍Loading Buffer,金属浴100℃加热5 min;配制10% SDS-聚丙烯酰胺凝胶,20 μg蛋白样本/泳道,恒压电泳,上层胶电压80 V,下层胶电压120 V;恒流转膜,电流200 mA湿转120 min;用含5%脱脂奶粉的TBST,室温封闭PVDF膜1 h,封闭后洗膜3次,每次5 min。TBST稀释一抗OCT4(1∶1 000)、KLF4(1∶1 000)、SOX2(1∶1 000)、β-Actin(1∶1 000),孵育4℃过夜。次日清洗PVDF膜3次,5 min/次。TBST稀释二抗辣根酶标记山羊抗兔IgG(1∶1 000)、辣根酶标记山羊抗小鼠IgG(1∶1 000),室温孵育2 h 。孵育后用TBST清洗PVDF膜3次,5 min/次。膜上滴加适量化学发光液,利用凝胶成像系统曝光成像。以β-Actin为内参,通过Image J软件计算条带的灰度值,比较细胞间OCT4、KLF4和SOX2表达水平差异。
2 结果
2.1 塞来昔布药物浓度筛选 E-R7细胞进行CCK-8实验,绘制标准曲线见图1。当吸光值为1时,得出最佳种植细胞数为2.2×104个/孔。按照最佳细胞数将E-R7细胞种植入96孔板中,进行CCK-8实验。根据公式计算细胞存活率,并绘制曲线图,见图2。当存活率为50%时,塞来昔布半抑制浓度为131 μM。
2.2 E-R7细胞干细胞表型标志物表达情况 按照塞来昔布半抑制浓度,给予E-R7细胞塞来昔布处理。实时定量聚合酶链式反应测定结果显示,塞来昔布处理后,E-R7细胞中干细胞表型标志物SOX2、OCT4、KLF4的mRNA表达水平较未处理的E-R7细胞明显降低,差异有统计学意义(P<0.05),见表1。免疫印迹检测结果显示,塞来昔布处理后,E-R7细胞中干细胞表型标志物SOX2、OCT4、KLF4的蛋白表达水平较未处理的E-R7细胞明显降低,差异有统计学意义(P<0.05),见表2、图3。
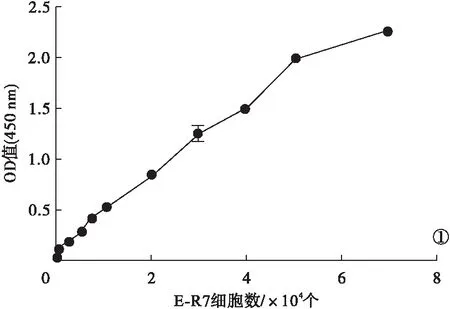
图1 E-R7细胞CCK-8实验标准曲线
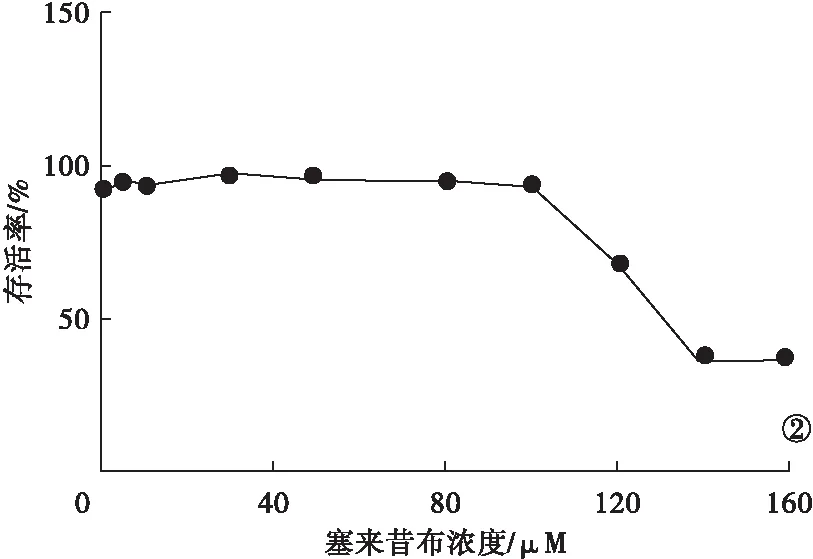
图2 E-R7细胞CCK-8存活-浓度曲线
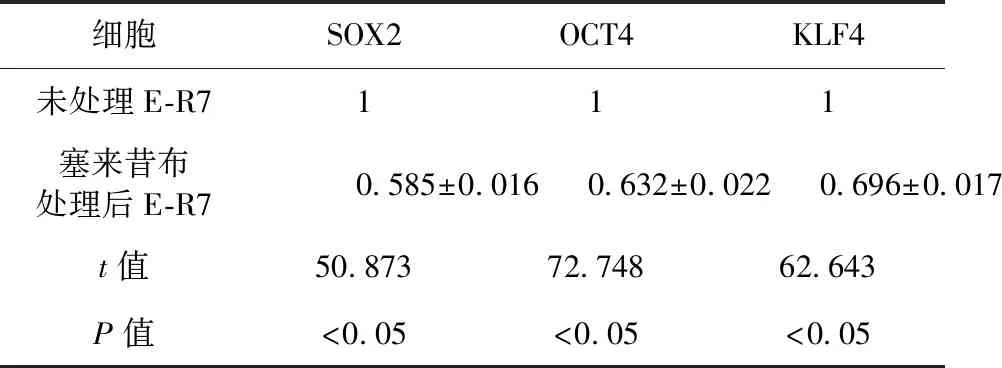
细胞SOX2OCT4KLF4未处理E-R7111塞来昔布处理后E-R70.585±0.0160.632±0.0220.696±0.017t值50.87372.74862.643P值<0.05<0.05<0.05
表2 E-R7细胞干细胞表型标志物蛋白相对表达量
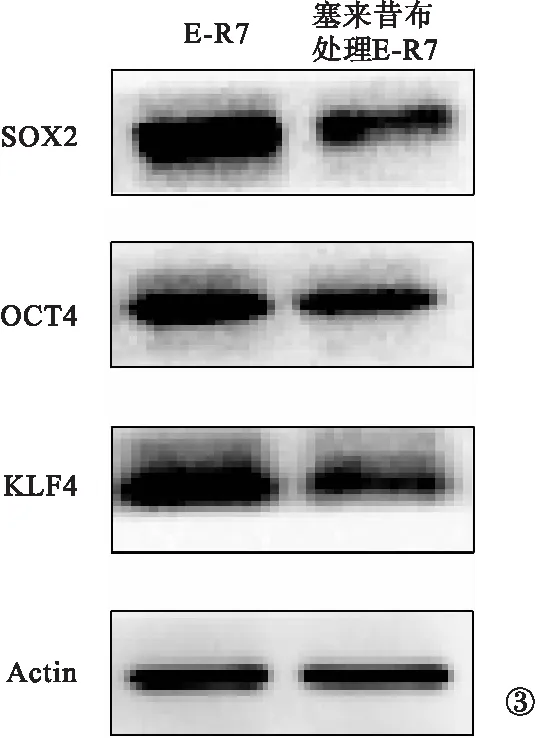
图3 E-R7细胞干细胞表型标志物蛋白表达
3 讨论
癌症包含不同种类的基质细胞群,支持癌细胞群基因层面的分化,由已分化的细胞和少数CSCs组成,具有自我更新的干细胞特性,能够重新填充整个肿瘤,维持肿瘤增殖,促进癌症的进展和转移[14-15]。鉴于CSCs的功能特点,治疗后存活的CSCs可能导致肿瘤复发。研究表明,CSCs的数量与对辐射的反应呈负相关,表明CSCs是肿瘤辐射抵抗和复发的关键[16]。此外,非CSCs对CSCs性质的重新获得以及对TME变化的适应性反应影响CSCs介导的外源性辐射抗性[17-18]。因此,RT需要通过靶向CSCs药物进行生物改良,以提高放射反应并防止长期复发。CSCs既可直接被干细胞表型标志物的特异性抗体靶向,也可通过靶向其功能的机制来抑制辐射抗性,以上策略可提高患者RT后的存活率。
目前,在干性表型的核心调控因子中,SOX2被认为是核心多功能相关转录因子的关键分子之一,在胚胎干细胞和神经干细胞的自我更新和干性的维持中起到积极作用,且参与体细胞重新编程成诱导多能干细胞的过程[19-21]。有研究证实,SOX2在癌症中具有致癌作用,其高表达是多个CSCs样表型的关键,已在多种预后较差的癌症中被发现[22-24]。SOX2阳性的肿瘤细胞作为肿瘤生长的起始群体,具有启动和增殖肿瘤生长的能力,并在不同的肿瘤类型中产生分化细胞的多样性,从而促进肿瘤的恶性发展。因此,抑制SOX2可能是一种新的、更有效的减少NPC在RT后复发和转移的辅助治疗方式。
COX-2在肿瘤发生、发展过程中起着重要作用[25]。塞来昔布作为一种选择性COX-2抑制剂,被认为具有多种潜在的抗肿瘤机制,包括抑制增殖、诱导凋亡、免疫调节、调节TME、抗血管生成作用等。塞来昔布与莪术酚联合应用,在体内外均可明显降低非小细胞肺癌的生长和凋亡[26]。研究报道,包括塞来昔布在内的联合用药可显著提高治疗的总体反应率[27];在晚期非小细胞肺癌的化疗中加入塞来昔布可提高总体反应率[28]。塞来昔布联合化疗提高COX-2阳性胃癌患者的总体存活率、无病存活率和生活质量,但未增加不良事件的风险[29]。
本研究中,通过CCK-8实验,测定塞来昔布对CNE-1残癌细胞半抑制浓度为131 μM。实时定量聚合酶链式反应、免疫印迹结果显示,塞来昔布可降低NPC残癌的干细胞表型标志物OCT4、KLF4和SOX2的表达。说明塞来昔布不仅与降低癌症发病率有关,而且与改善癌症患者的预后有关。然而,塞来昔布作为癌症患者新辅助治疗的有效性数据还不充分,对塞来昔布产生更好结果的因素仍有待进一步研究。此外,鉴于癌症患者对塞来昔布反应的潜在差异,确定其使用目标人群至关重要。
综上所述,塞来昔布可抑制经2 Gy60Co γ射线连续照射的CNE-1细胞获得的残癌细胞干细胞表型标志物SOX2、OCT4、KLF4的表达。

