黄酒对健康大鼠肥胖相关指标的影响
王丽媛,秦 文,霍军生,卓 勤,杨 倬,王晶波,沈 葹,李 岩*
(中国疾病预防控制中心 营养与健康所,北京 100050)
黄酒作为中国传统酿造酒的代表,最早可追溯到夏商时期,古人利用酒曲复式发酵法制作黄酒[1]。因此,黄酒与葡萄酒、啤酒并称“世界三大古酒”,享有“国酒”的美誉[2]。黄酒在诸多史料和文学作品中都有记载,如书圣王羲之于曲水流觞之际醉书“天下第一行书”的《兰亭集序》;南宋诗人陆游吟诵当时的绍兴酿酒业的“城中酒垆千百家”;近代鲁迅笔下的咸亨酒店,呈现了诸多中国黄酒的传统典故和传统文化[3]。
现代研究发现,黄酒中含有丰富的蛋白质、氨基酸、活性肽、酚类、低聚糖、维生素、矿物质等基本营养成分以及γ-氨基丁酸、多酚类物质、生物活性肽、功能性低聚糖、Monacolin K等具有特殊生物活性的功能性物质,具有抗衰老、降血压、降胆固醇和免疫调节的生理功效[4]。
肥胖已成为当今全球性健康问题之一,易引发高血压、冠心病、血脂异常等多种慢性疾病,成为危害大众健康水平和生活状态的重要原因。尽管黄酒有诸多保健功能,但黄酒同啤酒一样,常被称为“液体面包”[5],饮用黄酒能否引起肥胖成为人们关注的问题。因此,本实验进行了黄酒与健康大鼠肥胖相关指标体质量、血脂及肠道菌群的初步研究,揭示黄酒与机体肥胖的相关性。
1 材料与方法
1.1 材料与试剂
无特定病原体(species pathogen free,SPF)级SD雄性大鼠(共24只,体质量(200±20)g):斯贝福(北京)生物技术有限公司[生产许可证:SCXK(京)2014-0006]。
黄酒(绍兴黄酒,三年陈酿,酒精度15%vol):市售;食用酒精(普通级,酒精度95%vol):市售。
肠道细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:深圳华大基因科技有限公司。
1.2 仪器与设备
RV10V-C旋转蒸发仪:德国IKA公司;ME403E天平:瑞士梅特勒公司;AC2-4S1生物安全柜:新加坡ESCO公司;5427R高速冷冻离心机:德国EPPENDORF公司;全自动生化分析仪7600系列:日本HITACHI公司;Illumina HiSe2500测序仪:美国Illumina公司;NANO DROP紫外分光光度计:美国Thermo公司。
1.3 方法
1.3.1 动物实验
动物饲养于中国疾病预防控制中心南纬路动物实验室,许可证号SYXK(京)2009-0032,室温20~26℃,相对湿度40%~70%,12 h光照,12 h黑暗。动物适应3 d后根据体质量随机分为黄酒组、酒基对照组和空白对照组,每组动物各8只。黄酒组动物灌胃黄酒,酒基对照组动物灌胃15%酒基(95%食用酒精调配),空白对照组灌胃蒸馏水,灌胃量均为10 mL/kg体质量,连续灌胃35 d。实验期间动物自由进食和饮水,三组动物均给予基础饲料,每周称质量一次,并调整灌胃量。实验结束时,大鼠禁食24 h,眼眶采血,离心收集血清待测;解剖取肝脏称质量;取各组动物粪便-80℃冷冻保存待测。
动物实验已通过中国疾病预防控制中心营养与健康所伦理审查。
1.3.2 血液生化测定
采集的大鼠血液3000r/min离心15min,分离血清,采用全自动生化分析仪测定血清中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high desity lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low desitylipoproteincholesterol,LDL-C)指标。
1.3.3 肠道菌群高通量测序分析
采用华大基因研发的肠道细菌DNA提取试剂盒对各大鼠粪便样品进行DNA提取,并使用通用引物515F(5"-GTGCCAGCMGCCGCGGTAA-3")和806R(5"-GGACTACHVGGGTWTCTAAT-3")对16S rDNA的V4区进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。
应用IlluminaHiSe2500平台对PCR产物进行测序,测序类型为PE250。下机数据滤除低质量的reads,获得cleandata。使用软件FLASH(Fast Length Adjustment of Short reads,v1.2.11),将双末端测序得到的reads拼接成Tags,利用软件USEARCH(v7.0.1090)将优化好的Tags在97%的相似度下聚类为分类操作单元(operational taxonomic units,OTU),用于物种注释、物种复杂度分析以及组间物种α-多样性分析。
1.3.4 统计学方法
数据分析采用软件SPSS 16.0处理,各组以变异数进行方差分析,数据用均数±标准方差(x¯±s)表示,P≥0.05无显著差异,0.01≤P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 黄酒对大鼠体质量的影响
由表1可知,灌胃35 d后的黄酒组大鼠与空白对照组相比,体质量增量未见显著差异(P≥0.05)。有文献表明[6],50.0 mL/kg体质量剂量的黄酒在维持动物体质量方面具有一定作用。本研究中动物直接灌胃黄酒,浓度较低,并未见明显作用,但黄酒组大鼠体质量增量较空白对照组有下降的趋势。在实验过程中,各组大鼠均保持正常饮水进食,精神状态良好。

表1 各组大鼠体质量检测结果Table 1 Determination results of body mass of different groups of rats g
2.2 黄酒对大鼠血脂的影响
由表2可知,实验结束时,黄酒组大鼠血清中TC、TG、HDL-C和LDL-C的含量与空白对照组相比差异均不显著(P≥0.05),TG含量较空白对照组有升高的趋势,但该值在0.77~2.10 mmol/L正常监测范围内,酒基对照组动物结果同黄酒组。说明限量饮酒不会对血脂产生不良影响,但长期饮酒可能会引起TG水平上升。

表2 各组大鼠血脂指标检测结果Table 2 Determination results of blood lipid indexes of different groups of rats mmol/L
2.3 黄酒对大鼠肠道菌群的影响
2.3.1 黄酒对大鼠肠道微生物菌群α-多样性的影响
肠道微生物多样性是促进营养物质吸收、维持机体免疫和新陈代谢的基础,多样性降低极易对宿主免疫产生影响,进而影响健康[7]。各组样品所有序列按照97%的相似度进行OTU聚类,利用程序运算得到评价微生物Alpha多样性(Alpha diversity)丰度。Alpha多样性是对单个样品中物种多样性的分析[8],包括Observed-species指数、Chao指数、Ace指数、Shannon指数及Simpson指数,前面4个指数越大,最后一个指数越小,说明样品中的物种越丰富。物种丰富度相同的情况下,群落中各物种均匀度越大,群落多样性越大[9]。表3结果表明,黄酒组Observed-species指数、Chao指数、Ace指数与空白对照组相比差异显著(P<0.05),Shannon指数和Simpson指数没有显著差异(P≥0.05)。由此推断,黄酒对大鼠肠道菌群α-多样性没有显著影响(P≥0.05)。
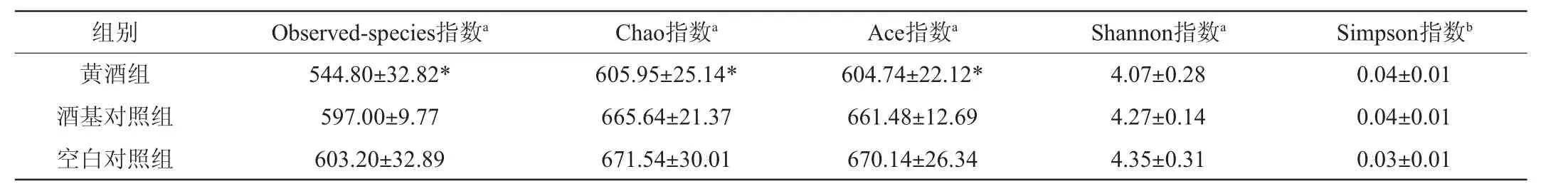
表3 大鼠肠道菌群α-多样性统计分析Table 3 Alpha diversity statistical analysis of gut microbiota in rats
2.3.2 黄酒对大鼠肠道菌群门水平丰度的影响
各组样品共产生938个OTU,被注释到7个细菌门类,分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、柔膜菌门(Tenericutes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和迷踪菌门(Elusimicrobia),各组菌群组成和比例如图1所示。

图1 各组大鼠肠道菌群在门水平上的注释结果Fig.1 Annotation results of gut microbiota in different groups of rats based on phylum-level
在肠道菌群中影响能量代谢平衡的两个主要群落是拟杆菌门和厚壁菌门,已经有研究表明,该两种菌的含量和比例可作为判定肥胖潜在可能的依据[10-12]。XIE W等[13-14]研究发现,瘦的动物或者人与肥胖的对照组相比,具有更多的拟杆菌门和较少的厚壁菌门。由图1可知,与空白对照组相比,黄酒组拟杆菌门上升了15%,厚壁菌门下降了16%,而酒基对照组与空白对照组相比,拟杆菌门下降了27%,厚壁菌门上升36%。结合2.1中的结果分析推测,健康大鼠体质量增加缓慢的趋势可能与黄酒改变了厚壁菌门和拟杆菌门含量有关。
2.3.3 黄酒对大鼠肠道菌群属水平丰度的影响
在属的水平上各组样品主要注释到21种菌,分别是不动杆菌属(Acinetobacter)、嗜粘蛋白-艾克曼菌属(Akkermansia)、Anoxybacillus属,拟杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、梭菌属(Clostridium)、粪球菌属(Coprococcus)、Corynebacterium属、Geobacillus属、乳杆菌属(Lactobacillus)、甲烷短杆菌属(Methanobrevibacter)、颤螺旋菌属(Oscillospira)、考拉杆菌属(Phascolarctobacterium)、普雷沃氏菌(Prevotella)、氏菌(Roseburia)、瘤胃球菌属(Ruminococcus)、八联球菌属(Sarcina)、Sutterella属、Turicibacter属、02d06菌属及rc4_4菌属。各组菌群组成及比例如图2所示。

图2 各组大鼠肠道菌群在属水平上的注释结果Fig.2 Annotation results of gut microbiota in different groups of rats based on genus-level
由图2可知,黄酒组、酒基对照组和空白对照组中,普雷沃氏菌(Prevotella)丰度相对较高,其次是乳杆菌属(Lactobacillus)和瘤胃球菌(Ruminococcus)。与空白对照组相比,黄酒组中双歧杆菌属、嗜粘蛋白-艾克曼菌属和拟杆菌属含量分别上升122%、76%、123%。黄酒组与酒基对照组相比,上述3个菌属含量分别上升79%、126%、38%。黄酒中含有的功能性低聚糖可以被肠道内的双歧杆菌利用,促进双歧杆菌增殖,增强机体免疫力[15]。双歧杆菌是构成肠道定殖抗力的主要细菌之一,其代谢产物主要是有机酸,引起肠道pH值下降,抑制了肠道致病菌如金黄色葡萄球菌、大肠杆菌、痢疾杆菌、艰难梭菌及沙门氏菌等的生长繁殖,而自身的生长不受抑制,维持了肠道菌群的相对平衡[16-17]。DAO M C等[18-20]研究表明,嗜粘蛋白-艾克曼菌(Akkermansia muciniphila)是肠道中的一种黏蛋白降解菌,在肥胖及相关代谢疾病(如糖尿病)中具有关键作用,可以调节人体能量平衡及脂代谢水平,其组成比例与宿主的健康之间存在正相关。有研究表明,拟杆菌在帮助宿主分解多糖、加快肠粘膜血管形成以及提高宿主免疫力、维持肠道微生态平衡等方面起到了重要作用[21-22]。结合2.1中的结果推测,黄酒组动物体质量增量缓慢的趋势可能与艾克曼菌属和拟杆菌属组成比例呈正相关。
3 结论
黄酒对健康大鼠体质量没有明显降低的作用(P≥0.05),但对大鼠体质量增加有减缓的趋势。在实验周期内,黄酒对健康大鼠血清中TC、TG、LDL-C和HDL-C含量没有显著影响(P≥0.05)。在门水平上,黄酒能够上调厚壁菌门并下调拟杆菌门的组成比例;在属的水平上,黄酒能够上调双歧杆菌属、嗜粘蛋白-艾克曼菌属和拟杆菌属的组成比例,推测黄酒能够改变与体质量有关的大鼠肠道菌群组成比例,并对改善宿主肠道菌群结构有促进作用。

